2019年3月14日,美国食品药品监督管理局终于将MitraClip(雅培)的适应证扩展至药物治疗不佳,中度至重度功能性二尖瓣关闭不全(MR)的心力衰竭(HF)患者。
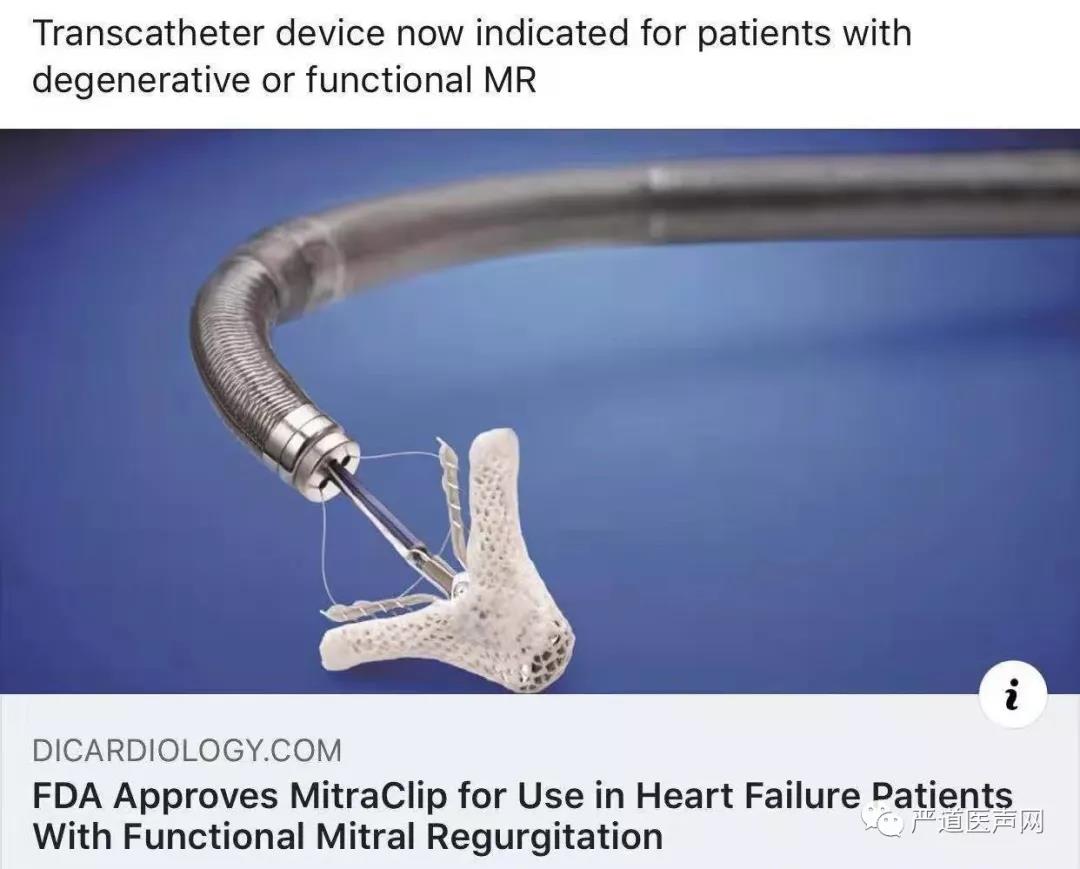
这项决定是在TCT 2018年会议上提交的610例COAPT试验之后作出的,该试验表明,对于心力衰竭和严重功能性MR患者使用经皮夹式手术进行经导管二尖瓣修复不仅显著减少了主要终点HF再入院,而且能够显著降低2年死亡率。
相关专家也指出“将该装置的批准扩大到药物未能缓解症状的患有严重继发性二尖瓣返流的心力衰竭患者,提供了一种重要的新治疗选择,但专家团队的仔细评估对于确定特定患者是否适合该手术是至关重要的。”
COAPT和MITRA-FR几乎同时发布,鉴于MITRA-FR试验中MitraClip缺乏益处,有专家认为有必要进行第三次试验“打破平局”试验,相关试验RESHAPE-HF 正在进行当中。
在COAPT中,主要疗效终点 - 超过24个月的所有住院治疗 - MitraClip组较常规医疗护理组显著降低。住院率年化率分别为35.8%和67.9%(P <0.001)。每个方案,意向治疗和治疗分析的结果与总体结果非常相似。
在COAPT中,心力衰竭的死亡或再住院也是MITRA-FR的主要终点(在MITRA-FR中测量为1年,在COAPT中为2年),MitraClip组为45.7%,而常规医疗组为67.9%。统计上存在显著差异。
首席研究员、医学博士Gregg W. Stone(NewYork-Presbyterian /哥伦比亚大学欧文医学中心,纽约)就此在TCTMD发表了评论。
“我们很高兴FDA尽快给予MitraClip继发性严重二尖瓣反流患者的指征。” “正如COAPT所证明的那样,这种疗法可以显著延长生存期,预防住院治疗,并改善数万名患者的生活质量。”
美国食品药品监督管理局公告强调,有650万美国成年人患有心力衰竭,这些患者中有一部分患有中度至重度或严重的“继发性”二尖瓣关闭不全。美国食品药品监督管理局表示,“通过这项新的批准,这一部分患者可以作为MitraClip的适应人群并和最佳的药物治疗相结合,从而改善症状及预后。”
MitraClip先前于2013年被批准用于治疗退行性(“原发性”)二尖瓣关闭不全,这是MR患者人群的一小部分。绝大多数患者为继发于心肌梗死或高血压等的继发性二尖瓣反流,往往这部分病人更重,更缺乏外科治疗的指征,吴永建教授在去年ESC年会上发表ChinaDVD研究指出,与欧美国家大多以退行性主动脉瓣膜狭窄为主不同,我国瓣膜性心脏病患者则以不同程度的二尖瓣返流为主,其比例高达30%,且其中相当一部分为继发性二尖瓣返流。由葛均波教授牵头中国自主研发的VALVECLAMP用于原发性二尖瓣关闭不全试验正在进行,相信FDA批准MitraClip用于继发性二尖瓣关闭不全患者将使更多患者受益。
作者:刘巍 高雅楠 北京安贞医院