心房颤动导管消融围手术期的抗凝治疗
2015-07-18 10:52
摘要:
目前,经皮导管消融已经成为心房颤动(房颤)的重要治疗手段,然而,由于术式复杂、损伤范围大,如何通过有效的抗凝治疗以降低围手术期血栓风险至关重要,是房颤导管消融的基础。本文重点针对围手术期抗凝治疗的策略进行阐述,主要包括术前血栓风险的评估、围手术期抗凝方案及强度的选择等,尤其是在血栓或心包压塞等出血等并发症发生时的处理,这不仅包括及时的对症处理以及血流动力学的监测与维持,更要随时调整抗凝强度以及针对性的使用抗凝拮抗措施,而后者需要对于凝血系统、抗凝系统及纤溶系统具有系统、深入的了解。
关键词:
心房颤动;导管消融;抗凝;血栓栓塞
目前,经皮导管消融已经成为心房颤动(房颤),特别是对抗心律失常药物治疗无效、无法耐受房颤症状且无明显器质性心脏病患者的一线治疗手段[1, 2]。然而,由于术式复杂、损伤范围大,围手术期并发症,特别是出血和栓塞事件的发生率也较高[3]。因此,房颤导管消融的围手术期抗凝治疗对于降低消融风险来说至关重要,临床应当给予足够重视,但一旦发生出血、血肿等并发症时,基础抗凝治疗通常会使临床情况进一步恶化。因此,如何灵活掌握房颤导管消融围手术期的抗凝治疗原则及发生手术并发症时的拮抗措施及下一步处理具有非常重要的临床意义。
一、 术前准备:
1. 血栓风险的评估:
术前进行经食道超声(TEE)、左房CT检查筛查左房或左心耳内血栓情况,并了解肺静脉与左房的解剖关系,对于避免术中左房血栓脱落引起栓塞、指导消融策略等具有重要作用。研究证实,应用TEE对拟行房颤消融且经过系统性抗凝治疗患者的左房血栓检出率为1.6%-2.1%[4-6],并且左房血栓的检出与CHADS2评分直接相关,在CHADS2为0分的患者中,左房血栓的检出率≤0.3%,而在CHADS2≥2分的患者中,左房血栓的检出率>5%,其他的危险因素还包括左房大小和持续性房颤。然而,是否应当对所有拟行房颤消融术患者均进行TEE检查,以及应对哪些患者进行术前的常规TEE筛查,目前尚无统一意见,2012年美国心律学会(HRS)、欧洲心律协会(EHRA)和欧洲心律失常学会(ECAS)联合颁布的房颤导管、外科消融专家共识(以下简称专家共识)提出对房颤持续≥48小时或未知时间者均应采用TEE排除左房血栓,而对窦律或房颤持续<48小时者则无强制要求[1]。
关于左房多排CT在筛查左房血栓中的精确性,不同研究的结果相差较大。Gottlieb等的研究表明[7],左房64排CT在筛查左房血栓中的精确性不及TEE,且不同阅片者之间的结果相差甚大,这与图片质量、难以鉴别梳状肌与血栓有关;而Patel等则提出左房CT在检测左心耳血栓中具有良好的灵敏度,但特异度中等[8],因此左房CT在排除左房血栓中的价值有待进一步探讨。目前通常推荐经食道超声为鉴别心房血栓的金标准。
此外,由于导管消融的过程涉及深静脉穿刺置管等有创操作,为防止围手术期肺栓塞的发生,术前对下肢深静脉血栓(VTE)的筛查也是相当必要的。D-二聚体对于VTE的阴性预测值可达99%[9],因此,是临床常用于筛查VTE的指标,对于D-二聚体阳性的患者应酌情采用下肢血管超声、肺动脉CT、肺通气灌注扫描对VTE进行确定诊断[10, 11]。对于确诊深静脉血栓形成或肺栓塞的患者,应先行系统性抗凝治疗,待血栓消失后择期进行房颤消融术。
2. 术前抗凝治疗策略的选择:
在导管消融术中及术后的数周至数月,房颤患者的血栓栓塞风险显著升高[12, 13],因此,抗凝治疗理论上应贯穿于房颤导管消融围手术期的全程,合理地选择抗凝策略对于减少出血、栓塞事件的发生是至关重要的。
由于多数接受导管消融治疗的患者已经有较高的血栓栓塞风险,而多项房颤指南推荐对于血栓中、高危的房颤患者(基于CHADS2、CHA2DS2-VASc评分或栓塞危险因素)均应采用口服抗凝药物进行系统性抗凝治疗[14-17],因此,这些患者在术前应当接受系统的抗凝治疗(华法林、直接凝血酶抑制剂或Xa因子抑制剂)[18-21];对于血栓低危患者可酌情选用阿司匹林进行抗血小板治疗[14-16]。专家共识推荐,对于房颤持续时间≥48小时或未知持续时间者,在术前应进行≥3周的系统性抗凝治疗[1]。关于房颤导管消融围手术期的常用抗凝策略有以下几种:
1) 肝素桥接治疗:
目前,肝素桥接治疗仍然是多数中心广泛采用的抗凝治疗方式[22],也是2007年HRS/EHRA/ECAS颁布的专家共识规定的传统术前抗凝策略[23]。所谓“桥接”是指在术前数天开始采用华法林与低分子肝素(LWMH)重叠治疗,在术前3-5天停用华法林开始单用LWMH,手术当日清晨停用LWMH[6, 12, 24]。然而一些研究显示,这种抗凝方式会增加围手术期出血并发症,特别是穿刺部位出血的风险[3, 25-27],因此,有学者提出在房颤消融围手术期不停用华法林的抗凝策略[24, 25, 28]。
2) 华法林连贯治疗:
近来,几项研究提出了在房颤消融围手术期持续应用华法林治疗的抗凝策略,在一些中心得到应用[20, 28-31],与LWMH桥接治疗相比,该策略不仅简化了操作流程,更重要的是明显降低了围手术期血栓栓塞和出血并发症的风险[24, 30, 32, 33],同时,多项研究表明,术前INR在2.0-2.5之间可以在不明显增加出血风险的基础上有效降低血栓栓塞风险[29, 34],因此2012年欧洲心脏病协会(ESC)颁布的房颤指南中也对该策略进行了规定,并提出手术当日的目标INR为2.0-2.5[15]。
需要特别注意的是,由于肝素和华法林的抗凝机制不同(图1),针对它们采取拮抗措施的效果也各异。对于采用肝素桥接治疗的患者发生出血并发症后,首选硫酸鱼精蛋白进行拮抗,其作用迅速,数分钟之内即可使活化的凝血时间(activated clotting time, ACT)下降,相对安全有效。然而,对于采用华法林该抗凝的患者,一旦发生出血并发症,特别是心包压塞等急症后,往往缺乏及时、有效的拮抗手段。由于术前长期口服华法林已经严重干扰了维生素K依赖性凝血因子(Ⅱ,Ⅶ,Ⅸ,Ⅹ)的合成,从而导致其绝对缺乏,人体需要重新合成新的凝血因子来改善凝血功能。因此,即使静脉补充维生素K,其拮抗作用也需要2-3天才能得以发挥,因此,必要时及时给予凝血酶原复合物可以迅速补充耗竭的凝血因子,尽快恢复凝血机制。
3) 新型口服抗凝药物治疗:
新型口服抗凝药物(直接凝血酶抑制剂或Xa因子抑制剂)应用于房颤患者的系统性抗凝治疗具有良好的安全性和有效性[18, 19],但是在房颤导管消融围手术期应用这些药物的临床证据较少,其安全性和有效性尚待进一步阐明。
二、 术中抗凝处理:
房颤消融术相关血栓栓塞事件的发生率为0.5-4.0%,其中缺血性卒中为0.23%,TIA为0.71%[12, 29, 35],而大多数栓子是在房间隔鞘管或电极导管刚进入左房时形成的[36-38],因此,应用肝素的时机应当是房间隔穿刺之前或即刻。为了保证达到并维持肝素化的效果,术中监测ACT极为必要,有限的临床资料表明,术中维持ACT水平在300-400s之间可以有效减少血栓形成[39]、血栓栓塞事件[40]及无症状性栓塞的发生[41]。2012专家共识也对此做出相应规定,在给予负荷量肝素后,应使ACT达到300-400s,此后应每30分钟测定一次,并酌情补充肝素,使手术全程的ACT维持在300-350s之间[1]。另外,对于术前未停用华法林的患者,术中的抗凝原则同肝素桥接治疗的患者[1],术前应测定ACT的基础值,术中应给予相对低剂量的肝素,使ACT达到并维持在350s[42]。消融完成后,可应用硫酸鱼精蛋白拮抗肝素的抗凝活性,使ACT下降至200-250s内即可拔除股静脉鞘管[1]。
由于国内尚缺乏该方面的研究,所以目前的抗凝强度是参照欧美指南进行的,但国人与欧美人种的凝血体质、对抗凝药物耐受程度的不同,欧美指南所提出的抗凝强度是否适合国人体质也存疑,因此,仍然有待进一步的大规模研究来提供关于国人术中抗凝治疗强度的高级别证据。
三、 术后抗凝治疗:
在消融治疗当天就应开始口服华法林进行抗凝,并使INR尽快达标。对于接受肝素桥接治疗的患者,在拔除股静脉鞘管后4-6小时开始应用华法林和LWMH重叠治疗,直到INR升高至治疗窗(2.0-3.0)后开始停用LWMH;对于未中断华法林的患者,术后无需使用LWMH,继续应用华法林,使INR维持在2.0-3.0即可[1]。
房颤消融术后晚发的血栓栓塞事件同样值得关注[43],目前的指南规定,在房颤术后,应口服华法林抗凝至少2个月,而对于卒中高危患者(推荐应用CHADS2或CHA2DS2-VASc评分),则应长期口服华法林以预防卒中的发生[1, 15, 44]。
四、 急性并发症处理中抗凝治疗的原则:
房颤导管消融术操作复杂、风险也相对较大,根据一项世界范围内的房颤消融调查结果[3],并发症的总发生率为5.9%,其中严重并发症发生率为2.2%,死亡率为0.05%。目前,房颤消融的主要并发症包括穿刺部位血管并发症、心包压塞、脑卒中及TIA、心房食管瘘、肺静脉狭窄、术后快速型房性心律失常等。
1. 心包压塞:
房颤消融术所致心包压塞的发生率为1.2-2.4%[3, 35, 45, 46],迟发性心包压塞(房颤消融术后1小时以后发生的心包压塞)的发生率为0.2%[47],调查显示,心包压塞是房颤消融所致死亡的最常见原因,占所有原因的25%[48]。其发生原因与房间隔穿刺操作不当、机械损伤、消融损伤有关。急性心包渗出会导致急性心脏舒张功能障碍以及短期内的大量失血,进一步引起心源性休克甚至低血容量性休克,如不及时处理,可能危及生命。因此,术中及术后应注意监测患者的生命体征,怀疑有心包渗出时(如血压下降、心率加快等),应及时进行床旁超声检查,早期发现心包压塞的征象并及时治疗。
大多数的心包压塞都可以通过心包穿刺引流和给予中和剂量的鱼精蛋白拮抗得到治疗,对于术前口服华法林的患者还应静脉给予维生素K和凝血因子复合物,以拮抗其抗凝活性。在有条件的中心,心包穿刺应在X线或超声指导下完成[49]。如果心房破裂口较大,穿刺引流效果不佳,则需要外科引流、修补治疗[46],因此,房颤消融术应当在具备外科支持的中心开展。
2. 穿刺血管并发症:
血管并发症是房颤消融术后最常见的并发症,包括血肿、腹膜后血肿、假性动脉瘤、动静脉瘘,大多数患者可经保守治疗或超声引导下压迫痊愈,少数严重病例需要输血、经皮或外科修补治疗[50]。关于出现血管并发症后应该采取何种强度的抗凝治疗,才能在不明显增加围手术期血栓形成风险的基础上尽量减少局部出血,目前尚无相关临床证据,目前,我们采用经验性推迟术后LWMH或华法林的应用。
五、 小结:
经皮导管消融术已经成为房颤的重要治疗手段,由于术式复杂、损伤范围大,消融相关出血或栓塞等是较为常见的围手术期并发症,因此,优化围手术期的抗凝治疗方案,对于提高手术安全性、降低手术风险具有重要意义;另外,围手术期抗凝药物及其拮抗药物的合理应用关系到全身凝血、抗凝、纤溶功能的平衡,更需谨慎应用。目前关于房颤导管消融围手术期的抗凝强度,国内仍然参照欧美指南提出的建议,因此,仍有待国内进一步的大规模临床研究来提供循证医学证据,从而进一步指导临床实践。
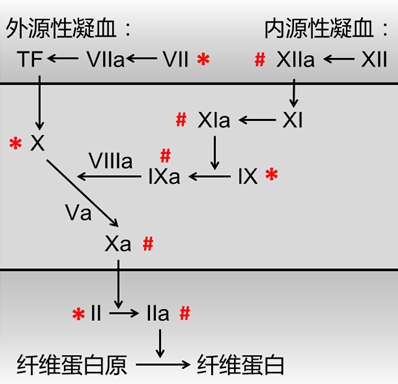
图1 凝血过程及肝素、华法林的作用靶点
(#代表肝素的作用靶点,*代表华法林的作用靶点)
参考文献
1. Calkins, H., et al., 2012 HRS/EHRA/ECAS Expert Consensus Statement on Catheter and Surgical Ablation of Atrial Fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design. Europace, 2012. 14(4): p. 528-606.
2. Verma, A., Atrial-fibrillation ablation should be considered first-line therapy for some patients. Curr Opin Cardiol, 2008. 23(1): p. 1-8.
3. Cappato, R., et al., Worldwide survey on the methods, efficacy, and safety of catheter ablation for human atrial fibrillation. Circulation, 2005. 111(9): p. 1100-5.
4. McCready, J.W., et al., Incidence of left atrial thrombus prior to atrial fibrillation ablation: is pre-procedural transoesophageal echocardiography mandatory? Europace, 2010. 12(7): p. 927-32.
5. Puwanant, S., et al., Role of the CHADS2 score in the evaluation of thromboembolic risk in patients with atrial fibrillation undergoing transesophageal echocardiography before pulmonary vein isolation. J Am Coll Cardiol, 2009. 54(22): p. 2032-9.
6. Scherr, D., et al., Incidence and predictors of left atrial thrombus prior to catheter ablation of atrial fibrillation. J Cardiovasc Electrophysiol, 2009. 20(4): p. 379-84.
7. Gottlieb, I., et al., Diagnostic accuracy of arterial phase 64-slice multidetector CT angiography for left atrial appendage thrombus in patients undergoing atrial fibrillation ablation. J Cardiovasc Electrophysiol, 2008. 19(3): p. 247-51.
8. Saksena, S., et al., A prospective comparison of cardiac imaging using intracardiac echocardiography with transesophageal echocardiography in patients with atrial fibrillation: the intracardiac echocardiography guided cardioversion helps interventional procedures study. Circ Arrhythm Electrophysiol, 2010. 3(6): p. 571-7.
9. Lucassen, W., et al., Clinical decision rules for excluding pulmonary embolism: a meta-analysis. Ann Intern Med, 2011. 155(7): p. 448-60.
10. Schulman, S., Advances in the management of venous thromboembolism. Best Pract Res Clin Haematol, 2012. 25(3): p. 361-77.
11. Chong, L.Y., et al., Management of venous thromboembolic diseases and the role of thrombophilia testing: summary of NICE guidance. BMJ, 2012. 344: p. e3979.
12. Scherr, D., et al., Incidence and predictors of periprocedural cerebrovascular accident in patients undergoing catheter ablation of atrial fibrillation. J Cardiovasc Electrophysiol, 2009. 20(12): p. 1357-63.
13. Vazquez, S.R., S.A. Johnson, and M.T. Rondina, Peri-procedural anticoagulation in patients undergoing ablation for atrial fibrillation. Thromb Res, 2010. 126(2): p. e69-77.
14. Wann, L.S., et al., 2011 ACCF/AHA/HRS focused update on the management of patients with atrial fibrillation (updating the 2006 guideline): a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation, 2011. 123(1): p. 104-23.
15. Camm, A.J., et al., 2012 focused update of the ESC Guidelines for the management of atrial fibrillation: an update of the 2010 ESC Guidelines for the management of atrial fibrillation. Developed with the special contribution of the European Heart Rhythm Association. Eur Heart J, 2012. 33(21): p. 2719-47.
16. You, J.J., et al., Antithrombotic therapy for atrial fibrillation: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest, 2012. 141(2 Suppl): p. e531S-75S.
17. 黄从新,张澍,马长生等, 心房颤动:目前的认识和治疗建议——2012. 中华心律失常学杂志, 2012. 16(4): p. 246-289.
18. Patel, M.R., et al., Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med, 2011. 365(10): p. 883-91.
19. Connolly, S.J., et al., Apixaban in patients with atrial fibrillation. N Engl J Med, 2011. 364(9): p. 806-17.
20. Gopinath, D., et al., Pulmonary vein antrum isolation for atrial fibrillation on therapeutic coumadin: special considerations. J Cardiovasc Electrophysiol, 2011. 22(2): p. 236-9.
21. Lakkireddy, D., et al., Feasibility and safety of dabigatran versus warfarin for periprocedural anticoagulation in patients undergoing radiofrequency ablation for atrial fibrillation: results from a multicenter prospective registry. J Am Coll Cardiol, 2012. 59(13): p. 1168-74.
22. Mardigyan, V., et al., Anticoagulation management pre- and post atrial fibrillation ablation: a survey of canadian centres. Can J Cardiol, 2013. 29(2): p. 219-23.
23. Calkins, H., et al., HRS/EHRA/ECAS expert Consensus Statement on catheter and surgical ablation of atrial fibrillation: recommendations for personnel, policy, procedures and follow-up. A report of the Heart Rhythm Society (HRS) Task Force on catheter and surgical ablation of atrial fibrillation. Heart Rhythm, 2007. 4(6): p. 816-61.
24. Wazni, O.M., et al., Atrial fibrillation ablation in patients with therapeutic international normalized ratio: comparison of strategies of anticoagulation management in the periprocedural period. Circulation, 2007. 116(22): p. 2531-4.
25. Hoyt, H., et al., Complications arising from catheter ablation of atrial fibrillation: temporal trends and predictors. Heart Rhythm, 2011. 8(12): p. 1869-74.
26. Abhishek, F., et al., Effectiveness of a strategy to reduce major vascular complications from catheter ablation of atrial fibrillation. J Interv Card Electrophysiol, 2011. 30(3): p. 211-5.
27. Lip, G.Y., et al., Bleeding risk assessment and management in atrial fibrillation patients: a position document from the European Heart Rhythm Association, endorsed by the European Society of Cardiology Working Group on Thrombosis. Europace, 2011. 13(5): p. 723-46.
28. Hakalahti, A., et al., Catheter ablation of atrial fibrillation in patients with therapeutic oral anticoagulation treatment. Europace, 2011. 13(5): p. 640-5.
29. Di Biase, L., et al., Periprocedural stroke and management of major bleeding complications in patients undergoing catheter ablation of atrial fibrillation: the impact of periprocedural therapeutic international normalized ratio. Circulation, 2010. 121(23): p. 2550-6.
30. Kwak, J.J., et al., Safety and convenience of continuous warfarin strategy during the periprocedural period in patients who underwent catheter ablation of atrial fibrillation. J Cardiovasc Electrophysiol, 2010. 21(6): p. 620-5.
31. Page, S.P., et al., Catheter ablation for atrial fibrillation on uninterrupted warfarin: can it be done without echo guidance? J Cardiovasc Electrophysiol, 2011. 22(3): p. 265-70.
32. Hussein, A.A., et al., Radiofrequency ablation of atrial fibrillation under therapeutic international normalized ratio: a safe and efficacious periprocedural anticoagulation strategy. Heart Rhythm, 2009. 6(10): p. 1425-9.
33. Santangeli, P., et al., Atrial Fibrillation Ablation without Interruption of Anticoagulation. Cardiol Res Pract, 2011. 2011: p. 837841.
34. Kim, J.S., et al., The optimal range of international normalized ratio for radiofrequency catheter ablation of atrial fibrillation during therapeutic anticoagulation with warfarin. Circ Arrhythm Electrophysiol, 2013. 6(2): p. 302-9.
35. Cappato, R., et al., Updated worldwide survey on the methods, efficacy, and safety of catheter ablation for human atrial fibrillation. Circ Arrhythm Electrophysiol, 2010. 3(1): p. 32-8.
36. Ren, J.F., F.E. Marchlinski, and D.J. Callans, Left atrial thrombus associated with ablation for atrial fibrillation: identification with intracardiac echocardiography. J Am Coll Cardiol, 2004. 43(10): p. 1861-7.
37. Shah, D., Filamentous thrombi during left-sided sheath-assisted catheter ablations. Europace, 2010. 12(12): p. 1657-8.
38. Asbach, S., et al., Early Heparin Administration Reduces Risk for Left Atrial Thrombus Formation during Atrial Fibrillation Ablation Procedures. Cardiol Res Pract, 2011. 2011: p. 615087.
39. Ren, J.F., et al., Increased intensity of anticoagulation may reduce risk of thrombus during atrial fibrillation ablation procedures in patients with spontaneous echo contrast. J Cardiovasc Electrophysiol, 2005. 16(5): p. 474-7.
40. Wazni, O.M., et al., Embolic events and char formation during pulmonary vein isolation in patients with atrial fibrillation: impact of different anticoagulation regimens and importance of intracardiac echo imaging. J Cardiovasc Electrophysiol, 2005. 16(6): p. 576-81.
41. Gaita, F., et al., Radiofrequency catheter ablation of atrial fibrillation: a cause of silent thromboembolism? Magnetic resonance imaging assessment of cerebral thromboembolism in patients undergoing ablation of atrial fibrillation. Circulation, 2010. 122(17): p. 1667-73.
42. Gautam, S., et al., Effect of therapeutic INR on activated clotting times, heparin dosage, and bleeding risk during ablation of atrial fibrillation. J Cardiovasc Electrophysiol, 2011. 22(3): p. 248-54.
43. Tao, H., et al., Late thromboembolic events after circumferential pulmonary vein ablation of atrial fibrillation. J Interv Card Electrophysiol, 2010. 27(1): p. 33-9.
44. Blanc, J.J., et al., Consensus document on antithrombotic therapy in the setting of electrophysiological procedures. Europace, 2008. 10(5): p. 513-27.
45. Andrade, J.G., et al., Efficacy and safety of cryoballoon ablation for atrial fibrillation: a systematic review of published studies. Heart Rhythm, 2011. 8(9): p. 1444-51.
46. Bunch, T.J., et al., Outcomes after cardiac perforation during radiofrequency ablation of the atrium. J Cardiovasc Electrophysiol, 2005. 16(11): p. 1172-9.
47. Cappato, R., et al., Delayed cardiac tamponade after radiofrequency catheter ablation of atrial fibrillation: a worldwide report. J Am Coll Cardiol, 2011. 58(25): p. 2696-7.
48. Cappato, R., et al., Prevalence and causes of fatal outcome in catheter ablation of atrial fibrillation. J Am Coll Cardiol, 2009. 53(19): p. 1798-803.
49. Tsang, T.S., et al., Consecutive 1127 therapeutic echocardiographically guided pericardiocenteses: clinical profile, practice patterns, and outcomes spanning 21 years. Mayo Clin Proc, 2002. 77(5): p. 429-36.
50. Waigand, J., et al., Percutaneous treatment of pseudoaneurysms and arteriovenous fistulas after invasive vascular procedures. Catheter Cardiovasc Interv, 1999. 47(2): p. 157-64.
目前,经皮导管消融已经成为心房颤动(房颤)的重要治疗手段,然而,由于术式复杂、损伤范围大,如何通过有效的抗凝治疗以降低围手术期血栓风险至关重要,是房颤导管消融的基础。本文重点针对围手术期抗凝治疗的策略进行阐述,主要包括术前血栓风险的评估、围手术期抗凝方案及强度的选择等,尤其是在血栓或心包压塞等出血等并发症发生时的处理,这不仅包括及时的对症处理以及血流动力学的监测与维持,更要随时调整抗凝强度以及针对性的使用抗凝拮抗措施,而后者需要对于凝血系统、抗凝系统及纤溶系统具有系统、深入的了解。
关键词:
心房颤动;导管消融;抗凝;血栓栓塞
目前,经皮导管消融已经成为心房颤动(房颤),特别是对抗心律失常药物治疗无效、无法耐受房颤症状且无明显器质性心脏病患者的一线治疗手段[1, 2]。然而,由于术式复杂、损伤范围大,围手术期并发症,特别是出血和栓塞事件的发生率也较高[3]。因此,房颤导管消融的围手术期抗凝治疗对于降低消融风险来说至关重要,临床应当给予足够重视,但一旦发生出血、血肿等并发症时,基础抗凝治疗通常会使临床情况进一步恶化。因此,如何灵活掌握房颤导管消融围手术期的抗凝治疗原则及发生手术并发症时的拮抗措施及下一步处理具有非常重要的临床意义。
一、 术前准备:
1. 血栓风险的评估:
术前进行经食道超声(TEE)、左房CT检查筛查左房或左心耳内血栓情况,并了解肺静脉与左房的解剖关系,对于避免术中左房血栓脱落引起栓塞、指导消融策略等具有重要作用。研究证实,应用TEE对拟行房颤消融且经过系统性抗凝治疗患者的左房血栓检出率为1.6%-2.1%[4-6],并且左房血栓的检出与CHADS2评分直接相关,在CHADS2为0分的患者中,左房血栓的检出率≤0.3%,而在CHADS2≥2分的患者中,左房血栓的检出率>5%,其他的危险因素还包括左房大小和持续性房颤。然而,是否应当对所有拟行房颤消融术患者均进行TEE检查,以及应对哪些患者进行术前的常规TEE筛查,目前尚无统一意见,2012年美国心律学会(HRS)、欧洲心律协会(EHRA)和欧洲心律失常学会(ECAS)联合颁布的房颤导管、外科消融专家共识(以下简称专家共识)提出对房颤持续≥48小时或未知时间者均应采用TEE排除左房血栓,而对窦律或房颤持续<48小时者则无强制要求[1]。
关于左房多排CT在筛查左房血栓中的精确性,不同研究的结果相差较大。Gottlieb等的研究表明[7],左房64排CT在筛查左房血栓中的精确性不及TEE,且不同阅片者之间的结果相差甚大,这与图片质量、难以鉴别梳状肌与血栓有关;而Patel等则提出左房CT在检测左心耳血栓中具有良好的灵敏度,但特异度中等[8],因此左房CT在排除左房血栓中的价值有待进一步探讨。目前通常推荐经食道超声为鉴别心房血栓的金标准。
此外,由于导管消融的过程涉及深静脉穿刺置管等有创操作,为防止围手术期肺栓塞的发生,术前对下肢深静脉血栓(VTE)的筛查也是相当必要的。D-二聚体对于VTE的阴性预测值可达99%[9],因此,是临床常用于筛查VTE的指标,对于D-二聚体阳性的患者应酌情采用下肢血管超声、肺动脉CT、肺通气灌注扫描对VTE进行确定诊断[10, 11]。对于确诊深静脉血栓形成或肺栓塞的患者,应先行系统性抗凝治疗,待血栓消失后择期进行房颤消融术。
2. 术前抗凝治疗策略的选择:
在导管消融术中及术后的数周至数月,房颤患者的血栓栓塞风险显著升高[12, 13],因此,抗凝治疗理论上应贯穿于房颤导管消融围手术期的全程,合理地选择抗凝策略对于减少出血、栓塞事件的发生是至关重要的。
由于多数接受导管消融治疗的患者已经有较高的血栓栓塞风险,而多项房颤指南推荐对于血栓中、高危的房颤患者(基于CHADS2、CHA2DS2-VASc评分或栓塞危险因素)均应采用口服抗凝药物进行系统性抗凝治疗[14-17],因此,这些患者在术前应当接受系统的抗凝治疗(华法林、直接凝血酶抑制剂或Xa因子抑制剂)[18-21];对于血栓低危患者可酌情选用阿司匹林进行抗血小板治疗[14-16]。专家共识推荐,对于房颤持续时间≥48小时或未知持续时间者,在术前应进行≥3周的系统性抗凝治疗[1]。关于房颤导管消融围手术期的常用抗凝策略有以下几种:
1) 肝素桥接治疗:
目前,肝素桥接治疗仍然是多数中心广泛采用的抗凝治疗方式[22],也是2007年HRS/EHRA/ECAS颁布的专家共识规定的传统术前抗凝策略[23]。所谓“桥接”是指在术前数天开始采用华法林与低分子肝素(LWMH)重叠治疗,在术前3-5天停用华法林开始单用LWMH,手术当日清晨停用LWMH[6, 12, 24]。然而一些研究显示,这种抗凝方式会增加围手术期出血并发症,特别是穿刺部位出血的风险[3, 25-27],因此,有学者提出在房颤消融围手术期不停用华法林的抗凝策略[24, 25, 28]。
2) 华法林连贯治疗:
近来,几项研究提出了在房颤消融围手术期持续应用华法林治疗的抗凝策略,在一些中心得到应用[20, 28-31],与LWMH桥接治疗相比,该策略不仅简化了操作流程,更重要的是明显降低了围手术期血栓栓塞和出血并发症的风险[24, 30, 32, 33],同时,多项研究表明,术前INR在2.0-2.5之间可以在不明显增加出血风险的基础上有效降低血栓栓塞风险[29, 34],因此2012年欧洲心脏病协会(ESC)颁布的房颤指南中也对该策略进行了规定,并提出手术当日的目标INR为2.0-2.5[15]。
需要特别注意的是,由于肝素和华法林的抗凝机制不同(图1),针对它们采取拮抗措施的效果也各异。对于采用肝素桥接治疗的患者发生出血并发症后,首选硫酸鱼精蛋白进行拮抗,其作用迅速,数分钟之内即可使活化的凝血时间(activated clotting time, ACT)下降,相对安全有效。然而,对于采用华法林该抗凝的患者,一旦发生出血并发症,特别是心包压塞等急症后,往往缺乏及时、有效的拮抗手段。由于术前长期口服华法林已经严重干扰了维生素K依赖性凝血因子(Ⅱ,Ⅶ,Ⅸ,Ⅹ)的合成,从而导致其绝对缺乏,人体需要重新合成新的凝血因子来改善凝血功能。因此,即使静脉补充维生素K,其拮抗作用也需要2-3天才能得以发挥,因此,必要时及时给予凝血酶原复合物可以迅速补充耗竭的凝血因子,尽快恢复凝血机制。
3) 新型口服抗凝药物治疗:
新型口服抗凝药物(直接凝血酶抑制剂或Xa因子抑制剂)应用于房颤患者的系统性抗凝治疗具有良好的安全性和有效性[18, 19],但是在房颤导管消融围手术期应用这些药物的临床证据较少,其安全性和有效性尚待进一步阐明。
二、 术中抗凝处理:
房颤消融术相关血栓栓塞事件的发生率为0.5-4.0%,其中缺血性卒中为0.23%,TIA为0.71%[12, 29, 35],而大多数栓子是在房间隔鞘管或电极导管刚进入左房时形成的[36-38],因此,应用肝素的时机应当是房间隔穿刺之前或即刻。为了保证达到并维持肝素化的效果,术中监测ACT极为必要,有限的临床资料表明,术中维持ACT水平在300-400s之间可以有效减少血栓形成[39]、血栓栓塞事件[40]及无症状性栓塞的发生[41]。2012专家共识也对此做出相应规定,在给予负荷量肝素后,应使ACT达到300-400s,此后应每30分钟测定一次,并酌情补充肝素,使手术全程的ACT维持在300-350s之间[1]。另外,对于术前未停用华法林的患者,术中的抗凝原则同肝素桥接治疗的患者[1],术前应测定ACT的基础值,术中应给予相对低剂量的肝素,使ACT达到并维持在350s[42]。消融完成后,可应用硫酸鱼精蛋白拮抗肝素的抗凝活性,使ACT下降至200-250s内即可拔除股静脉鞘管[1]。
由于国内尚缺乏该方面的研究,所以目前的抗凝强度是参照欧美指南进行的,但国人与欧美人种的凝血体质、对抗凝药物耐受程度的不同,欧美指南所提出的抗凝强度是否适合国人体质也存疑,因此,仍然有待进一步的大规模研究来提供关于国人术中抗凝治疗强度的高级别证据。
三、 术后抗凝治疗:
在消融治疗当天就应开始口服华法林进行抗凝,并使INR尽快达标。对于接受肝素桥接治疗的患者,在拔除股静脉鞘管后4-6小时开始应用华法林和LWMH重叠治疗,直到INR升高至治疗窗(2.0-3.0)后开始停用LWMH;对于未中断华法林的患者,术后无需使用LWMH,继续应用华法林,使INR维持在2.0-3.0即可[1]。
房颤消融术后晚发的血栓栓塞事件同样值得关注[43],目前的指南规定,在房颤术后,应口服华法林抗凝至少2个月,而对于卒中高危患者(推荐应用CHADS2或CHA2DS2-VASc评分),则应长期口服华法林以预防卒中的发生[1, 15, 44]。
四、 急性并发症处理中抗凝治疗的原则:
房颤导管消融术操作复杂、风险也相对较大,根据一项世界范围内的房颤消融调查结果[3],并发症的总发生率为5.9%,其中严重并发症发生率为2.2%,死亡率为0.05%。目前,房颤消融的主要并发症包括穿刺部位血管并发症、心包压塞、脑卒中及TIA、心房食管瘘、肺静脉狭窄、术后快速型房性心律失常等。
1. 心包压塞:
房颤消融术所致心包压塞的发生率为1.2-2.4%[3, 35, 45, 46],迟发性心包压塞(房颤消融术后1小时以后发生的心包压塞)的发生率为0.2%[47],调查显示,心包压塞是房颤消融所致死亡的最常见原因,占所有原因的25%[48]。其发生原因与房间隔穿刺操作不当、机械损伤、消融损伤有关。急性心包渗出会导致急性心脏舒张功能障碍以及短期内的大量失血,进一步引起心源性休克甚至低血容量性休克,如不及时处理,可能危及生命。因此,术中及术后应注意监测患者的生命体征,怀疑有心包渗出时(如血压下降、心率加快等),应及时进行床旁超声检查,早期发现心包压塞的征象并及时治疗。
大多数的心包压塞都可以通过心包穿刺引流和给予中和剂量的鱼精蛋白拮抗得到治疗,对于术前口服华法林的患者还应静脉给予维生素K和凝血因子复合物,以拮抗其抗凝活性。在有条件的中心,心包穿刺应在X线或超声指导下完成[49]。如果心房破裂口较大,穿刺引流效果不佳,则需要外科引流、修补治疗[46],因此,房颤消融术应当在具备外科支持的中心开展。
2. 穿刺血管并发症:
血管并发症是房颤消融术后最常见的并发症,包括血肿、腹膜后血肿、假性动脉瘤、动静脉瘘,大多数患者可经保守治疗或超声引导下压迫痊愈,少数严重病例需要输血、经皮或外科修补治疗[50]。关于出现血管并发症后应该采取何种强度的抗凝治疗,才能在不明显增加围手术期血栓形成风险的基础上尽量减少局部出血,目前尚无相关临床证据,目前,我们采用经验性推迟术后LWMH或华法林的应用。
五、 小结:
经皮导管消融术已经成为房颤的重要治疗手段,由于术式复杂、损伤范围大,消融相关出血或栓塞等是较为常见的围手术期并发症,因此,优化围手术期的抗凝治疗方案,对于提高手术安全性、降低手术风险具有重要意义;另外,围手术期抗凝药物及其拮抗药物的合理应用关系到全身凝血、抗凝、纤溶功能的平衡,更需谨慎应用。目前关于房颤导管消融围手术期的抗凝强度,国内仍然参照欧美指南提出的建议,因此,仍有待国内进一步的大规模临床研究来提供循证医学证据,从而进一步指导临床实践。

图1 凝血过程及肝素、华法林的作用靶点
(#代表肝素的作用靶点,*代表华法林的作用靶点)
参考文献
1. Calkins, H., et al., 2012 HRS/EHRA/ECAS Expert Consensus Statement on Catheter and Surgical Ablation of Atrial Fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design. Europace, 2012. 14(4): p. 528-606.
2. Verma, A., Atrial-fibrillation ablation should be considered first-line therapy for some patients. Curr Opin Cardiol, 2008. 23(1): p. 1-8.
3. Cappato, R., et al., Worldwide survey on the methods, efficacy, and safety of catheter ablation for human atrial fibrillation. Circulation, 2005. 111(9): p. 1100-5.
4. McCready, J.W., et al., Incidence of left atrial thrombus prior to atrial fibrillation ablation: is pre-procedural transoesophageal echocardiography mandatory? Europace, 2010. 12(7): p. 927-32.
5. Puwanant, S., et al., Role of the CHADS2 score in the evaluation of thromboembolic risk in patients with atrial fibrillation undergoing transesophageal echocardiography before pulmonary vein isolation. J Am Coll Cardiol, 2009. 54(22): p. 2032-9.
6. Scherr, D., et al., Incidence and predictors of left atrial thrombus prior to catheter ablation of atrial fibrillation. J Cardiovasc Electrophysiol, 2009. 20(4): p. 379-84.
7. Gottlieb, I., et al., Diagnostic accuracy of arterial phase 64-slice multidetector CT angiography for left atrial appendage thrombus in patients undergoing atrial fibrillation ablation. J Cardiovasc Electrophysiol, 2008. 19(3): p. 247-51.
8. Saksena, S., et al., A prospective comparison of cardiac imaging using intracardiac echocardiography with transesophageal echocardiography in patients with atrial fibrillation: the intracardiac echocardiography guided cardioversion helps interventional procedures study. Circ Arrhythm Electrophysiol, 2010. 3(6): p. 571-7.
9. Lucassen, W., et al., Clinical decision rules for excluding pulmonary embolism: a meta-analysis. Ann Intern Med, 2011. 155(7): p. 448-60.
10. Schulman, S., Advances in the management of venous thromboembolism. Best Pract Res Clin Haematol, 2012. 25(3): p. 361-77.
11. Chong, L.Y., et al., Management of venous thromboembolic diseases and the role of thrombophilia testing: summary of NICE guidance. BMJ, 2012. 344: p. e3979.
12. Scherr, D., et al., Incidence and predictors of periprocedural cerebrovascular accident in patients undergoing catheter ablation of atrial fibrillation. J Cardiovasc Electrophysiol, 2009. 20(12): p. 1357-63.
13. Vazquez, S.R., S.A. Johnson, and M.T. Rondina, Peri-procedural anticoagulation in patients undergoing ablation for atrial fibrillation. Thromb Res, 2010. 126(2): p. e69-77.
14. Wann, L.S., et al., 2011 ACCF/AHA/HRS focused update on the management of patients with atrial fibrillation (updating the 2006 guideline): a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation, 2011. 123(1): p. 104-23.
15. Camm, A.J., et al., 2012 focused update of the ESC Guidelines for the management of atrial fibrillation: an update of the 2010 ESC Guidelines for the management of atrial fibrillation. Developed with the special contribution of the European Heart Rhythm Association. Eur Heart J, 2012. 33(21): p. 2719-47.
16. You, J.J., et al., Antithrombotic therapy for atrial fibrillation: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest, 2012. 141(2 Suppl): p. e531S-75S.
17. 黄从新,张澍,马长生等, 心房颤动:目前的认识和治疗建议——2012. 中华心律失常学杂志, 2012. 16(4): p. 246-289.
18. Patel, M.R., et al., Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med, 2011. 365(10): p. 883-91.
19. Connolly, S.J., et al., Apixaban in patients with atrial fibrillation. N Engl J Med, 2011. 364(9): p. 806-17.
20. Gopinath, D., et al., Pulmonary vein antrum isolation for atrial fibrillation on therapeutic coumadin: special considerations. J Cardiovasc Electrophysiol, 2011. 22(2): p. 236-9.
21. Lakkireddy, D., et al., Feasibility and safety of dabigatran versus warfarin for periprocedural anticoagulation in patients undergoing radiofrequency ablation for atrial fibrillation: results from a multicenter prospective registry. J Am Coll Cardiol, 2012. 59(13): p. 1168-74.
22. Mardigyan, V., et al., Anticoagulation management pre- and post atrial fibrillation ablation: a survey of canadian centres. Can J Cardiol, 2013. 29(2): p. 219-23.
23. Calkins, H., et al., HRS/EHRA/ECAS expert Consensus Statement on catheter and surgical ablation of atrial fibrillation: recommendations for personnel, policy, procedures and follow-up. A report of the Heart Rhythm Society (HRS) Task Force on catheter and surgical ablation of atrial fibrillation. Heart Rhythm, 2007. 4(6): p. 816-61.
24. Wazni, O.M., et al., Atrial fibrillation ablation in patients with therapeutic international normalized ratio: comparison of strategies of anticoagulation management in the periprocedural period. Circulation, 2007. 116(22): p. 2531-4.
25. Hoyt, H., et al., Complications arising from catheter ablation of atrial fibrillation: temporal trends and predictors. Heart Rhythm, 2011. 8(12): p. 1869-74.
26. Abhishek, F., et al., Effectiveness of a strategy to reduce major vascular complications from catheter ablation of atrial fibrillation. J Interv Card Electrophysiol, 2011. 30(3): p. 211-5.
27. Lip, G.Y., et al., Bleeding risk assessment and management in atrial fibrillation patients: a position document from the European Heart Rhythm Association, endorsed by the European Society of Cardiology Working Group on Thrombosis. Europace, 2011. 13(5): p. 723-46.
28. Hakalahti, A., et al., Catheter ablation of atrial fibrillation in patients with therapeutic oral anticoagulation treatment. Europace, 2011. 13(5): p. 640-5.
29. Di Biase, L., et al., Periprocedural stroke and management of major bleeding complications in patients undergoing catheter ablation of atrial fibrillation: the impact of periprocedural therapeutic international normalized ratio. Circulation, 2010. 121(23): p. 2550-6.
30. Kwak, J.J., et al., Safety and convenience of continuous warfarin strategy during the periprocedural period in patients who underwent catheter ablation of atrial fibrillation. J Cardiovasc Electrophysiol, 2010. 21(6): p. 620-5.
31. Page, S.P., et al., Catheter ablation for atrial fibrillation on uninterrupted warfarin: can it be done without echo guidance? J Cardiovasc Electrophysiol, 2011. 22(3): p. 265-70.
32. Hussein, A.A., et al., Radiofrequency ablation of atrial fibrillation under therapeutic international normalized ratio: a safe and efficacious periprocedural anticoagulation strategy. Heart Rhythm, 2009. 6(10): p. 1425-9.
33. Santangeli, P., et al., Atrial Fibrillation Ablation without Interruption of Anticoagulation. Cardiol Res Pract, 2011. 2011: p. 837841.
34. Kim, J.S., et al., The optimal range of international normalized ratio for radiofrequency catheter ablation of atrial fibrillation during therapeutic anticoagulation with warfarin. Circ Arrhythm Electrophysiol, 2013. 6(2): p. 302-9.
35. Cappato, R., et al., Updated worldwide survey on the methods, efficacy, and safety of catheter ablation for human atrial fibrillation. Circ Arrhythm Electrophysiol, 2010. 3(1): p. 32-8.
36. Ren, J.F., F.E. Marchlinski, and D.J. Callans, Left atrial thrombus associated with ablation for atrial fibrillation: identification with intracardiac echocardiography. J Am Coll Cardiol, 2004. 43(10): p. 1861-7.
37. Shah, D., Filamentous thrombi during left-sided sheath-assisted catheter ablations. Europace, 2010. 12(12): p. 1657-8.
38. Asbach, S., et al., Early Heparin Administration Reduces Risk for Left Atrial Thrombus Formation during Atrial Fibrillation Ablation Procedures. Cardiol Res Pract, 2011. 2011: p. 615087.
39. Ren, J.F., et al., Increased intensity of anticoagulation may reduce risk of thrombus during atrial fibrillation ablation procedures in patients with spontaneous echo contrast. J Cardiovasc Electrophysiol, 2005. 16(5): p. 474-7.
40. Wazni, O.M., et al., Embolic events and char formation during pulmonary vein isolation in patients with atrial fibrillation: impact of different anticoagulation regimens and importance of intracardiac echo imaging. J Cardiovasc Electrophysiol, 2005. 16(6): p. 576-81.
41. Gaita, F., et al., Radiofrequency catheter ablation of atrial fibrillation: a cause of silent thromboembolism? Magnetic resonance imaging assessment of cerebral thromboembolism in patients undergoing ablation of atrial fibrillation. Circulation, 2010. 122(17): p. 1667-73.
42. Gautam, S., et al., Effect of therapeutic INR on activated clotting times, heparin dosage, and bleeding risk during ablation of atrial fibrillation. J Cardiovasc Electrophysiol, 2011. 22(3): p. 248-54.
43. Tao, H., et al., Late thromboembolic events after circumferential pulmonary vein ablation of atrial fibrillation. J Interv Card Electrophysiol, 2010. 27(1): p. 33-9.
44. Blanc, J.J., et al., Consensus document on antithrombotic therapy in the setting of electrophysiological procedures. Europace, 2008. 10(5): p. 513-27.
45. Andrade, J.G., et al., Efficacy and safety of cryoballoon ablation for atrial fibrillation: a systematic review of published studies. Heart Rhythm, 2011. 8(9): p. 1444-51.
46. Bunch, T.J., et al., Outcomes after cardiac perforation during radiofrequency ablation of the atrium. J Cardiovasc Electrophysiol, 2005. 16(11): p. 1172-9.
47. Cappato, R., et al., Delayed cardiac tamponade after radiofrequency catheter ablation of atrial fibrillation: a worldwide report. J Am Coll Cardiol, 2011. 58(25): p. 2696-7.
48. Cappato, R., et al., Prevalence and causes of fatal outcome in catheter ablation of atrial fibrillation. J Am Coll Cardiol, 2009. 53(19): p. 1798-803.
49. Tsang, T.S., et al., Consecutive 1127 therapeutic echocardiographically guided pericardiocenteses: clinical profile, practice patterns, and outcomes spanning 21 years. Mayo Clin Proc, 2002. 77(5): p. 429-36.
50. Waigand, J., et al., Percutaneous treatment of pseudoaneurysms and arteriovenous fistulas after invasive vascular procedures. Catheter Cardiovasc Interv, 1999. 47(2): p. 157-64.