一、病例资料
患者,男性,67岁,因胸痛向左肩放散,伴胸闷、气急2天入院。患者于两天前无明显诱因突发心前区疼痛向左肩放散,伴胸闷,症状呈发作性,伴随剑突上部疼痛,最长持续30分钟,休息后不缓解,逐至当地医院急诊。辅助检查示:心电图窦性心动过缓,偶见室性逸搏;肌钙蛋白Ⅰ(TNI)7.9μg/L;脑钠肽(BNP)1110 ng/L。抗凝、扩冠及降脂治疗一天后,症状未缓解且出现气急,逐于隔日上午转入我院。
既往史:每日吸烟30支,患慢性支气管炎20年,不饮酒,无高血压、糖尿病及其他心血管病家族史。
体格检查示:血压109/65 mm Hg;脉搏58次/分,律整齐;呼吸均匀20次/分;体温37.7℃。口唇无紫绀。心率58次/分,律整,心音纯正,无杂音。胸廓呈桶状,肋间隙增宽,双肺叩诊过清。双肺听诊无干、湿性啰音。入院时急查:TNI 48.2 μg/L;肌酸激酶(CK)2097 μ/L;肌酸激酶同工酶(CK-MB)210 μ/L;超敏CRP19 mg/L;血钾(K)3.61 mmol/L;白细胞总数10×109/L,中性粒80.8%。D二聚体180 μg/L。心电图大致正常(图1)。
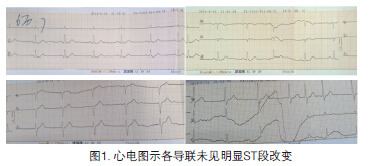
初步诊断:1. 冠心病,非ST段抬高心肌梗死,窦性心动过缓,室性逸搏,KILLIP2级;2. 慢性阻塞性肺病。
入院后处理:因急性心梗发病时间超过24小时,且已无胸痛症状,病情稳定,故决定先行药物保守治疗,择期冠脉介入术(PCI)治疗。给予吸氧、心电监护,双抗(阿司匹林0.1 qd、氯吡格雷75 mg qd)治疗,同时还常规给予低分子肝素、硝酸酯类药物、他汀(阿托伐他汀)、心肌营养(左卡尼丁)药物。
二、病程记录
入院当日上午9时,患者气急,偶有胸痛、咳嗽,咳少许白色黏痰。查体:血压106/54 mm Hg,心率60次/分。肺呼吸音粗,双肺底可闻少许湿啰音。考虑左心衰,给予速尿、安体舒通口服。
下午4时,症状好转,但血压为84/53 mm Hg,偏低;脉搏54次/分,律整齐;呼吸:20次/分;体温:37.6度。口唇无紫绀。复查血液:TNI 44.8 μg/L;CK 1231 μ/L;CKMB 82 μ/L;超敏CRP 95 mg/L;K+ 3.61 mmol/L;白细胞总数11×109/L,中性粒79.8%。停用硝酸酯类药,补充血容量后,血压回升至94/53 mm Hg,心率始终偏慢,56次/分。
第二日和第三日,症状缓解,病情稳定。第三日,病情稳定,无胸痛胸闷。血压:99/60 mm Hg,心率56次/分,律不齐,偶有早搏或阵发性心房纤颤。血氧饱和度100%。复查血液:TNI 25.3 μg/L;CK 268 μ/L;CKMB20 μ/L;超敏CRP 123 mg/L;K+ 3.61 mmol/L;白细胞总数5.7×109/L,中性粒73.1%,Hb 110 g/L,RBC3.49×1012/L;血小板214×109/L;Cr 90 μmmol/L,BUN8.13 mmol/L。
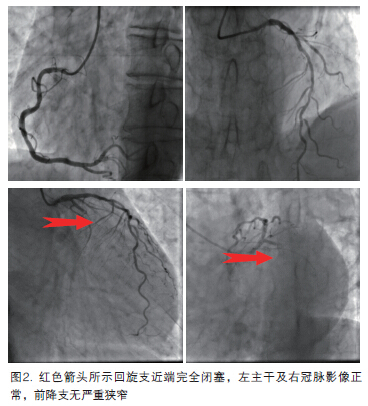
三、发病后第七天行择期PCI(11时)
冠脉造影见回旋支近段完全闭塞,前降支和右冠虽有动脉粥样硬化影像但没有严重狭窄,故确定回旋支为罪犯血管(图2)。
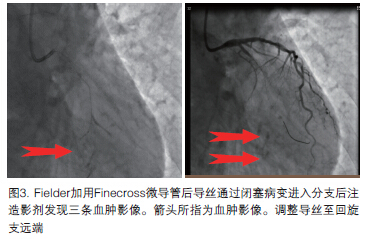
决定行经桡动脉回旋支PCI术,6F冠脉EBU3.75指引导管到位后,先选择Runthrough导丝尝试但不易通过闭塞病变,改用Fielder加用Finecross微导管后导丝通过闭塞病变但进入分支,经微导管推注造影剂发现三条血肿影像,观察约10分钟后,血肿影像逐渐淡化(图3)。
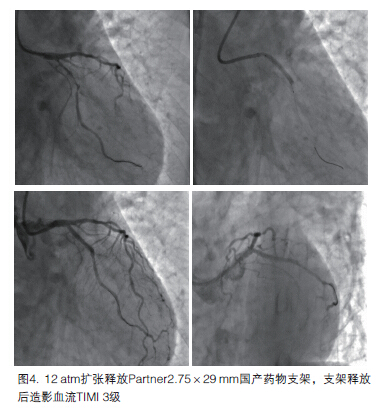
重新调整导丝至回旋支远端后,行血栓(Rebirth导管)抽吸、球囊(Maverick2.0×20 mm)扩张,在6~10 atm压力下预扩张2次,然后行支架术(Partner2.75×29 mm)。支架植入后冠脉血流为TIMI 3级(图4)。
术前应用普通肝素8000单位,术中欣维宁1支。术中无不适,生命体征平稳,血压124/70 mm Hg,心率66次/分。
四、术后病情变化
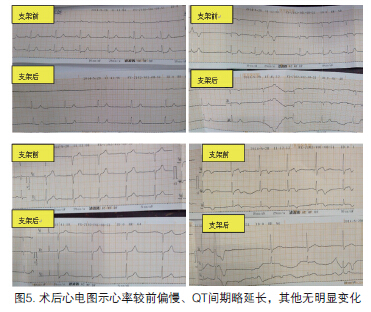
当日下午2点,术后约2小时,患者出现持续前胸疼痛,向左肩放散,血压下降:71/44 mm Hg;心率减慢至48次/分;血氧饱和度96%;双肺呼吸粗,散在干鸣,肺底有少量湿啰音。口唇紫绀但无颈静脉怒张。给予硝酸酯类药物微泵注射症状不缓解。胸痛当日心电图与28日术前心电图比较无明显变化(图5)。
床边心超示少量心包积液,约0.8 cm,后壁0.6 cm。给予杜冷丁50 mg肌注,小剂量多巴胺微泵静注。急查TNI22.4,与术前比较未见升高。因患者持续胸痛不缓解,决定复查冠脉造影。下午4时复查冠脉造影,由三位心内科资深专家同时会诊,左主干、前降支、回旋支均未发现任何问题。但患者仍有胸痛,血压为88/60 mm Hg,偏低。
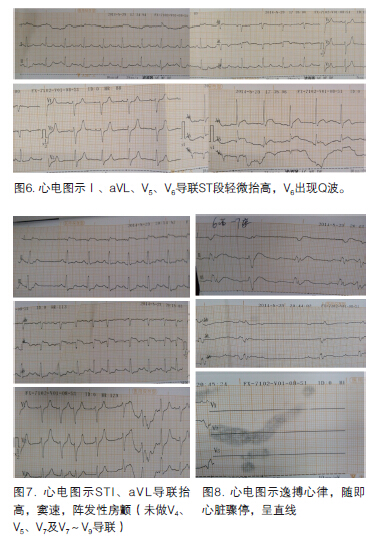
17时34分,心电图示:Ⅰ、aVL、V5、V6导联ST段轻微抬高,V6导联出现Q波(图6)。
18时,复查冠脉造影2小时后,患者胸痛、大汗,血压继续降低至77/56 mm Hg,心率78次/分,血氧饱和度92%,双肺可闻及干湿啰音。给予甲强龙40 mg、速尿20 mg静注。
20时15分,患者胸痛加重,大汗淋漓。心电图显示阵发性心房纤颤,Ⅰ、aVL导联ST段抬高(图7)。20时44分,患者血压100/88 mm Hg,心率138次/分,血氧饱和度92%。突然出现逸搏心律(图8),患者心率减慢至40次/分,血压下降,意识丧失,呼吸变慢。立即行心脏按压。
心脏按压10分钟时床边心脏超声探测:心包积液少到中量,心尖1.0 cm,后壁1.1 cm。与上次结果比较心包积液未见明显增加。PCI术后当日21时30分,心肺复苏不成功,死亡。临床诊断:冠心病,急性下壁心肌梗死,泵衰竭,心律失常,PCI术,心脏猝死。未尸解。
五、死亡原因初步探讨
这是一个表面看似简单,实际因果交错、迷踪错乱、一步走错步步走乱的病例。疑点如下:
1. 心脏破裂?心脏破裂应该伴有大量心包积液,特别是在心脏按压后。该患者心脏按压10分钟后床边心超不支持心脏破裂。
2. 冠脉穿孔致心包填塞?术中发生回旋支分支血肿,可能诱发心包刺激症状,可以解释胸痛症状,但心超未见心包大量积压。
3. 冠脉内急性血栓?支架术后持续胸痛,但心电图无明显改变,复查冠脉造影后未见血管闭塞。复查造影左主干和前降支并无血管损伤迹象,前降支为非治疗血管。
4. 冠脉造影复查后迟发血栓形成?复查冠脉造影2小时后心电图出现Ⅰ、aVL、V5、V6导联ST段抬高,其中V6出现Q波,尽管漏做V7、V8、V9导联,可以考虑发生高侧壁和正后壁心梗,但不能肯定该血管再闭塞与心脏骤停的关系。
5. 心律失常?患者入院表现为非ST段抬高心梗,造影发现回旋支闭塞,考虑为急性下壁心梗。结合发病后有窦性心动过缓、反复阵发性房颤、室性逸搏,考虑病窦。虽然术前忽视了病窦诊断,但有房颤保护,不至于心脏骤停。
6. 急性左心衰?患者肺部虽然可闻及干、湿啰音,有左心衰表现,但没有发生严重呼吸困难,无颈静脉怒张。患者主要症状以胸痛、低血压、气急为主。
7. 肺栓塞?入院时血气正常。入院时D二聚体正常,PCI术后D二聚体轻微升高。临终前血气未做。但PCI为桡动脉路径,且肝素化,术后使用低分子肝素和欣维宁,发生致命性血栓可能性不大。患者下肢无静脉疾病,术后吸氧后血氧饱和度一直维持在92%以上。
8 . 高血钾?患者死亡前2小时急查血钾略高,5.49mmol/L(正常值3.5~5.34);血钙略低,1.89 mmol/L;血钠略低131 mmol/L。因检验报告是患者死亡后出来的,未处理。但心电图表现不支持高血钾。
六、专家分析及文献复习
该患者死因考虑为心肌血肿导致心脏压塞以及心肌缺血加重所致的三度房室传导阻滞。主要依据是:PCI术中发生明显的心肌血肿,术后出现心电图和冠脉造影复查不能解释的持续剧烈胸痛,以及用心超无法解释的颈静脉怒张、血压降低、心衰等心脏压塞表现。本例患者误诊的最大教训是对心肌血肿认识不足,没有及时做心超或心脏增强CT检查。
心肌血肿是指由于各种原因心肌或冠脉破裂引起的血液在心肌内(或心外膜下)积聚,从而导致的一系列临床表现。心肌血肿分为自发性和继发性两种。心脏压塞的原因有两种,一种是我们经常关注的心包填塞,心包内有大量积液,另一种是平时易被忽略的心肌血肿或心脏肿物压迫,心包腔内没有积液或仅有少量积液。心肌血肿本身并不是一种常见的临床疾病和(或)并发症,国内文献鲜有报道。因此导致大部分临床医师对于心肌血肿认识不足,从而造成临床上的误诊或漏诊。
导致心肌血肿发生的最主要因素是心肌梗死,绝大部分发生在心肌梗死急性期,也有少部分可能发生在心肌梗死后恢复期[1-3]。急性心肌梗死后,如果心电图相关导联的ST段持续抬高,或者新出现的ST段抬高(排除再梗后),需要考虑心肌血肿的发生。心肌血肿可以机械性压迫冠状动脉,导致冠脉血流变缓或中断,出现酷似心梗的心电图变化,因此,易误诊为心肌梗死。强化抗凝治疗反而导致血肿加重。
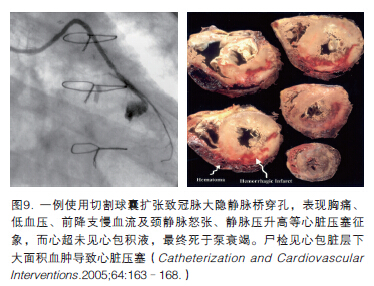
冠脉介入治疗是引起心肌血肿的另一个重要因素[4]。冠脉穿孔大多数发生在PCI术中,或者术后数小时至数天之内,且以心包填塞症状为主要表现,但有时会合并不易被发现的心肌血肿。患者的临床表现一般不典型,比如,胸闷、胸痛、颈静脉怒张、静脉压升高和血压降低等,甚至发生心源性休克、猝死。Furui M等[5]报道了一例PCI术后因心肌血肿出现心脏压塞和心源性休克的病例。Vu H. Quan[6]等报告一例使用切割球囊扩张致冠脉大隐静脉桥穿孔,表现胸痛、低血压、前降支慢血流及颈静脉怒张、静脉压升高等心脏压塞征象,而心超未见心包积液,最终死于泵衰竭。尸检见心包脏层下大面积血肿导致心脏压塞(图9)。
此外,在国外相当一部分病例报道中,心肌血肿的患者常有冠脉搭桥的手术史[7-9]。其他心脏外科手术术后出现心肌血肿的概率相对较低。2012年,Wilson等[10]报道了一例心肌梗死后出现的左室巨大血肿,由于心包的限制,向上延伸压迫左房的病例。
心包脏层下血肿十分常见,面积扩散快,产生心包刺激症,胸痛和心包压塞症状,而心包腔内没有积液或只有少量积液[10,11]。
临床上诊断心肌血肿的影像学检查有心超、心脏超声造影、CT、磁共振,有助于心肌血肿的诊断,可以评价其性质、大小、危险性以及是否与压塞心腔或与心室腔相通等。
心肌血肿的治疗,目前尚无统一的标准,其主要的治疗手段包括:1.急性期停用抗凝或抗血小板药物,防止继续出血或血肿增大,监护生命体征;2.缓解期或合并冠脉支架干预的患者,可以药物治疗,多主张使用单一抗血小板药物(阿司匹林、波立维)+抗凝药物(低分子肝素、华法林等)[11,12],也可使用双联抗血小板治疗[13];3.手术治疗:包括冠状动脉旁路移植术、室间隔及室壁修补术;4.介入治疗:主要是指在冠脉介入治疗过程中出现冠脉穿孔,使用球囊封堵血管近段或者破口,甚至使用带膜支架覆盖破口。
心肌血肿的预后取决于血肿的大小、部位和破口的方向。心包脏层下心肌血肿体积越大,心脏压塞和破裂风险越高,位于心房、流出道等部位,造成血流动力学障碍大。血肿破溃到心腔内者,风险较小,但栓塞风险较高。破溃到心包腔内时会立即发生心包填塞。因此,心肌血肿的死亡率极高,预后极差。
总之,心肌血肿是一种罕见的临床疾病和(或)并发症,其临床表现多种多样,误诊漏诊率高,目前缺乏有效的治疗手段,具有死亡率高,预后差的特点。

来源: