该系统能够帮助医生在导管消融手术过程中快速、准确地绘制三维心脏标测图,缩短手术时长并提升手术准确率
编者按:
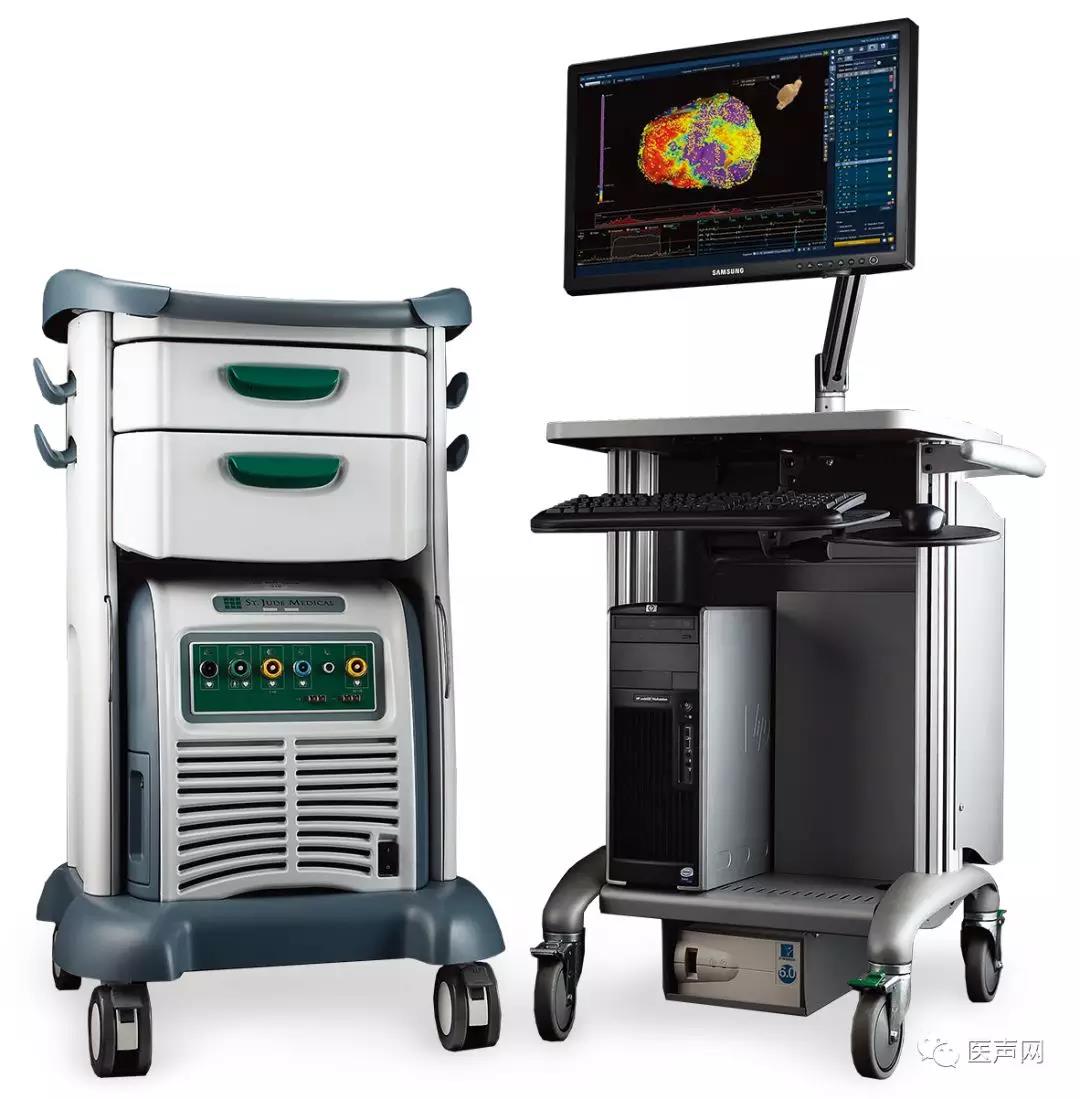
全球领先的医疗保健公司雅培宣布,雅培EnSite™ Velocity 5.0心脏三维标测系统正式在中国上市,该系统能够帮助医生在为患有心律不齐、心律失常等心脏疾病的患者进行导管消融等手术治疗时,实现从建模、标测到消融全阶段的智能化心脏三维成像,显著提高手术效率并缩短手术时间。作为雅培心律管理和心衰业务整套解决方案中的重要组成部分,EnSite™ Velocity 5.0心脏标测系统能连同具备感应功能的其他工具一起,不仅可以减少导管导航时所需透视,还能降低因过度辐射所带来的潜在风险。
当医生使用导管消融来治疗心律失常时,小部分心脏组织在消融导管尖端下方被高频能量加热,产生创伤或微小疤痕。之后,该部分的心脏组织就不会再导致心律失常。目前,基于从导管电极上同时记录心脏空间信息和心电生理活动的心电解剖标测已经成为心律失常消融治疗中的重要工具123,医生可以通过可视化的心电解剖标测进行导航,提供更精确的消融治疗。传统的心脏标测技术要求操作者用手移动一个在心脏内的导管,直接检查电位图后收集各个标测点具456。虽然这一过程能产生精确的心脏标测图,但是标测点的采集是一项耗时耗力的工作。
雅培公司新推出的EnSite™ Velocity 5.0心脏三维标测系统实现了从建模、标测到消融各阶段的全智能化心脏三维成像,实时帮助医生了解手术的进展及导管消融的具体效果。它不仅可用超过Velocity 4.0 扫描密度27倍的点云密度带来CT扫描般的模型细节,在缩短标测时间的同时,减少了人为误差,还可以通过自动三维空间校准来优化建模,帮助医生使用任意导管在任意心腔内完成高密度标测,从而进一步优化导管消融治疗过程。该系统还提供多个最新解决方案,如EnSite AutoMap模块。该模块可帮助电生理专家更快地执行信息匹配,使用自动心脏节律标记工具来确认不规则心跳的病灶,从而进行消融治疗。EnSite AutoMap模块包含了新的Turbo Map功能,使医生能够利用已记录的数据,用比当前系统快10倍的速度构建心脏标测图。
“与现有的技术相比,新的EnSite™ Velocity 5.0心脏三维标测系统可以在更短时间内收集更多标测数据,实现相对更加智能标测、精准建模,帮助医生迅速判断病灶位置,最终灵活配合医生展开消融治疗,提高手术效率。它相对智能、精准和灵活的特性还可以缩短医生的学习曲线,能够更好的开展临床工作。”中国医学科学院阜外医院心律失常中心副主任、博士导师姚焰教授表示,“我们期待EnSite心脏三维标测系统在临床治疗中的表现,不论是简单还是复杂的消融射频治疗,我们都可以利用这个系统为患者提供可拓展的程序选择并量身定制治疗方案,并在治疗的过程中将准确性和速度提升至一个新的水准 。”
目前,EnSite™ Velocity 5.0心脏三维标测系统已在欧洲、美国及日本获批上市,得到多家著名医院和电生理实验室的认可,其中在美国就有超过三万例临床应用。 “作为全球领先的医疗保健公司,雅培致力于帮助人们获得健康,拥有更美好的生活。我们不断引进创新医疗技术和设备,支持中国医疗事业的发展,帮助患有心律不齐等疾病的患者改善身体健康状况,活出精彩人生。”雅培心律管理和心衰业务中国总经理余金宝说。作为提供医生多元选择以支持对复杂心律疾病患者进行专业护理的行业领导者,雅培与全球知名的医院及医疗机构、电生理专家和医生保持着长期且紧密的协作关系,为有消融手术需求的患者们提供安全且最优性价比的治疗方案。他还表示,EnSite Velocity 5.0心脏三维标测系统的上市和投入应用,将极大推动中国电生理医学事业的发展,开启电生理领域智能标测新时代。
Ensite Velocity 5.0心脏三维标测系统于2017年11月,获得中国相关审批机构的上市许可,目前已在国内多家医院引进该产品并投入临床运用,未来将帮助更多的中国心律不齐患者解除病痛,早日拥有更健康的人生。
1.Ben-Haim S, Osadchy D, Schuster I, Gepstein L, Hayam G, Josephson M. Nonfluoroscopic, in vivo navigation and mapping technology. Nat Med. 1996; 2:1393-1395.
2.Gepstein L, Hayam G, Ben-Haim S. A novel method for nonfluoroscopic catheterbased electroanatomical mapping of the heart. In vitro and in vivo accuracy results Circulation. 1997; 95:1611-1622.
3.Gepstein L, Wolf T, Hayam G, Ben-Haim S. Accurate linear radiofrequency lesions guided by a nonfluoroscopic electroanatomic mapping method during atrial fibrillation. Pacing Clin Electrophysiol. 2001; 24:1672-1678.
4.Corrado D, Basso C, Leoni L, Tokajuk B, Turrini P, Bauce B, Migliore F, Pavei A, Tarantini G, Napodano M, Ramondo A, Buja G, Iliceto S, Thiene G. Threedimensional electroanatomical voltage mapping and histologic evaluation of myocardial substrate in right ventricular outflow tract tachycardia. J Am Coll Cardiol.2008; 51:731-739.
5.Koa-Wing M, Ho S, Kojodjojo P, Peters N, Davies D, Kanagaratnam P. Radiofrequency ablation of infarct scar-related ventricular tachycardia: Correlation of electroanatomical data with post-mortem histology. J Cardiovasc Electrophysiol.2007; 18:1330-1333.
6.Nademanee K, McKenzie J, Kosar E, Schwab M, Sunsaneewitayakul B, Vasavakul T, Khunnawat C, Ngarmukos T. A new approach for catheter ablation of atrial fibrillation: Mapping of the electrophysiologic substrate. J Am Coll Cardiol. 2004;43:2044-2053.