

诸如导管消融术和基于器械的介入治疗等新疗法,无疑将人们的注意力从传统的抗心律失常药物(AAD)上转移开来。然而,AAD仍然是节律管理的基石,尤其是在手术治疗不可用、无效、患者拒绝或在共同决策中不被优先选择时。事实上,在欧洲所有心房颤动(AF)患者中,只有约1.5%接受了消融,而在美国,超过40%的患者即使在消融后仍继续接受AAD治疗。

认识到这种持续的需求,欧洲心律协会(EHRA)制定了一份关于AAD的全面临床共识文件,为临床医生提供基于实际场景的实用指导。该文件长达72页,包含大量表格、文本框和图表,还有一份内容丰富的在线补充材料。在此,本文总结了10项关键信息,这些信息反映了该纲要最具相关性和临床适用性的主题。
01
AAD当代应用的ABC框架
该纲要引入了一个新的概念模型:AAD治疗的ABC框架(图A)。
适宜使用:AAD作为主要或首选疗法。
后备选择:当手术治疗不可行、有风险或无效时使用。
辅助补充:作为增强消融、器械或心脏复律疗效的辅助手段。
例如,对于房颤,AAD通常是急性药物复律或非阵发性房颤长期控制的一线选择;在等待手术期间、心律失常复发患者的消融空白期期间及之后,AAD也常被使用。
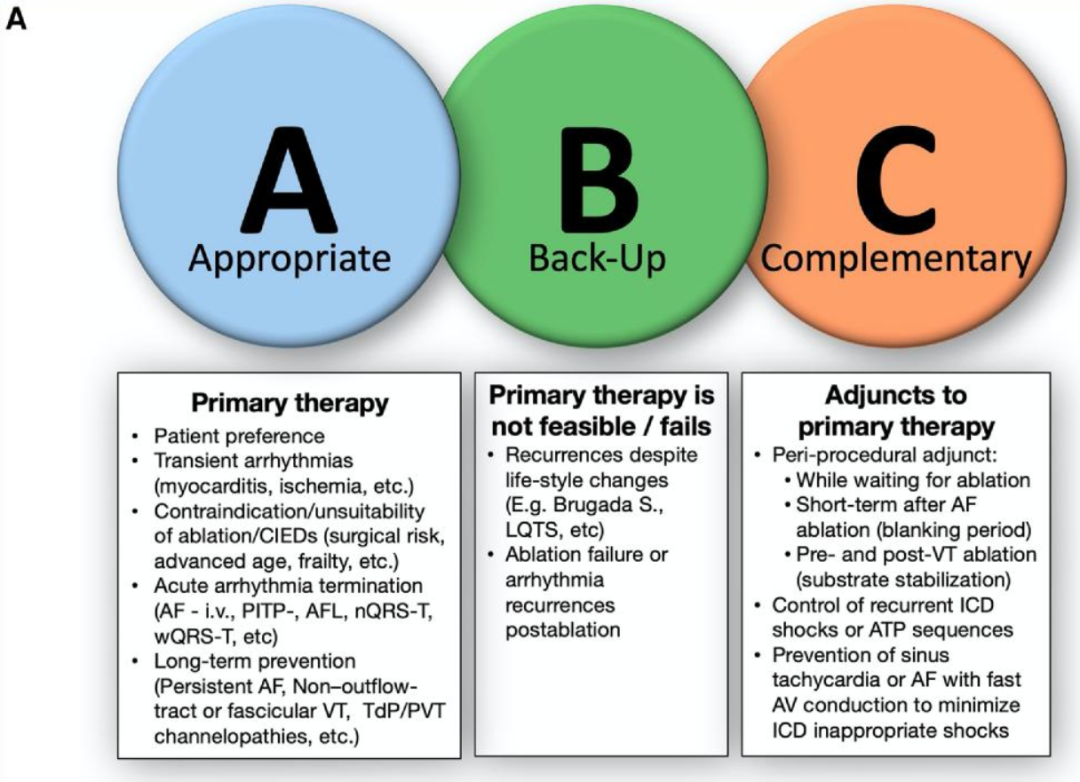
图A: AAD的临床应用框架。
EHRA实用纲要中的“ABC”模型将抗心律失常药物的使用分为A类——适当的一线治疗,B类——一线治疗不可行或失败时的后备治疗,以及C类——作为手术或器械治疗的辅助补充治疗。图中提供了每个类别的典型临床场景示例。
02
更新且实用的AAD分类
传统的Vaughan–Williams(VW)分类法虽然仍有用,但遗漏了地高辛、异丙肾上腺素、伊伐布雷定等药物,以及维纳卡兰或雷诺嗪等较新的药物。
EHRA采用了2018年VW分类的简化版本,纳入了现代和新兴药物,同时省略了目前没有可用药物的理论分类(图B)。这种实用格式有助于指导现实世界的治疗决策。同一类别内药物之间的差异也被注明。
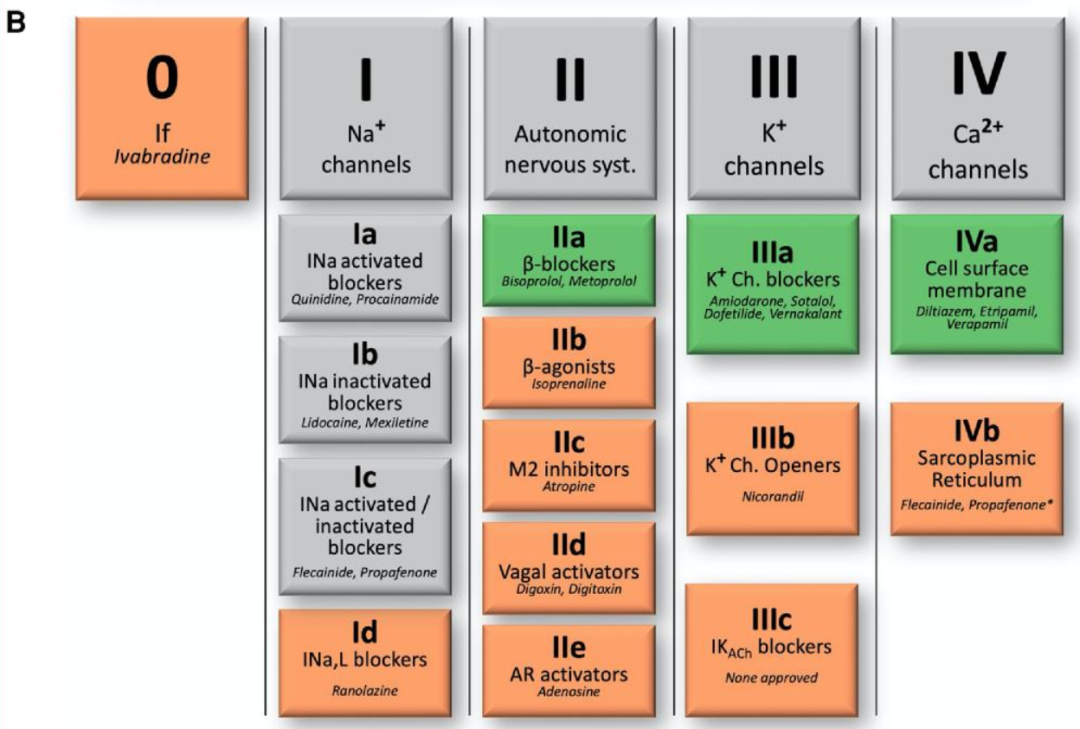
图B: AAD的Vaughan–Williams分类简化更新。
展示了0–IV类及代表性药物示例。每个类别及其亚类均以粗体突出显示,并在方框中标注了其主要的离子通道/受体/系统靶点和示例药物。类别列于顶部,其相应的亚类排列在下方。方框的颜色编码如下:灰色——与先前分类相比无显著变化;绿色——与经典VW方案相比已重新标记;浅红色——新引入的类别。
*氟卡尼和普罗帕酮属于Ic类抗心律失常药物,但也具有次要的细胞内肌浆网RyR2-Ca2+通道阻滞作用(IVb类),这在特定的心律失常(如儿茶酚胺敏感性多形性室速)中尤为相关。
AF:心房颤动;ACh:乙酰胆碱;AR:腺苷受体;ATP:抗心动过速起搏;Ca2+:钙;Ch:通道;CIED:心脏植入式电子设备;ICD:植入式心脏复律除颤器;If:起搏电流;INa和IK:钠电流和钾电流;INa,L:晚期钠电流;K+:钾;LQTS:长QT综合征;M2:2型毒蕈碱受体;Na+:钠;nQRS-T:窄QRS波群心动过速;PITP:口袋药;PVT:多形性室速;S:综合征;Syst.:系统;TdP:尖端扭转型室速;VT:室性心动过速;wQRS-T:宽QRS波群心动过速。
03
AAD当代应用的ABC框架
理解诸如正向与反向使用依赖性(药物的电生理效应随心率变化的关系)以及结合动力学等概念,对于选择正确的AAD至关重要。
例如,氟卡尼在较高心率时作用更强,使其能有效终止心动过速。相反,索他洛尔的效应在心动过缓时增强,增加了QT间期延长和尖端扭转型室速的风险,尤其当心律失常终止时,这也使得它在预防房颤方面比终止房颤更有效。
首过代谢和食物相互作用也很重要——例如,决奈达隆、胺碘酮、钙通道阻滞剂(CCB)和普萘洛尔等药物,与餐同服可增强吸收(减少首过代谢),因此应与食物同服。
04
适应症、禁忌症和选择流程图
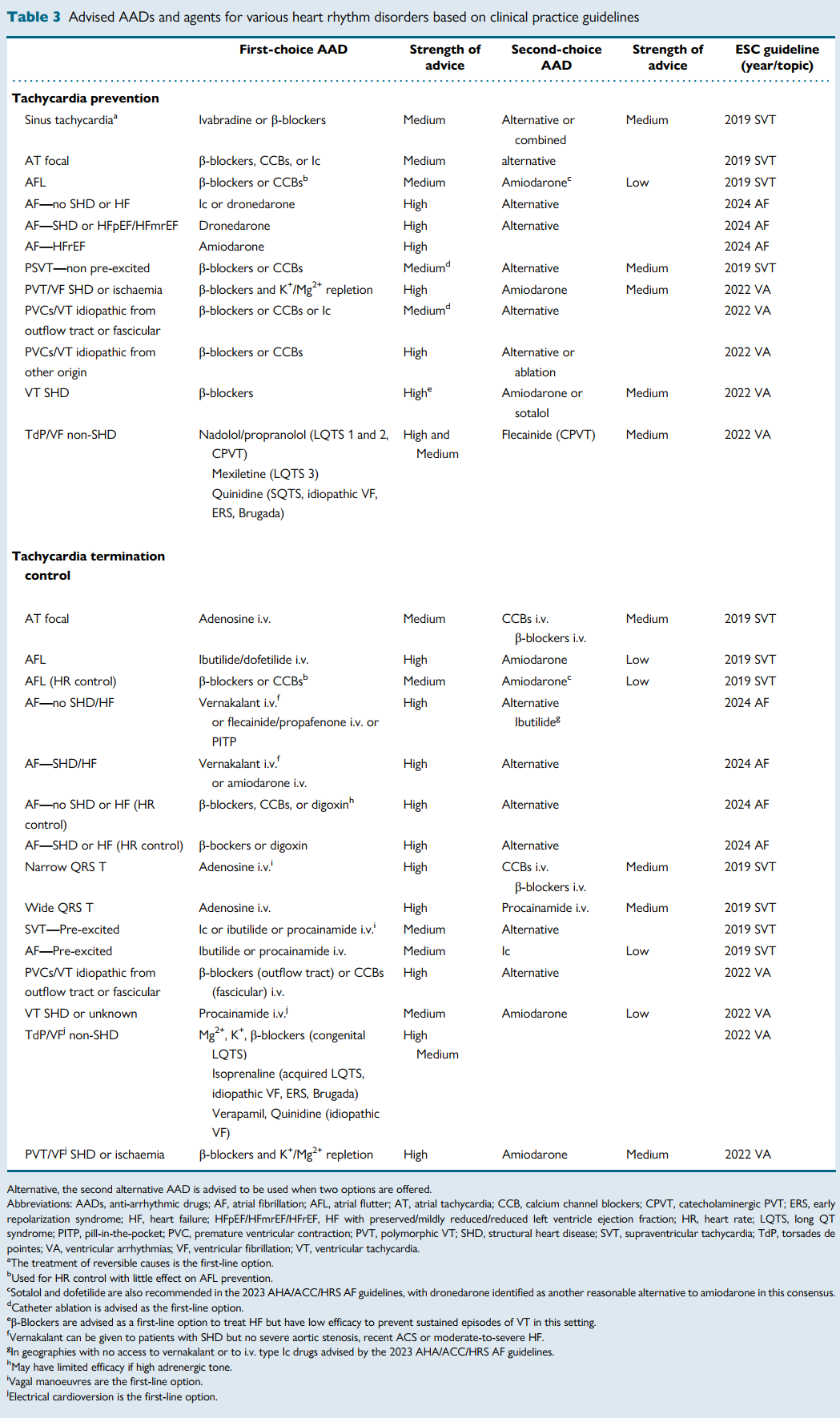
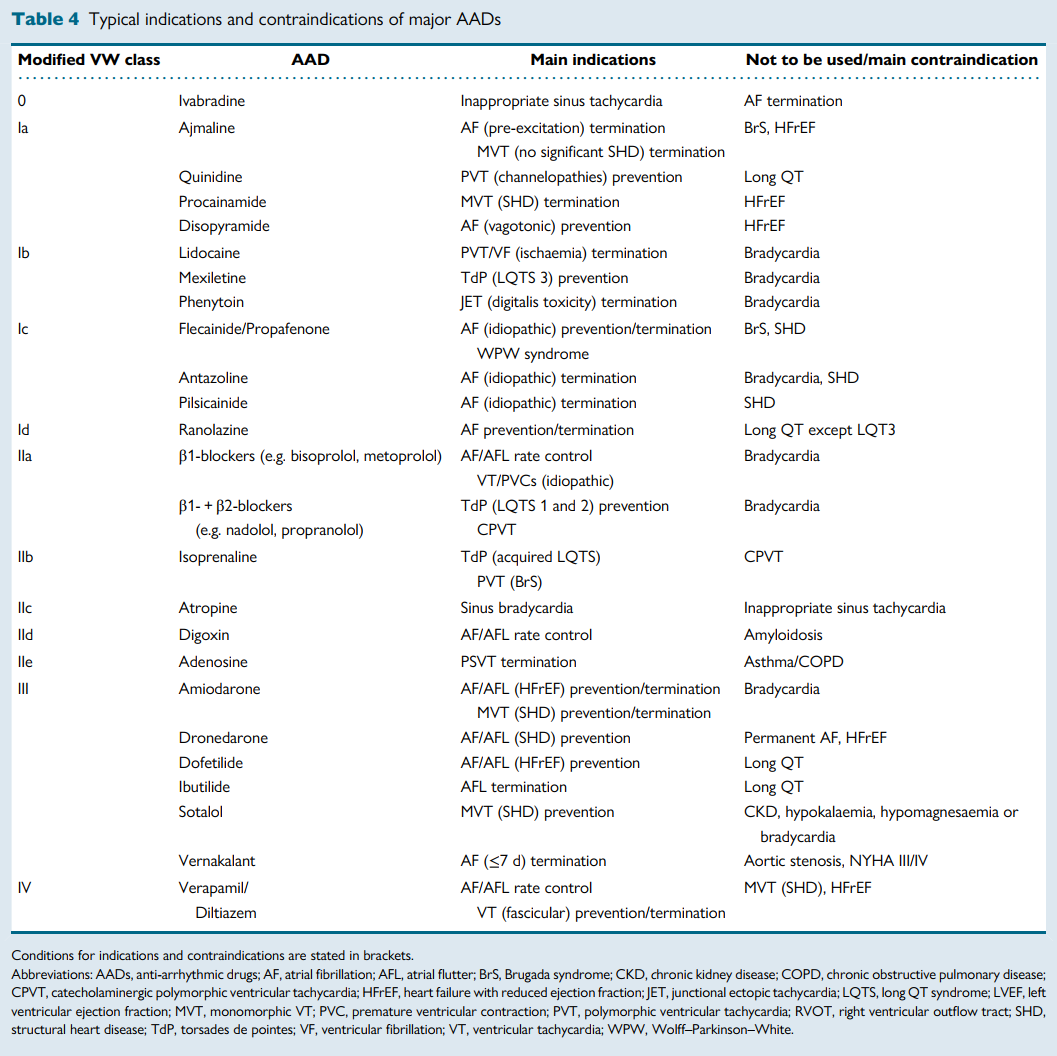
该纲要提供了一个全面的表格,列出了基于ESC和AHA/ACC/HRS指南的一线适应症、禁忌症和禁用警告。
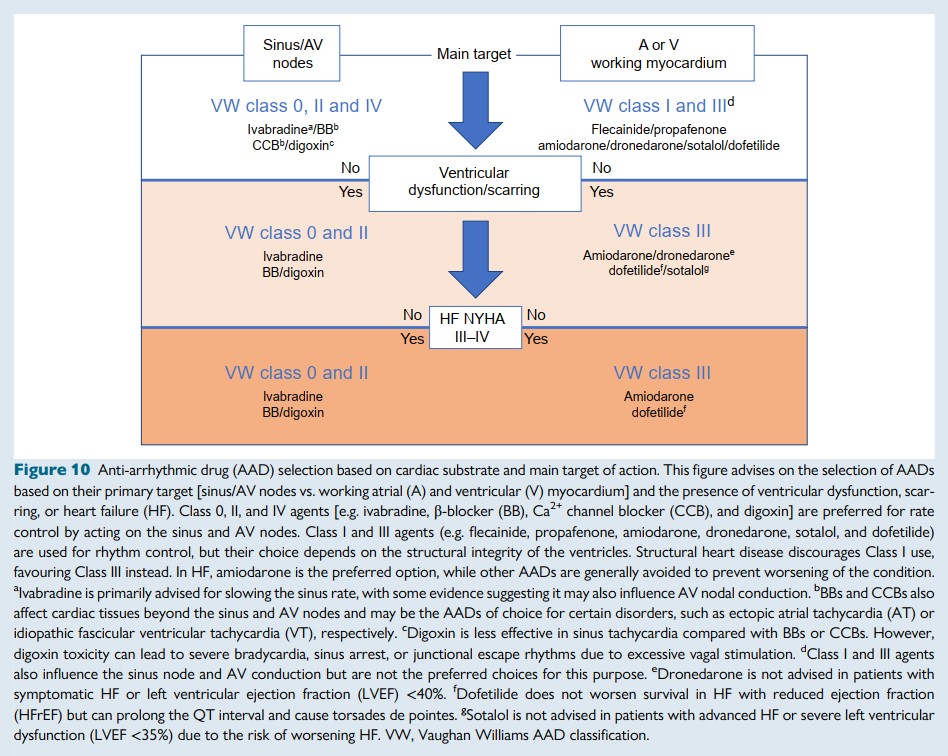
流程图帮助临床医生根据作用靶点(例如,窦房结/房室结与心房心肌/心室心肌)、是否存在结构性心脏病和心功能分级来确定药物选择。例如,当窦房结和房室结是主要目标时,首选伊伐布雷定、地高辛、CCB和β受体阻滞剂;而对于心肌性心律失常,通常首选I类和III类药物。
然而,在心室瘢痕或收缩功能不全的患者中应避免使用IC类药物和CCB,在NYHA心功能III–IV级心力衰竭患者中应避免使用索他洛尔和决奈达隆,因其存在致心律失常和/或血流动力学风险。
05
药物相互作用:避免陷阱
AAD常受到显著药物相互作用的影响,其中许多相互作用在实用表格中详细列出。
一个常见的误区是将胺碘酮与经CYP3A4代谢的他汀类药物(如阿托伐他汀和辛伐他汀)联合使用,这会增加肌病风险——应改用其他他汀类药物(如瑞舒伐他汀、普伐他汀)。与地高辛、抗凝药物和延长QT间期的药物等的相互作用也至关重要,需予以考虑。
06
AAD联合使用:何时以及如何使用?
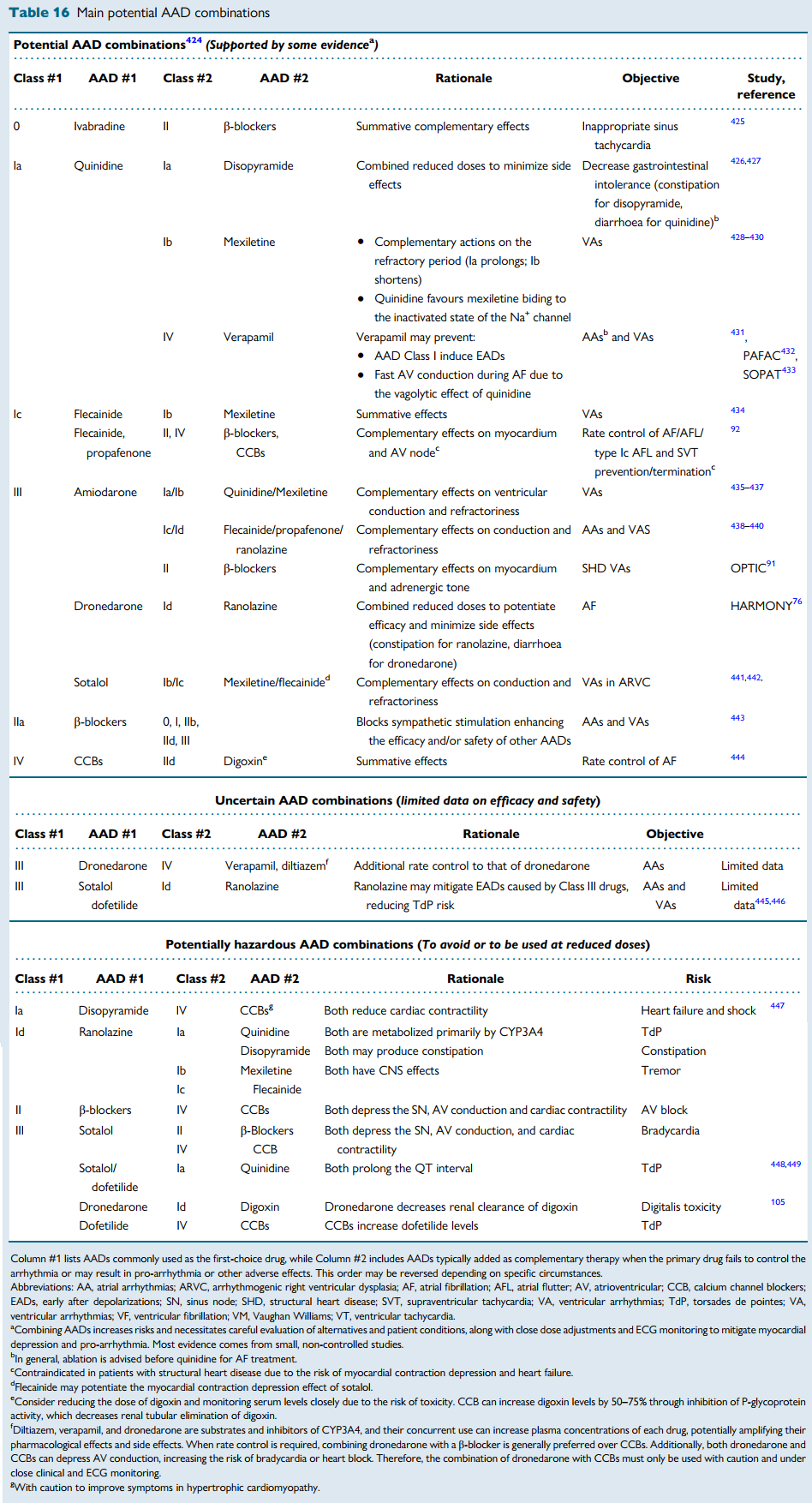
由于叠加毒性和致心律失常作用,通常应避免联合使用AAD,但某些联合用药具有策略性益处。
对于心房颤动转为心房扑动的情况,推荐使用IC类药物联合β受体阻滞剂或CCB,以防止房颤转为扑动时发生房室结快速传导。
对于室性心律失常,特别是合并右心室发育不良相关的室性心律失常,索他洛尔联合氟卡尼或美西律可能有效。
另一方面,应避免索他洛尔+奎尼丁等组合,这可能导致QT间期过度延长;也应避免决奈达隆+地高辛,这会降低地高辛排泄并增强其毒性。
07
毒性与致心律失常性:仍需关注
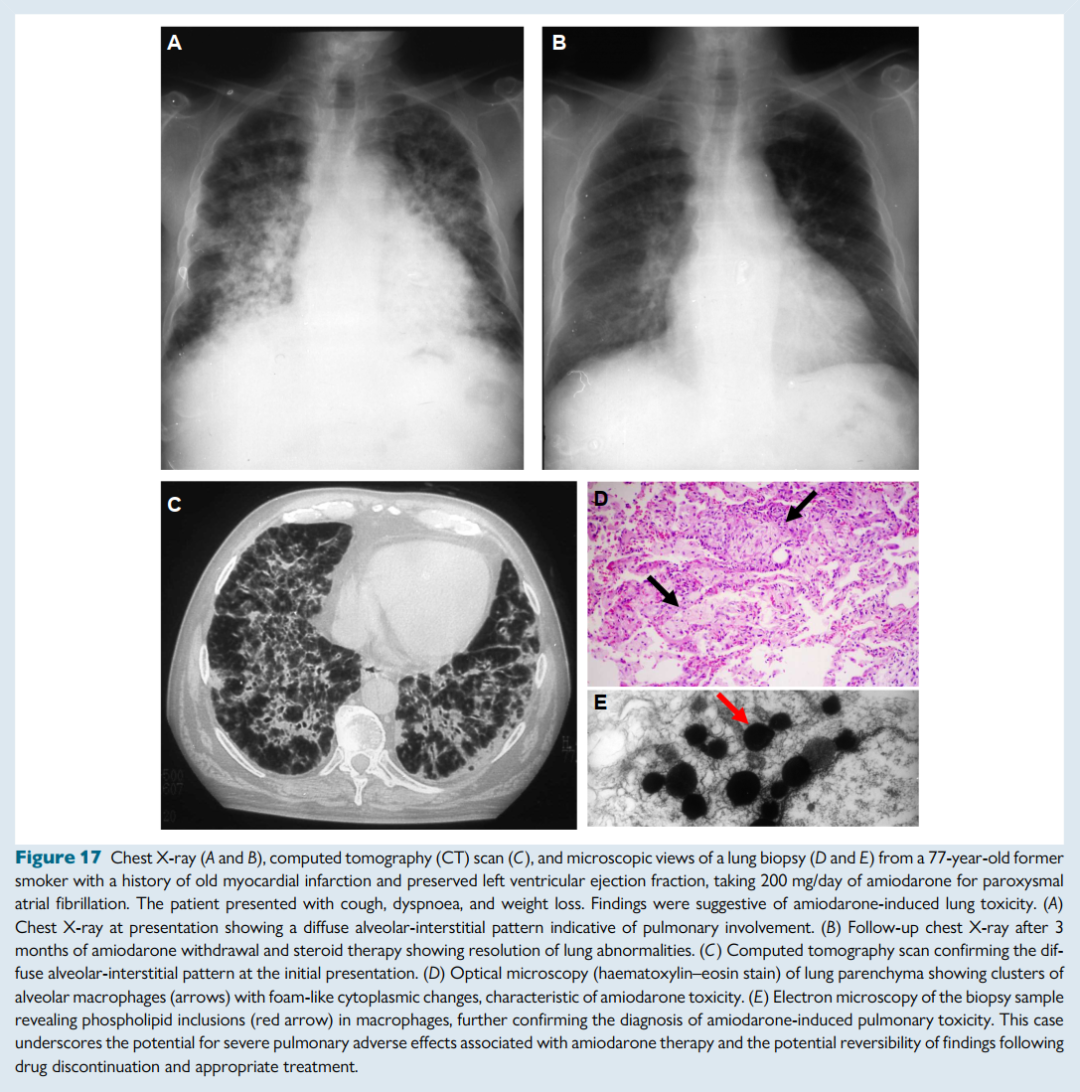
尽管在选择得当的情况下很少见,但毒性和致心律失常性仍然需要重点关注的问题。
胺碘酮可引起角膜沉积物(>90%)、甲状腺疾病、肝脏病变和肺纤维化(1%–2%)。
胺碘酮诱发的两种甲状腺毒症(AIT-1和AIT-2)在发病机制和治疗上有所不同。
在排除了结构性心脏病后,氟卡尼引起的室性心律失常现已较为罕见。

08
药物起始与监测:住院vs门诊vs口袋药
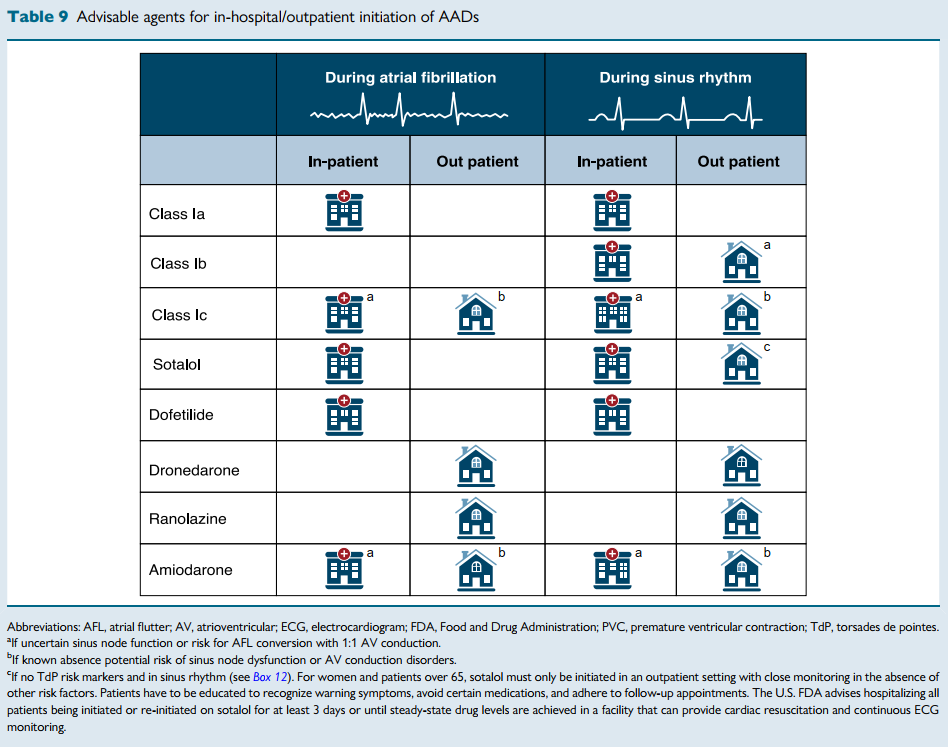
某些AAD(例如Ia类药物和多非利特)的起始用药仍需住院监测。
不过,对于使用氟卡尼、普罗帕酮或雷诺嗪的特定患者,鼓励采用“口袋药”方案(在医疗机构中首次证明有效且安全后,转为门诊用药)。
该纲要还概述了心电图监测计划、实验室随访以及基线检查(例如甲状腺、肝脏和肺部),尤其是针对胺碘酮的使用。
09
特殊人群中的应用
该纲要提供了针对妊娠期(避免胺碘酮、决奈达隆和阿替洛尔;优选其他β受体阻滞剂或地高辛)、老年人(考虑到预期肝肾功能下降,65岁以上者起始剂量减量,75岁以上者起始剂量减半,并缓慢调整剂量)、心力衰竭、离子通道病、先天性心脏病和运动员的详细指导。
10
剂型、剂量与未来药物
该纲要提供了一个专用表格总结了全球最常见的剂型、剂量和给药途径。有些药物仅在部分国家有售。
依曲帕米(Etripamil)是一种短效鼻内给药的钙通道阻滞剂,即将获批用于在家中自行给药以终止室上性心动过速。
吸入性氟卡尼可能为房颤终止提供快速起效的效果。
其他在研药物包括budiodarone、HDAC6抑制剂和小电导K+通道阻滞剂。
AAD远未过时。它们仍然是管理各类患者和临床场景中心律失常的关键——随着人口老龄化和医疗资源持续紧张,这种药物需求只会有增无减。
EHRA实用纲要不仅提供了更新的药理学知识,还提供了一个用于现实世界临床决策的工具箱。只要选择得当,AAD就会继续发挥作用,而且会比以往更智能、更安全,也更不可或缺。
出处:European Heart Journal, Volume 47, Issue 3, 14 January 2026, Pages 286–289,
https://doi.org/10.1093/eurheartj/ehaf805