

如果您有重磅研究成果或精彩案例
诚邀您向我们投稿
本平台将充分发挥学术传播优势
助力提升您研究成果的学术影响力与行业可见度
12月22日,四川大学华西医院心脏大血管外科联合国内15家心脏中心,在心血管介入领域顶级期刊《JACC: Cardiovascular Interventions》上发表论文《Mid-Term Outcomes of a Novel TAVR Device for Pure Aortic Regurgitation: A Prospective, Multicenter Trial》。该研究旨在评估我国自主研发的PIONEER TAVR主动脉瓣反流系统,在治疗外科高危或无法手术的单纯性自体主动脉瓣反流患者中的中期安全性与有效性,为这一临床难题提供了全新的中国器械解决方案。
背景
重度主动脉瓣反流(AR)患者常伴有复杂的合并症与解剖结构异常,使得相当一部分患者不适合接受常规外科手术干预。
尽管经导管主动脉瓣置换术(TAVR)目前已成为主动脉瓣狭窄的主要治疗方法,但其在单纯性自体AR患者中的应用,仍受限于解剖学和技术上的障碍。具体而言,AR患者缺乏用于器械锚定的钙化结构,且反流量大,这使得最初为主动脉瓣狭窄设计的常规TAVR系统应用时,瓣膜移位和瓣周漏的风险增加。在AR中超适应症使用自膨胀式和球囊扩张式经导管心脏瓣膜(THV)显示出更高的死亡率、瓣周反流和瓣膜移位率。
最近,针对已获得CE认证的JenaValve Trilogy THV(JenaValve Technology)的ALIGN-AR试验结果,展示了令人满意的技术和器械成功率,且死亡率低、并发症少。类似的J-Valve(JC Medical)在一项同情使用试验中也显示出良好的短期结果。基于这些有利结果,最新的2025年ESC/EACTS瓣膜性心脏病管理指南指出,对于有症状的重度AR且经心脏团队评估不适合手术的患者,若解剖结构合适,可考虑采用TAVR治疗。因此,开发针对解剖结构优化的TAVR装置,并在中高危AR人群中对其安全性和有效性进行扎实的临床验证,是结构性心脏病治疗领域中一个关键且尚未满足的需求。
Pioneer瓣膜系统(科凯生命科学公司)的首次人体应用经验已显示出可接受的短期结果。本研究报告了Pioneer瓣膜系统在有症状的重度单纯性自体AR患者中进行的前瞻性试验的1年结果。
研究方法
研究设计与患者
本研究为一项前瞻性、多中心、单臂临床研究,研究于2023年5月至11月期间,前瞻性纳入了来自中国15个中心的110例连续患者,所有患者均经多学科心脏团队评估,并依据综合风险评估模型(包括胸外科医师协会预测死亡风险、衰弱程度、主要器官功能障碍及手术特异性障碍)判定为高危或不可手术患者。
主要纳入标准为:年龄≥65岁、经超声心动图定义的严重单纯性自体AR、以及NYHA心功能分级≥II级。主要排除标准包括:二叶式主动脉瓣、活动性心内膜炎、30天内发生急性心肌梗死或接受冠状动脉血运重建、30天内发生脑血管意外、超声心动图发现心内占位(包括血栓和赘生物)、梗阻性肥厚型心肌病、需要手术干预的其他瓣膜疾病、任何瓣膜干预史、左心室射血分数<20%,以及抗凝治疗禁忌症。
术前使用多排计算机断层扫描评估主动脉根部和瓣膜解剖结构,并确定主动脉瓣环尺寸。
装置与手术流程
Pioneer瓣膜是一款专门为治疗单纯性自体AR而设计的经股动脉自膨式TAVR系统。其创新设计镍钛合金支架有一个带抓握特征的喇叭形流入端以提高锚定稳定性,以及一个圆形的外密封裙边,旨在确保更好的密封并防止瓣周漏。三个独立角度可调的镍钛合金定位器,允许根据不同的瓣叶形态进行实时、患者特异性的对齐,优化瓣叶捕获精度,确保交界对齐和精确定位。Pioneer瓣膜有4种尺寸(25、27、29和31mm),可用于直径为22至30mm的自体主动脉瓣环。输送系统采用双段式三维可调弯技术,即使在心脏位置横位的患者中也能确保最佳的同轴对齐(图1)。
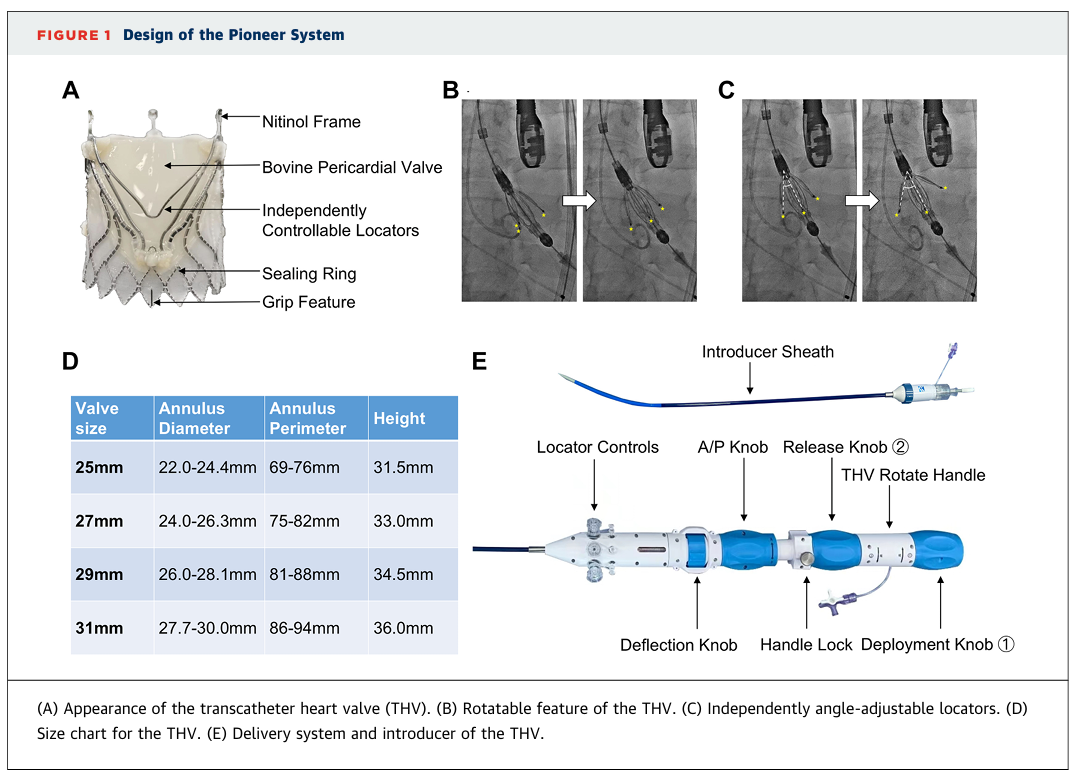
图1 Pioneer瓣膜系统设计
所有手术均在杂交手术室中进行,采用全身麻醉,并在经食管超声心动图和透视引导下完成。所有患者均接受阿司匹林和氯吡格雷双联抗血小板治疗6个月。合并心房颤动的患者则接受长期华法林抗凝治疗。
终点与随访
主要终点是1年随访时的全因死亡率。次要终点包括技术成功率、器械成功率、主要不良事件、血流动力学参数、NYHA心功能分级症状的减轻以及截至1年时的生活质量改善。主要不良事件包括心肌梗死、卒中、新植入永久起搏器、大出血、主要血管并发症、急性肾损伤、其他手术并发症(中转开胸手术、瓣环破裂、心脏压塞、心内膜炎、瓣膜血栓形成、瓣膜移位和瓣周漏)以及心血管原因再住院。所有终点事件均根据瓣膜学术研究联盟-3的定义进行判定,并由一个临床事件委员会进行中心化裁定。
通过医院信息系统收集基线特征、超声心动图、心电图和计算机断层扫描数据。所有患者术后在7天、30天、6个月和1年时接受超声心动图随访。临床随访中位时间为348天。
研究结果
基线特征
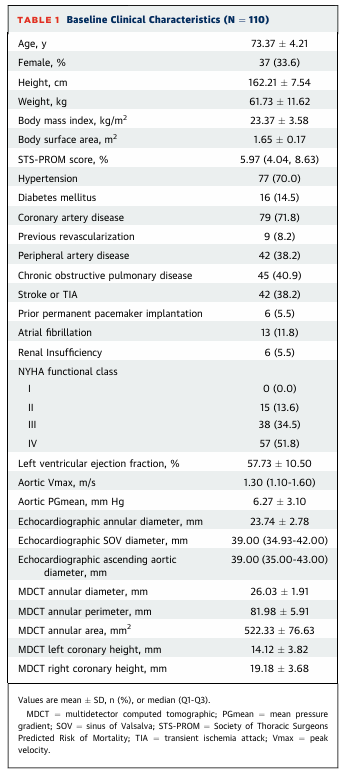
2023年5月至11月期间,共筛查了118例患者,最终纳入了来自15个参与中心的110例连续的重度单纯性自体主动脉瓣反流患者。基线特征总结于表1。
表1:基线特征
手术特征
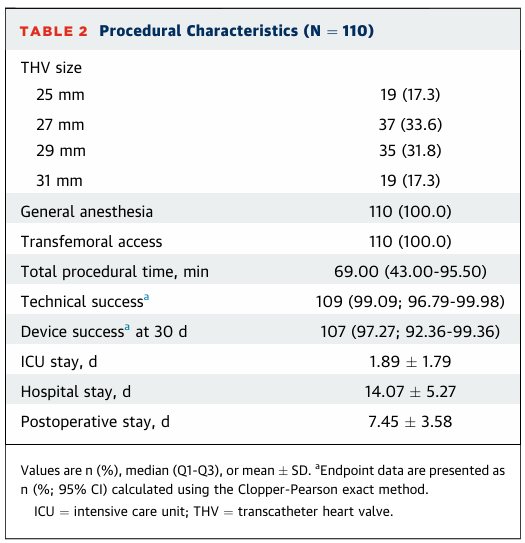
手术特征总结于表2。所有110例患者均在全身麻醉下接受了经股动脉Pioneer瓣膜系统植入。术中1例患者发生瓣膜移位至升主动脉,该患者随后植入了商用经导管心脏瓣膜(Venus A-Valve, Venus MedTech)。技术成功率为109/110(99%)。所有患者在术中均未发生心肌梗死、卒中、瓣环破裂或急性肾损伤。植入后即刻,所有患者均未出现中度或更重的跨瓣主动脉瓣反流或瓣周漏。仅有1例患者存在轻度残余反流,44例患者存在轻度瓣周漏。术后30天的器械成功率为107/110(97.27%; 95% CI: 92.36%-99.36%)。
表2:手术特征
临床结果与随访
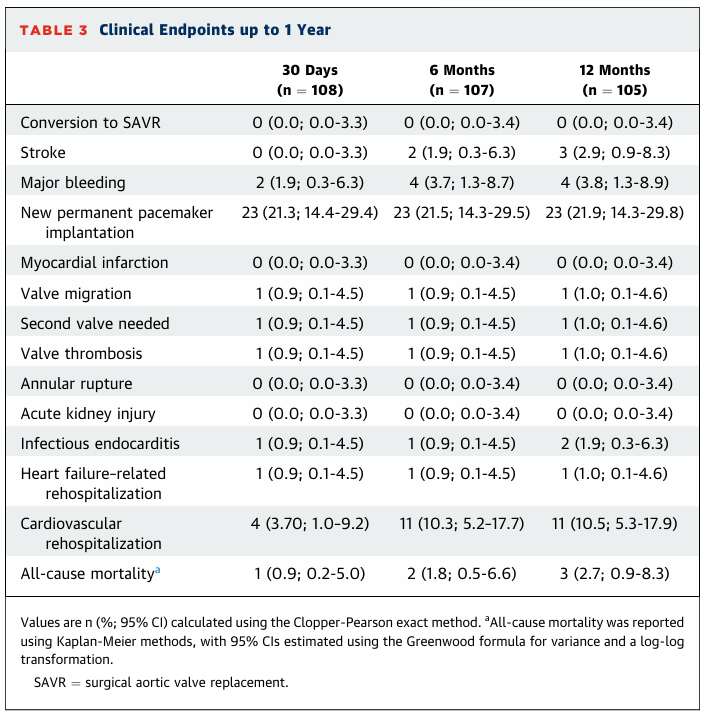
截至1年随访期的临床结果详见表3。中位临床随访时间为348天(Q1-Q3: 342-357天)。
表3:截至1年随访期的临床结果
安全性终点
30天全因死亡率为1/110(0.9%;95% CI:0.2%-5.0%),该患者于术后住院期间死于心源性猝死。6个月和1年全因死亡率分别为2/110(1.8%;95% CI:0.5%-6.6%)和3/110(2.7%;95% CI:0.9%-8.3%)。其中,1例患者于5个月时死于颅内出血,1例患者于9个月时因循环衰竭被推定为心源性死亡。所有患者在30天时均未发生卒中;在1年随访时,105例患者中有3例(2.9%;95% CI:0.9%-8.3%)发生卒中。1年时未发生冠状动脉梗阻和急性肾损伤。在30天时,因发生三度房室传导阻滞或完全性束支传导阻滞,105例患者中有23例(21.5%;95% CI:14.3%-29.8%)新植入了永久起搏器。截至1年,共有4/105例(3.8%;95% CI:1.3%-8.9%)发生大出血(危及生命或致残性)。1例在30天时发现的瓣膜血栓经华法林治疗后被消除。105例患者中有2例(2%;95% CI:0.3%-6.3%)发生感染性心内膜炎;其中1例发生在30天内,经抗生素治疗成功;另1例发生在6个月时,因抗生素治疗无效而接受了经导管心脏瓣膜手术移除。
有效性终点
如图2所示,患者报告了显著的功能改善。在105例患者中,有103例(98.1%)未出现NYHA心功能III级或IV级症状。其中,60例(57.1%)为心功能I级,43例(41.0%)为心功能II级。图3A和3B显示,在1年随访期间,堪萨斯城心肌病问卷(KCCQ)评分持续显著改善。91%的患者在1年时KCCQ生活质量评分有所提高:其中,105例患者中有78例(74.3%)表现为大幅改善(增加≥20分),13例(12.4%)为中度改善(增加10至<20分),5例(4.76%)为轻度改善(增加5至<10分)。
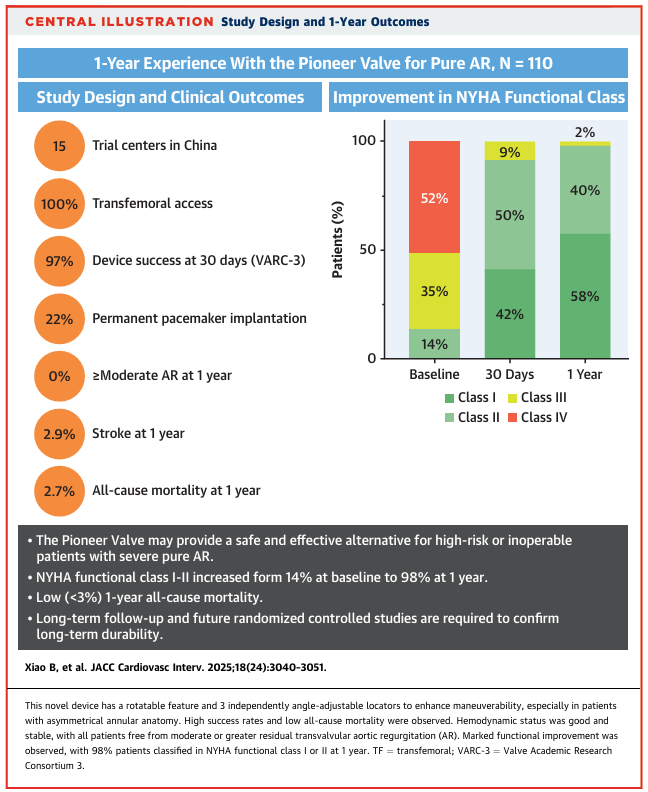
图2 研究设计与1年随访结果
血流动力学表现与超声心动图发现
表4总结了术后心室尺寸与血流动力学参数的纵向变化。在6个月和1年随访时,平均有效瓣口面积分别为2.01 ± 0.49 cm²和2.05 ± 0.48 cm²(图3C)。平均主动脉瓣压差在6个月时为8.50 ± 2.98 mm Hg,并在1年时保持稳定(8.72 ± 3.26 mm Hg)(图3D)。主动脉峰值流速在6个月时短暂升高至1.98 ± 0.34 m/s,但在1年时稳定在2.02 ± 0.36 m/s。左心室舒张末期内径和收缩末期内径从基线时的59.11 ± 7.35 mm和41.13 ± 8.69 mm,进行性下降至1年时的50.28 ± 5.93 mm和34.62 ± 6.57 mm,这表明了显著的心脏逆重构。同样,左心室舒张末期容积和收缩末期容积也持续减少。TAVR术后左心室射血分数未发生显著变化。
在1年随访时,104例患者中有69例(66.3%)完全无瓣周漏。34例患者(32.7%)存在轻度瓣周漏,仅1例患者(1.0%)存在中度瓣周漏。103例患者中有92例(88.5%)无跨瓣主动脉瓣反流,仅11例(10.6%)在1年时存在轻度残余反流。
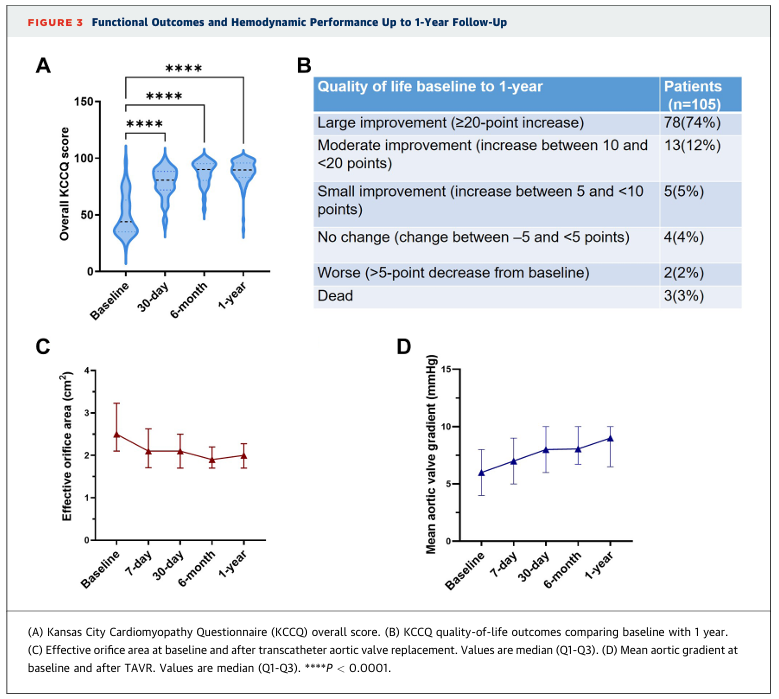
图3 功能结局与血流动力学表现:1年随访结果
表4. 超声心动图数据
研究结论
本研究表明,对于高风险或无法手术的重度单纯性AR患者,Pioneer瓣膜提供了一种安全有效的替代治疗选择,取得了良好的中期结果,并具有稳定的血流动力学性能。
