

Karol WATSON教授:认识妊娠期糖尿病,一种女性特有的终身性心血管疾病风险因素
妊娠期糖尿病(GDM)在全球范围内十分常见,约7%的孕妇会受到GDM影响,世界各地的患病率在1%~14%之间不等,GDM的病理生理核心是妊娠相关的胰岛素抵抗状态,主要由胎盘分泌的激素等驱动。
GDM对母婴双方均会带来长期影响。在对母亲的影响方面,有GDM病史的女性,日后罹患2型糖尿病的风险显著增加:约30%~50%曾有GDM的女性,在分娩后的5~10年内会患上2型糖尿病,有研究指出,如果不采取预防性干预措施,高达60%有GDM病史的女性最终可能患上2型糖尿病,该风险受肥胖、糖尿病家族史、种族和生活方式行为等因素影响,鉴于这种高风险,美国糖尿病协会、美国妇产科医师学会、世界卫生组织等发布的相关指南建议对曾有妊娠期糖尿病的女性终身进行糖尿病筛查,通常是在产后6~12周进行75 g口服葡萄糖耐量试验,之后每1-3年复查一次。在对胎儿的影响方面,子宫内环境对发育中胎儿的影响可能持续终生,有假说认为,母体代谢的改变可能影响胎儿结构发育,这些变化或许会对子代的代谢功能产生远期影响。
GDM的管理策略强调预防与干预,应针对高风险女性实施预防妊娠期糖尿病的干预措施,对于曾有GDM病史的女性则需积极控制危险因素,如保持正常BMI、健康饮食、规律运动、戒烟等。除此之外,二甲双胍在产后干预中显示出改善代谢指标的潜力,未来二甲双胍等预防性药物可能展现出更多益处。
陈桢玥教授:妊娠期、哺乳期、绝经期等女性特殊生命阶段的血脂水平评估和管理

脂代谢存在显著性别差异,该差异由性别特异性因素及激素效应导致,具体表现在基因表达水平、肥胖患病率、雌激素水平影响女性脂肪分布模式等多个方面。
女性通常面临着妊娠、哺乳、绝经等特殊时期。妊娠期血脂呈现生理性适应特征,遵循“早期储存,晚期动员”模式,TG升高最为显著,可达非孕时的2~4倍,TC、LDL-C、HDL-C同样呈上升趋势,HDL-C在妊娠晚期可能略有下降,此变化由激素水平改变、胰岛素抵抗及胎盘作用共同调控,旨在为胎儿发育及产后泌乳提供能量与原料。然而,妊娠期血脂变化可诱发急性脂肪肝、子痫前期和妊娠期糖尿病等病理性风险,管理应以生活方式干预为主,药物选择相对有限,目前唯一获批用于孕妇的降脂药物为胆汁酸螯合剂。
哺乳期对母体代谢有积极影响,可改善血脂并动员孕期储存脂肪,但所有妊娠期禁用的降脂药物在哺乳期仍属禁忌,鉴于哺乳对代谢健康的益处与重启降脂治疗的需求存在矛盾,需在分娩前及产后第四孕期的每次随访中启动共同决策,综合评估他汀治疗中断期与持续哺乳的风险获益比。
绝经后,因内源性雌激素水平急剧下降,其对血脂的保护作用减弱,导致血脂谱呈现明确的致动脉粥样硬化模式。绝经期风险管理需高度个体化,进行全面的心血管风险评估,并关注早发性绝经、妊娠并发症等女性专属风险增强因子。
Nandita SCOTT教授:妊娠相关自发性冠状动脉夹层——妊娠期女性心肌梗死的主要原因之一

P-SCAD特指发生于妊娠期间或产后一年内的自发性冠状动脉夹层,是妊娠期急性心肌梗死的常见病因之一,且绝大多数事件集中发生于产后早期,尤其是第一周内。P-SCAD的发生与妊娠期激素变化、血流动力学改变导致的血管脆弱性相关,与非妊娠相关的SCAD相比,P-SCAD患者通常临床表现更为危重,更常表现为STEMI、左心室收缩功能降低以及累及左主干或多支血管的夹层。
在治疗策略上,对存在进行性缺血、心源性休克或左主干夹层等高风险特征的患者,应考虑PCI或CABG,但因夹层血管壁脆弱,PCI技术挑战大,并发症风险较高。对绝大多数病情稳定的患者,首选保守药物治疗,核心方案包括阿司匹林、β受体阻滞剂等。值得注意的是,多数SCAD病例在影像学上可观察到自愈现象。
P-SCAD的长期管理涵盖多个层面,分娩管理需多学科协作,涉及分娩时机与方式选择、抗血小板治疗、心脏康复及避孕咨询等。另外,SCAD后PTSD的发生率较高,诊断时年龄较轻与更持久严重的PTSD症状相关。关于SCAD后再次妊娠,现有观察性研究及荟萃分析并未明确证实其与SCAD复发存在强关联,目前证据尚不足以支持普遍性的禁孕建议,决策应基于个体化风险评估及充分的医患共同决策。
总体而言,目前对P-SCAD的认知仍存在诸多空白,包括复发的确切预测因素、辅助生殖技术的安全性、母乳喂养的影响以及最佳分娩方式等,均需更多研究以进一步阐明。
Emily LAU教授:更年期是女性生命周期中的重要阶段,其与CVD关联密切
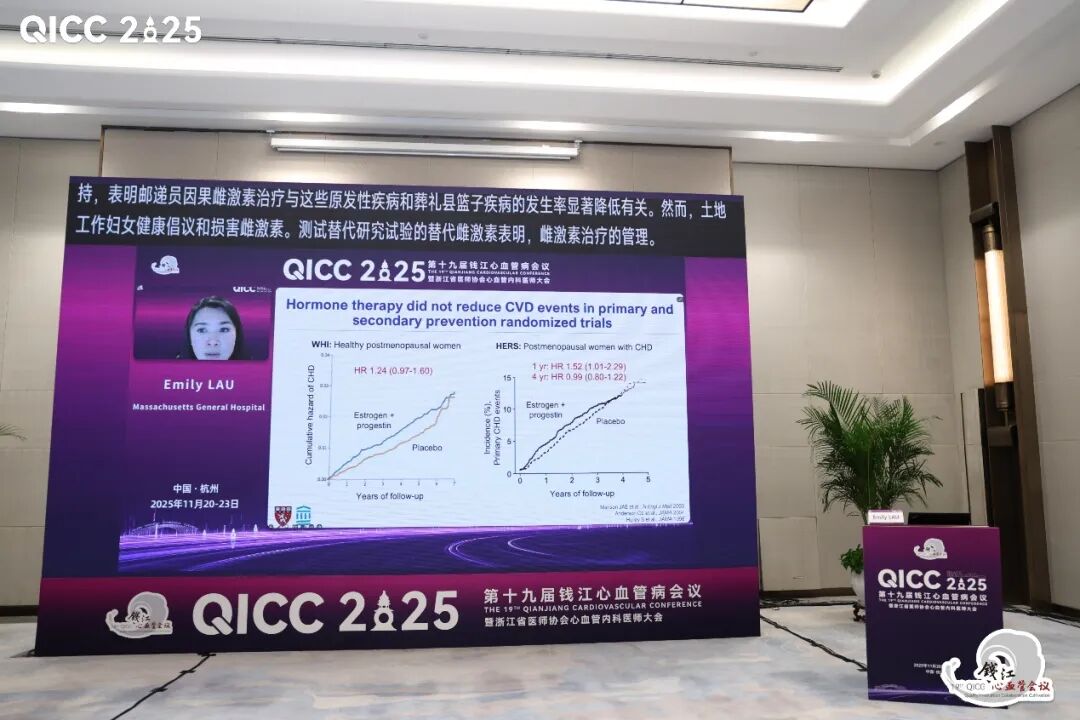
更年期是女性生命周期中的重要阶段,女性一生中多达40%的时间处于绝经后状态。大量证据表明,绝经后女性在各年龄组的CVD发病率均显著高于绝经前女性,风险增加近两倍。围绝经期过渡阶段是心血管代谢健康发生不利变化的关键窗口。有研究证实,在此期间女性LDL-C水平上升,体脂率增加,特别是内脏脂肪组织显著堆积,这些变化与亚临床心血管疾病的加速进展直接相关。
关于MHT与CVD风险的关系,观察性研究与随机对照试验的结果存在显著差异,这种差异催生了“时机假说”,即MHT的启动时机至关重要。荟萃分析表明,在年龄<60岁或绝经后<10年内启动MHT可能与较低CVD风险相关,而晚于该时间窗启动则无心血管获益。后续的KEEPS和ELITE试验进一步为“时机假说”提供了机制层面的支持。
基于现有证据,当前MHT的启动决策需进行个体化风险评估。临床指南建议依据患者的10年ASCVD风险、绝经年限以及血管舒缩症状严重程度进行分层管理。对于不适用MHT或高风险患者,非激素替代方案是重要的治疗选择。
最后,相关研究还指出,更年期状态及血管舒缩症状本身可能通过影响全身炎症和内皮功能和冠状动脉微血管功能等进而影响CVD风险。未来需要通过纵向分子谱分析等机制研究,更深入地揭示更年期影响心血管健康的具体生物学路径。
刘梅林教授:女性高血压管理专家共识解读

2025年,《中华心血管病杂志》最新发布了《女性高血压管理专家共识》,共识指出,我国女性高血压患病率持续上升,并在60~65岁后超过男性。美国长期随访数据显示,随年龄增加,女性收缩压、舒张压升高幅度大于男性,且收缩压升高幅度随年龄增加而增大。
女性高血压的发病机制与雌激素水平变化密切相关,雌激素通过调节血管、肾脏和心脏等细胞钙依赖调控途径、一氧化氮合酶和肾素-血管紧张素-醛固酮系统影响血压,雌激素减少导致交感神经系统激活、血管内皮肾上腺素受体表达及NO合成增加,通过氧化应激、炎症和盐敏感等机制导致血管舒张功能受损。此外,女性特有的生理阶段如妊娠、更年期以及口服避孕药、多囊卵巢综合征等均构成独特的危险因素。
临床预后方面,女性在相同血压水平下发生心脑血管事件及靶器官损害的风险高于男性,尽管知晓率较高,但治疗率与控制率更不理想。与中青年女性相比,老年女性的血压控制率更低。
特殊时期的女性高血压管理更应个体化:妊娠期高血压需注重运动及综合管理,可选择β-受体阻滞剂、CCB类药物和甲基多巴,妊娠期重度高血压则需静脉注射拉贝洛尔、口服甲基多巴或口服硝苯地平治疗;产后需注意降压药在乳汁中的安全性,肼苯达嗪是一种哺乳期母亲与新生儿可接受的降压药;绝经后高血压患病率高,噻嗪类利尿剂减少钙排泄而预防骨质疏松症,或能带来更多治疗获益;精神压力相关的高血压在女性中突出,需结合心理干预与药物治疗。综上,女性高血压管理需采取贯穿生命全周期的个体化综合策略。
Amy SARMA教授:妊娠期心脏应激及心血管功能障碍的识别与管理

正常妊娠伴随显著血流动力学改变:心输出量增加、心率增快、全身血管阻力下降,形成高容量、高动力循环状态,这些生理变化可能导致与心血管疾病早期表现相似的症状,如呼吸困难、功能性收缩期杂音、下肢水肿等,增加了临床鉴别诊断的难度。
心血管疾病已成为全球孕产妇发病率和死亡率的主要原因,风险贯穿整个围产期并延伸至产后第一年。风险评估工具包括2001年加拿大的心脏病妊娠风险指数评分法(CARPREGⅡ)和改良版WHO妊娠心血管风险分级(mWHO),用于量化妊娠心脏事件风险并指导分级管理。狭窄性瓣膜病变尤其是二尖瓣狭窄在妊娠期耐受性显著降低,即使孕前无症状者也可能出现失代偿,管理策略包括通过β受体阻滞剂控制心率、使用利尿剂缓解心衰症状,以及在具备条件的中心行经皮二尖瓣球囊成形术等。
此外,妊娠期并发症如子痫前期可通过内皮功能障碍和血管阻力增加诱发左心室向心性肥厚及舒张功能障碍,并显著增加远期心血管疾病风险。常规超声心动图可用于监测妊娠相关心脏结构及功能变化,利钠肽在心力衰竭评估中则具有一定阴性预测价值。总的来说,妊娠既是短期心血管应激事件,也是揭示女性终身心血管健康风险的重要窗口期。
总结
本次会议聚焦女性心血管健康的特殊性,国内外多位专家从女性不同生命阶段展开深入探讨。Karol WATSON教授指出妊娠期糖尿病是女性终身心血管风险因素,需加强产后筛查与代谢管理。陈桢玥教授强调女性血脂管理需结合妊娠、哺乳及绝经等阶段特点,进行精准干预。Nandita SCOTT教授系统介绍了妊娠相关自发性冠状动脉夹层的临床表现与治疗策略,强调治疗选择与多学科随访。Emily LAU教授指出更年期伴随心血管代谢恶化,MHT需把握时机并个体化评估。刘梅林教授解读中国女性高血压管理专家共识,指出女性高血压与激素变化密切相关,需全周期综合干预。Amy SARMA教授则关注妊娠期心脏应激反应及其对长期心血管健康的影响。与会专家一致认为,女性心血管疾病管理应贯穿生命全周期,结合性别特异性风险,实施个体化、多维度防治策略。
本文由心关注/医望原创供稿
