

第37届美国经导管心血管治疗学术会议(TCT 2025)于10月25日至28日在美国旧金山拉开帷幕。
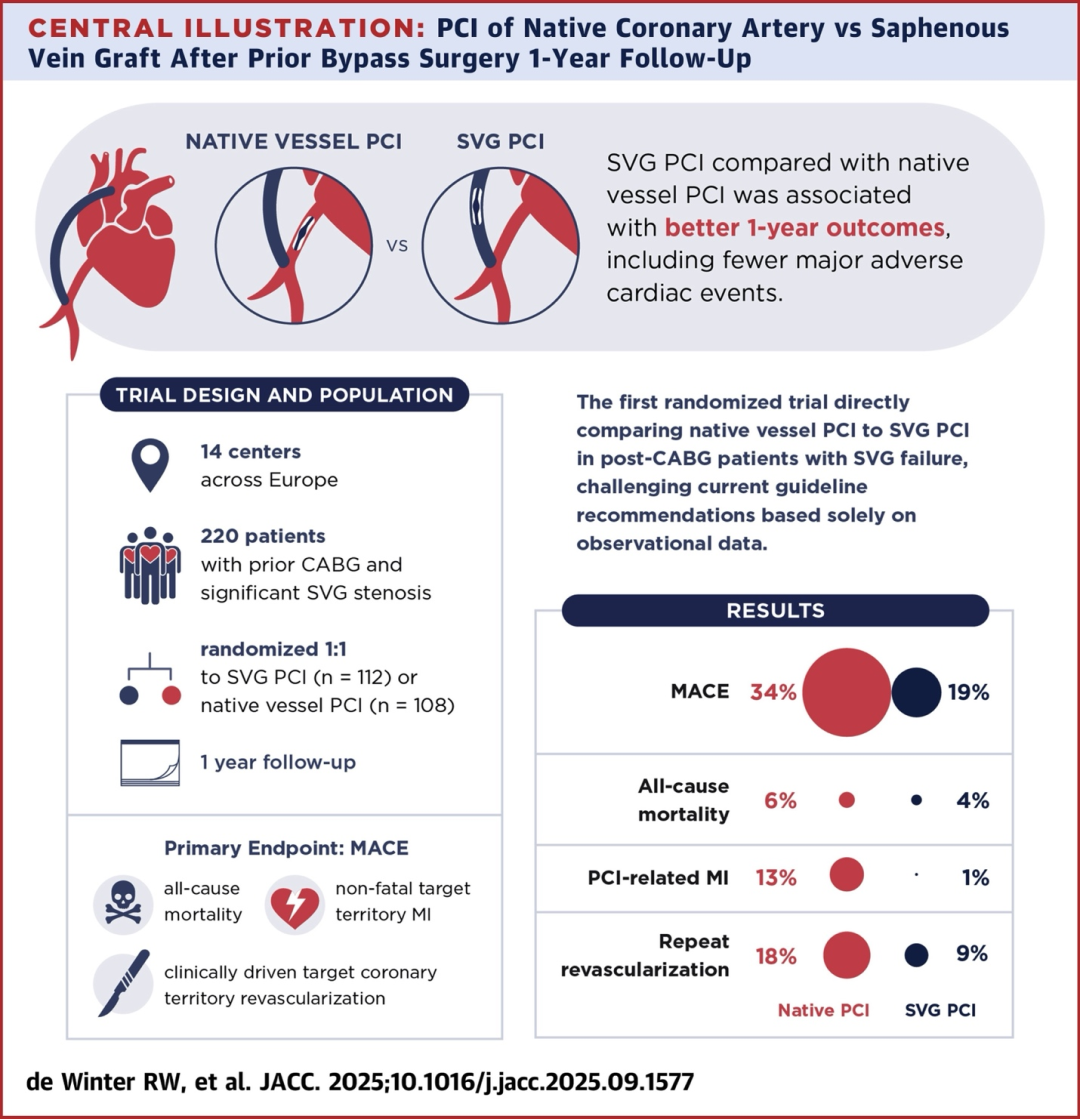
PROCTOR试验公布其1年结果:PCI开通桥血管(SVG组)在术后1年的临床结局优于PCI开通原生血管组。研究为全球首个聚焦CABG后桥血管失败PCI策略的随机对照试验,弥补了该领域长期以来的证据空白。

研究背景
冠状动脉旁路移植术(CABG)虽可改善缺血性心脏病患者的预后,但其远期疗效受限于桥血管退行性改变和原生冠脉疾病进展。据报道,术后5年约20%的患者再次出现心绞痛或缺血症状,10年后该比例上升至40–50%,15年可高达60%。大量CABG患者需接受再次冠脉造影及后续血运重建治疗。在此背景下,一个长期存在的临床抉择是:当静脉桥(SVG)发生狭窄或闭塞时,应当开通退变的桥血管,还是转而处理其所供血的原生冠脉病变?传统经验和指南多基于观察性研究,倾向于优先开通原生冠脉。例如2018年欧洲心肌血运重建指南针对CABG后桥血管失败情形给予IIa类推荐,认为如技术可行应首先考虑PCI开通原生血管,而非在退变的静脉桥上支架。美国指南亦持类似观点。这一策略假设基于对桥血管远期预后不佳及原生血管完全血运重建潜在获益的考虑。然而,此“经验法则”一直缺乏前瞻性随机试验证据支撑。
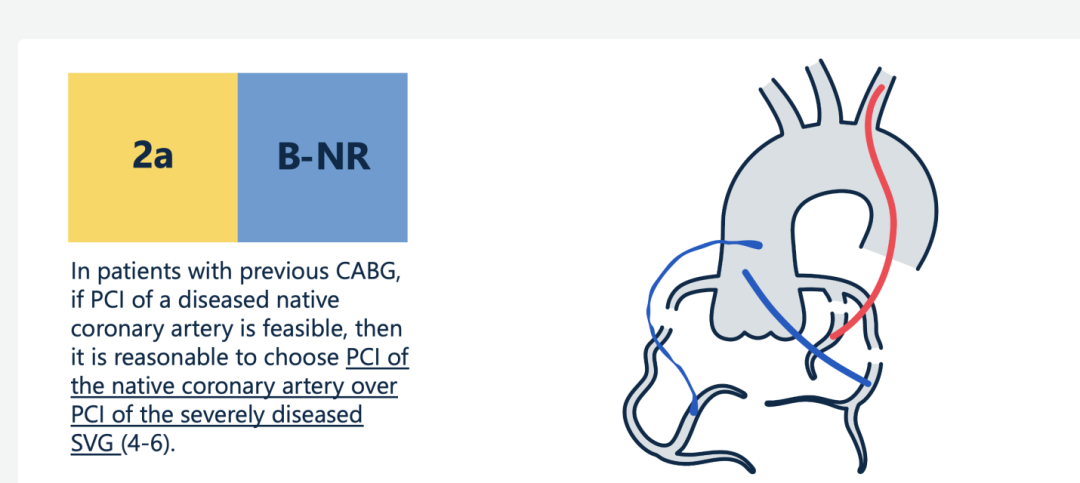
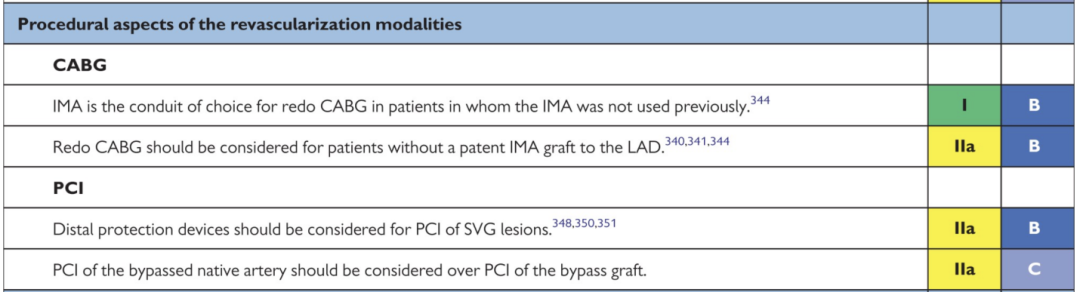
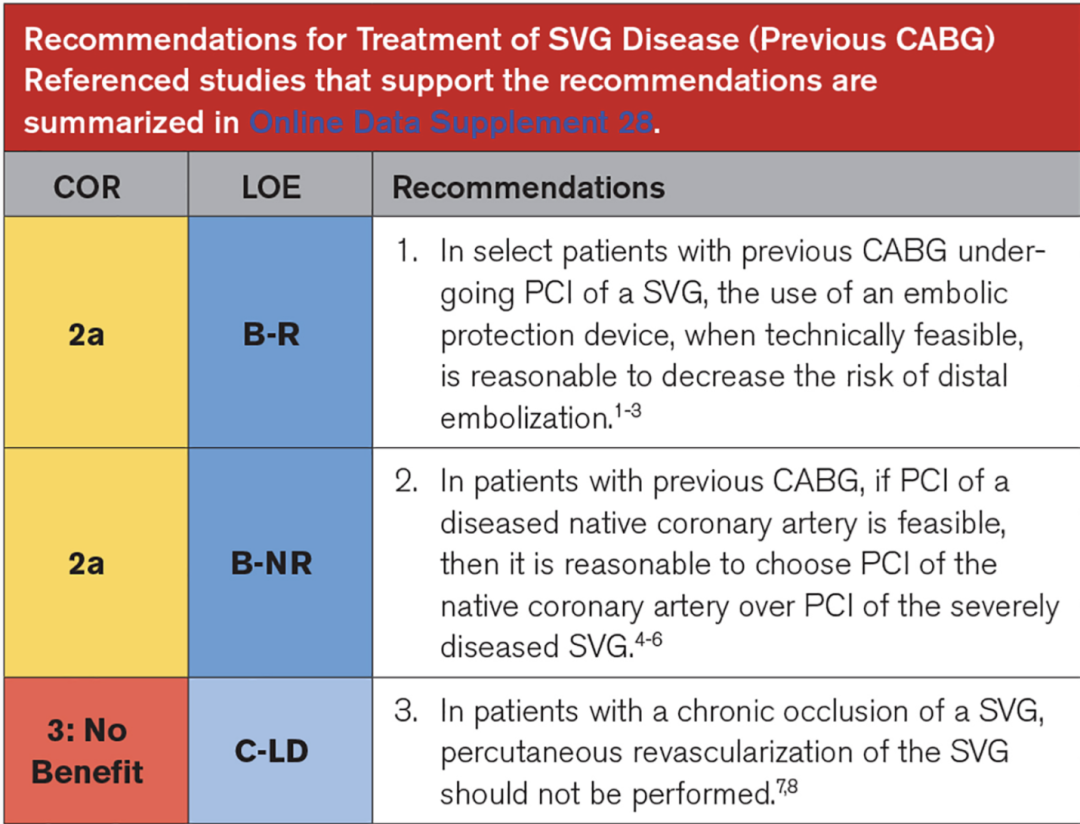
现行血运重建指南(AHA/ACC2021和ESC2018)对PCI处理原生冠脉给出2a类推荐
PROCTOR试验(PCI of Protected Coronary vs Total Occlusion Revascularization)正是在这一临床背景上展开,旨在成为首个比较“桥血管PCI vs 原生血管PCI”策略优劣的随机研究。研究者希望借此高水平证据,检验长期奉行的治疗准则是否站得住脚。
试验设计
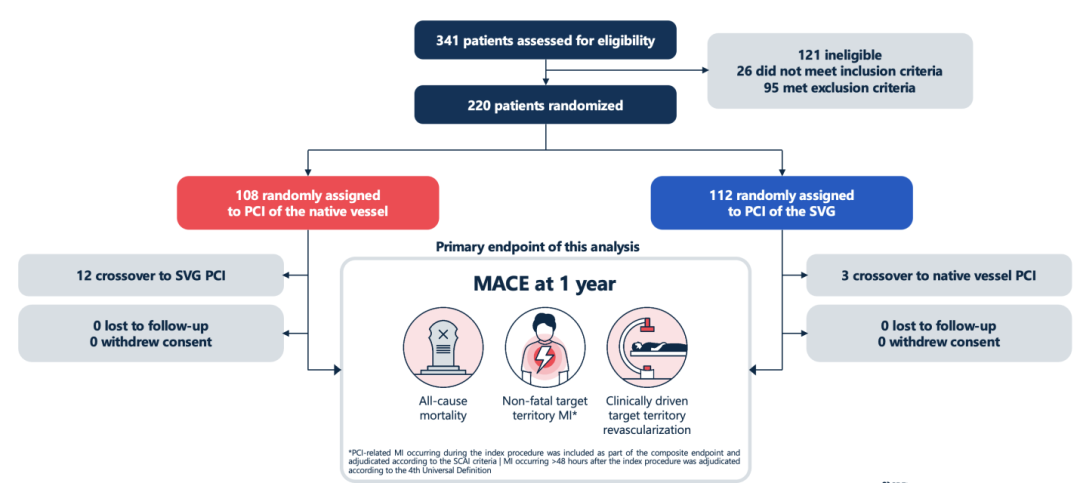
PROCTOR为研究者发起的多中心、开放标签、随机对照试验。欧洲14家心脏中心参与了该研究,入选对象为既往接受过CABG且当前出现大隐静脉桥血管(SVG)显著狭窄(直径狭窄>50%)、需进一步经皮血运重建的患者;入选前由心脏团队评估确认:针对每位患者,桥血管PCI和原生冠脉PCI两种策略在解剖上均具可行性;且患者临床确有PCI指征。
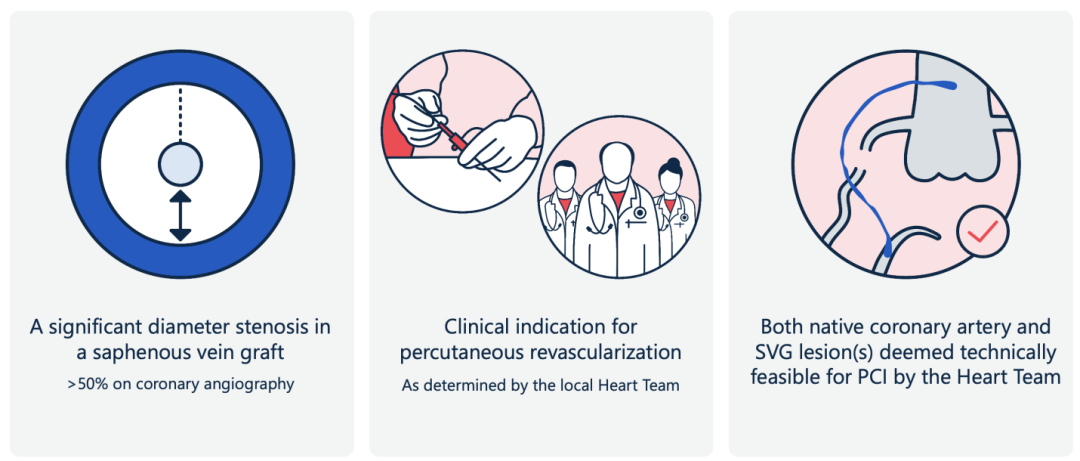
主要纳入标准:既往接受过CABG且当前出现大隐静脉桥血管(SVG)显著狭窄(直径狭窄>50%)、需进一步经皮血运重建的患者;入选前由心脏团队评估确认:针对每位患者,桥血管PCI和原生冠脉PCI两种策略在解剖上均具可行性;且患者临床确有PCI指征。
主要排除标准包括:CABG手术完成不足1年、因急性STEMI/NSTEMI并持续缺血状态而入院者、以及桥血管存在瘤样改变或大量附壁血栓等高危特点的情况。
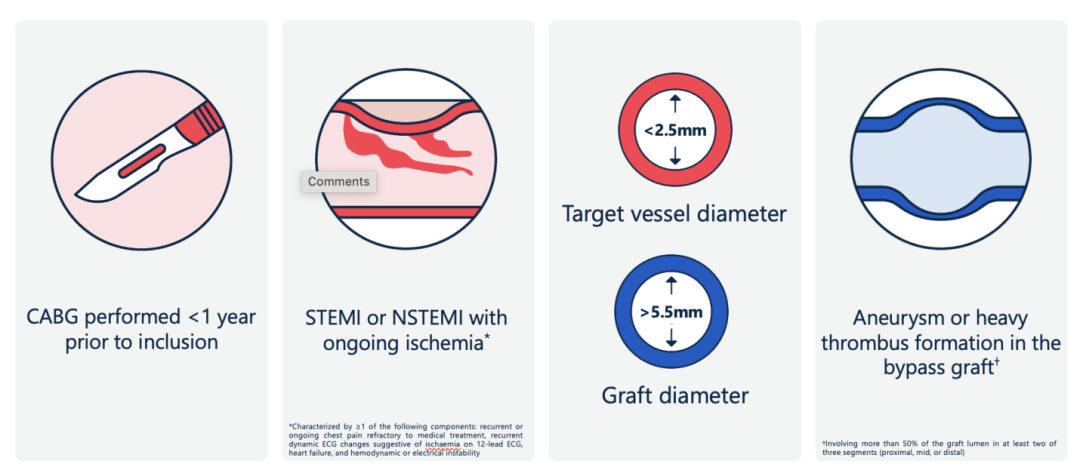
关键排除标准:CABG手术完成不足1年、因急性STEMI/NSTEMI并持续缺血状态而入院者、以及桥血管存在瘤样改变或大量附壁血栓等高危特点的情况,以及靶血管直径<2.5mm或桥血管直径>5.5mm等。
前10例连续病例原生血管病变和静脉桥病变造影图
这样的筛选标准使试验人群相对稳定,避免早期桥血管急性失功或高风险SVG病变干扰结果。患者被1:1随机分配接受SVG-PCI或原生冠脉PCI治疗。所有患者均使用第二代药物洗脱支架完成干预。
研究总体设计
试验计划随访1年以评价主要临床终点事件。该研究原计划入组约584例患者,但由于入组缓慢和资金因素,中途停止时共随机入组了220例。入组患者平均年龄73岁,从CABG手术到此次PCI的平均间隔长达18年。合并症负担较高:例如45%患有糖尿病,既往PCI和心肌梗死病史分别为61%和53%。原生血管PCI组中83%为慢性完全闭塞病变(CTO),反映大多数桥血管发生狭窄时,对应原生冠脉已完全闭塞且病变复杂。相对地,入选的SVG病变大多不属于高度复杂病变(排除了瘤样改变、巨大血栓负荷的SVG)。这种入选模式使两种策略的技术难度存在差异,正如试验名称所示,一组主要处理“顽固CTO原生血管”,另一组则处理“尚有血流的受保护血管(桥血管)”。
主要终点设定为靶血管区域的1年主要心血管不良事件(MACE)发生率,包括:全因死亡、目标冠脉区域的非致死性心肌梗死、以及该区域需临床驱动的重复血运重建。值得一提的是,围术期(48小时内)与PCI相关的心肌梗死也被纳入主要终点界定范围(按照SCAI标准认定)。试验同时记录次要终点,包括依方案/治疗分析、主要终点各组分、目标血管及靶病变失败率、肾功能不全发生率、以及患者症状/生活质量评分等。
主要发现

主要终点为靶血管区域的1年主要心血管不良事件(MACE)发生率
结果显示,PCI开通桥血管(SVG组)在术后1年的临床结局优于PCI开通原生血管组。两组主要复合终点MACE发生率分别为18.7% vs 34.3%,SVG-PCI组显著更低(风险比2.14,95%CI 1.25–3.65,P=0.004)。这一下降主要归因于原生血管PCI策略下围术期心肌梗死和后续重复血运重建事件的增加。
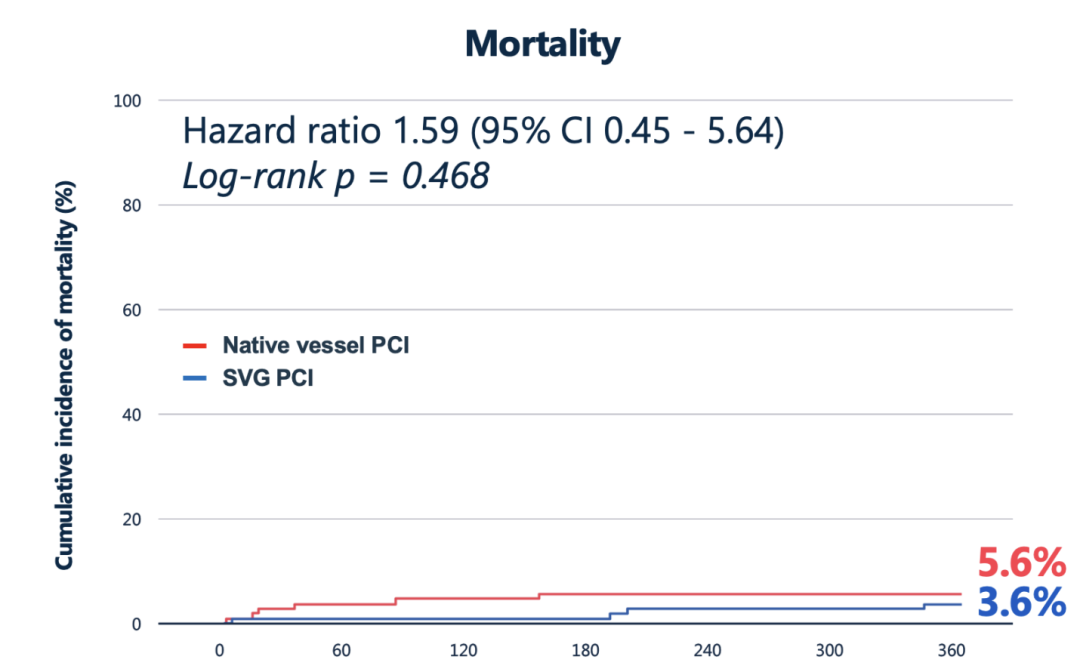
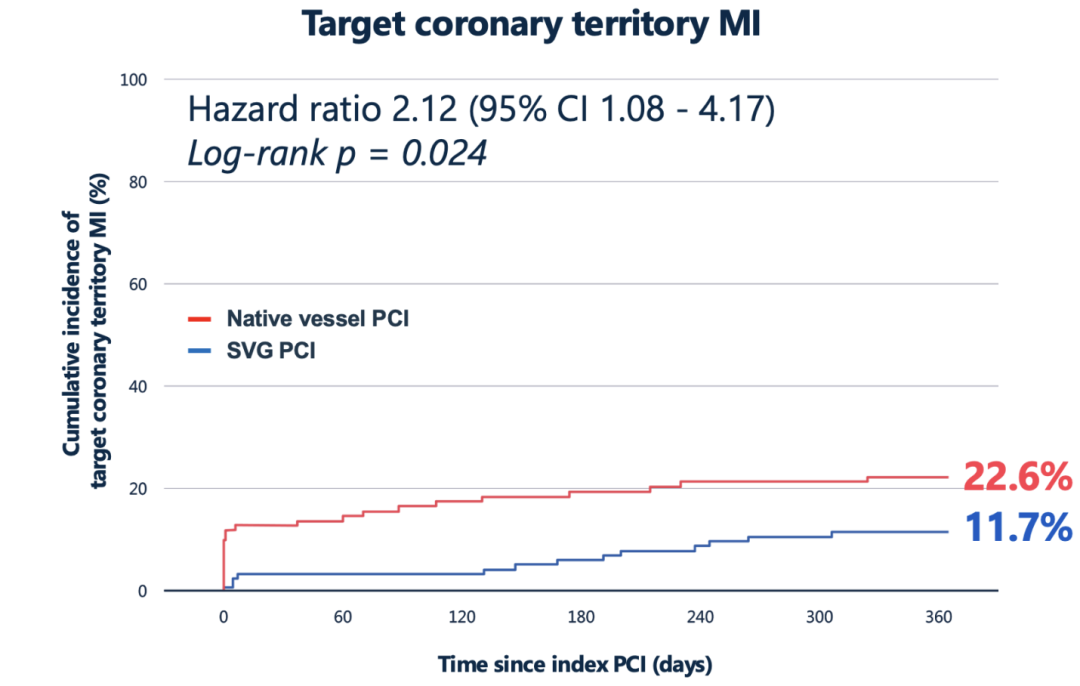
全因死亡率两组间无显著差异,目标区域心肌梗死差异显著(原生血管PCI更常见)
具体而言,尽管全因死亡率在两组间无显著差别(SVG组3.6% vs 原生组5.6%,P=0.468),但目标区域心肌梗死在原生血管PCI组明显更常见(22.6% vs 11.7%,HR 2.12,95%CI 1.08–4.17,P=0.024);其中多数为手术相关的4a型心梗,发生率高达13%(对比SVG组仅1%)。
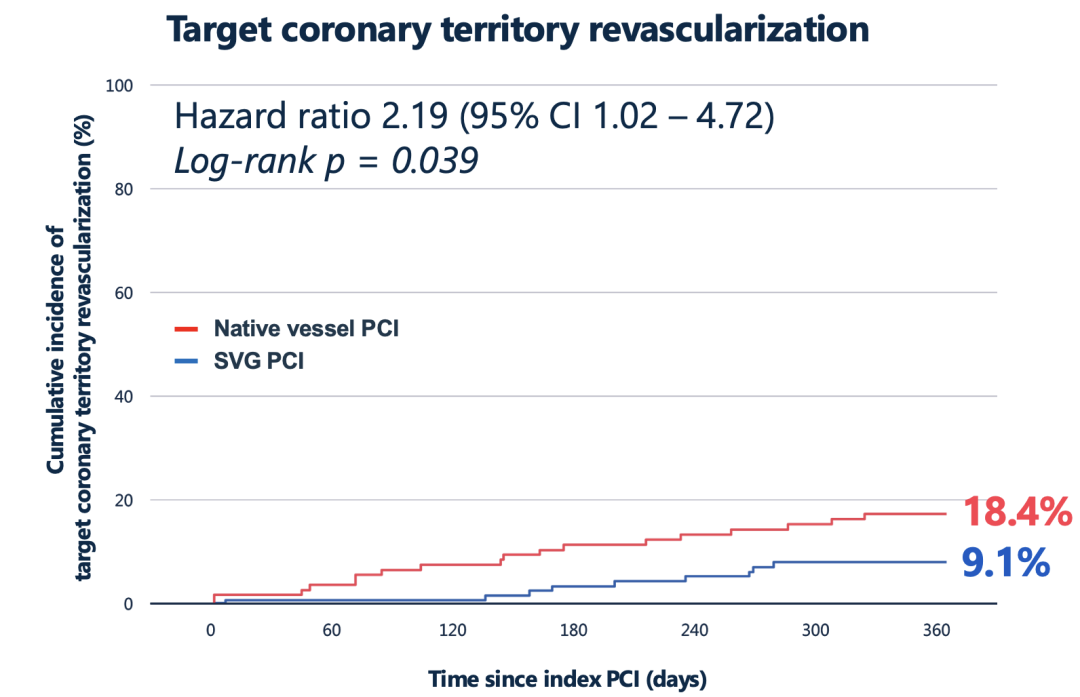
原生血管PCI组目标冠脉区域再次血运重建发生率更高
此外,目标区域再次血运重建发生率原生组亦高于SVG组(18.4% vs 9.1%,HR 2.19,95%CI 1.02–4.72,P=0.039)。由此可见,在随机随访一年内,选择治疗退变桥血管反而取得了更好的临床结局,这与既往基于回顾性研究所认为的“优选原生血管”理念相左。值得注意的是,两组围术期死亡绝对发生率都很低,主要差异来自非致死性不良事件。
除临床终点外,PROCTOR试验也比较了两种策略在手术过程中的困难度和资源耗用。结果显示,与SVG-PCI组相比,原生冠脉PCI组手术复杂性更高:首次开通失败需要改换策略的比例为18%,高于SVG组的10%。尽管通过补救或重复PCI,最终两组均有约92–93%的患者实现了血运重建的技术成功,但原生血管组付出了更大的手术代价。原生PCI组每例患者平均植入支架数2.7枚,显著多于SVG组的1.3枚;总支架长度中位数84 mm vs 23 mm;透视时间中位数55分钟 vs 11分钟;造影剂用量中位数220 mL vs 100 mL,以上差异均具统计学显著性。这些客观指标量化了CTO病变PCI在器械耗材、辐射暴露、造影剂使用等方面远高于常规SVG介入的负担。
两种策略围术期主要并发症发生率虽然在统计学上未见显著差异,但原生PCI的复杂操作本身增加了潜在风险暴露。例如,CTO导丝操作可能带来冠脉穿孔、大量造影剂提升肾损伤风险,而SVG介入则存在远端栓塞和无复流的隐忧。对此,研究者指出当原生闭塞病变过于复杂或操作者缺乏CTO介入经验时,直接处理桥血管可能更明智安全。同样,在SVG-PCI过程中应尽量使用远端栓塞防护装置,以减少术中微栓子脱落造成的无复流和心肌梗死风险——这一策略已被写入指南(I类推荐),但真实世界采用率有待提高。
TCT 2025现场直击
大会现场,荷兰阿姆斯特丹UMC的Ruben de Winter医生代表PROCTOR研究团队公布了上述结果。他强调PROCTOR是全球首个聚焦CABG后桥血管失败PCI策略的随机对照试验,弥补了该领域长期以来的证据空白。由于试验结果与既往观察性研究的认识相反,de Winter坦言“一定程度上令人感到惊讶”。他指出,此前经验普遍认为开通原生血管效果更好,而PROCTOR的发现挑战了这一传统观点。de Winter在演讲中详细阐述了试验入选人群的特殊性:研究严格筛选了适宜两种策略皆可行的病例,所处理的SVG病变相对简单,而原生血管组病变高度复杂,超过80%为CTO闭塞。一些高风险情形(如搭桥术后一年内即桥血管急性失功、急性心肌梗死患者、SVG内巨大血栓负荷等)被排除在试验之外。
因此,de Winter提醒临床医生在解读结果时要注意适用人群的局限:PROCTOR结论主要适用于那些桥血管病变并不极端复杂且原生血管病变复杂度高、两种途径技术上都能实施的患者。即便如此,这项研究依然在一年临床随访中对现行指南提出了有力挑战。de Winter团队已将研究论文同步发表在《美国心脏病学会杂志》(JACC)上。他还强调,长期随访结果仍至关重要——研究团队计划继续观察3年乃至更久,以确定SVG策略在中远期是否仍能保持优势,抑或随时间推移两组预后差异缩小甚至反转。
研究发表于最新一期JACC
学术反响
PROCTOR试验的意外发现引发了心血管病学界的热议。专家们普遍认为患者选择和病变复杂度是解读该研究的关键背景。诚如哥伦比亚大学医学中心的Ajay Kirtane医生所指出的,“这项随机研究在某种程度上是拿非常棘手的原生病变与相对容易的静脉桥病变进行比较“。另一位评论嘉宾、加拿大McMaster大学的Sanjit Jolly医生也形象地比喻道:“PROCTOR有点像把苹果和橘子作对比,因此结果需谨慎评估”。
尽管如此,多数专家认可该试验填补了研究空白,其结果“颠覆了我们长年的既定观念”。英国萨里心脏中心的Shrilla Banerjee医生在随后的专家讨论中表示,“PROCTOR数据令她感到惊讶,并预计两组MACE发生率曲线在3~5年随访时可能会出现交叉——因为既往经验表明SVG支架干预的长期持续获益有限”。但她也坦言,该研究“将促使我在今后的临床决策中重新审视自己的选择”。担任大会主讨论人的德州贝勒医学院Subhash Banerjee教授则高度评价了PROCTOR的意义,称其“非常重要,可能从根本上改变我们的治疗范式”。他同意试验入选的选择偏向(原生组病变更复杂)需考虑,但依然认为“这些数据将带来实践改变的影响”,并预期它们很可能会促使临床指南做出相应更新。会场内外,不少国际知名介入专家也公开肯定了PROCTOR研究的价值,呼吁同行摒弃以往那种“凡桥血管堵了就一定要开通原生血管”的教条式观念。
在学术讨论的热烈反馈下,指南制定者也可能会思考新证据的融入。国际专家预计各主要指南将在下一次更新时修改关于CABG后PCI策略的推荐。基于PROCTOR的随机证据,未来指南可能不再一味偏好原生血管PCI,而是更加强调根据个体病变情况选择方案。例如,当原生冠脉CTO病变极其复杂、高风险而SVG病变相对简单时,可考虑优先行SVG支架重建作为替代策略(可能赋予IIa类推荐);相应地,对原生血管PCI的推荐级别可能从“应考虑”下调为“可考虑”。鉴于PROCTOR目前仅有1年随访、样本量也有限,指南委员会在调整措辞时或将保持一定谨慎,暂不会简单将SVG-PCI提升为I类推荐,但预期会在指南文本中纳入PROCTOR结果并提示临床关注这一新发现。
临床启示
对于广大临床心血管医生而言,PROCTOR试验带来了重要的实践启迪。
首先,该研究提供了一级证据来重新审视CABG后再血运重建的策略选择。过去在缺乏RCT数据时,我们往往倾向于认为开通原生闭塞血管可获得更长远利益,而现在至少在短期内(1年左右),随机证据表明支架治疗退变的静脉桥反而取得了更佳的效果。因此,在遇到类似PROCTOR入选标准的患者时(既往搭桥多年后出现桥血管病变,同时原生血管CTO技术上可开通),心脏团队应更加开放地评估两种策略,而非教条式地仅考虑原生血管PCI。具体决策时,病变的复杂程度和医院/术者的技术能力是两个关键考量因素。
当原生冠脉CTO病变过于复杂、开通成功率低且风险高,而SVG病变相对局限、易于处理时,选择SVG-PCI往往能以更小的手术代价解决问题,并减少近期不良事件。尤其在缺乏CTO介入专业技术的中心,直接处理桥血管可能是更务实安全的选项。
反之,如果患者原生血管闭塞病变并非特别复杂,或者患者年轻、预期寿命较长,则需权衡SVG支架的远期通畅率问题,谨慎考虑长期获益。
需要强调的是,PROCTOR研究的结论并非意即所有CABG后桥血管病变都应改行SVG-PCI。临床医生应严格比照试验入排标准,将其结果应用于合适的场景。对于那些桥血管情况不佳(如完全闭塞或大量血栓、瘤样改变)而未纳入试验的患者,仍需根据具体情况决定最佳再血运重建途径。若决定采用原生血管PCI策略,应尽可能由经验丰富的CTO介入专家主刀,并在术前充分评估成功率和风险,必要时转诊至具备高级CTO介入能力的中心进行。而选择SVG-PCI策略时,同样有技术细节需要关注,例如尽量使用远端栓塞防护装置来降低微栓塞和无复流风险,这会提高桥血管PCI的安全性和成功率。

GuardWire远端栓塞防护装置示意图
可以预见,随着PROCTOR结果的公布,越来越多的心脏团队将在病例讨论中加入这一新证据的权衡。医生也应及时更新知识,在决策时向患者解释不同策略的利弊,以共同制定最符合患者利益的治疗方案。
展望未来,PROCTOR试验的后续长期随访及潜在的进一步研究将为我们提供更完整的证据图景。很多专家期待在3年、5年这样的时间节点再次比较两组患者的主要临床结局,观察SVG-PCI的早期优势能否持续,以及原生PCI是否会在中远期体现出潜在收益。在更多数据公布之前,临床实践应根据当前最佳证据谨慎行事。
总而言之,PROCTOR试验为CABG术后患者的再血运重建策略选择打开了新思路:医师需在“桥血管与原生血管”之间保持理性平衡,根据个体情况和自身技术专长制定最优方案。这一循证转变过程也体现了心血管领域实践不断演进的特点——唯有融合新证据与临床判断,方能不断优化患者的治疗结局。