

涂圣贤
上海交通大学
2025年欧洲心脏病学会(ESC)年会暨世界心脏病学大会于8月29日至9月1日在西班牙马德里拉开帷幕。
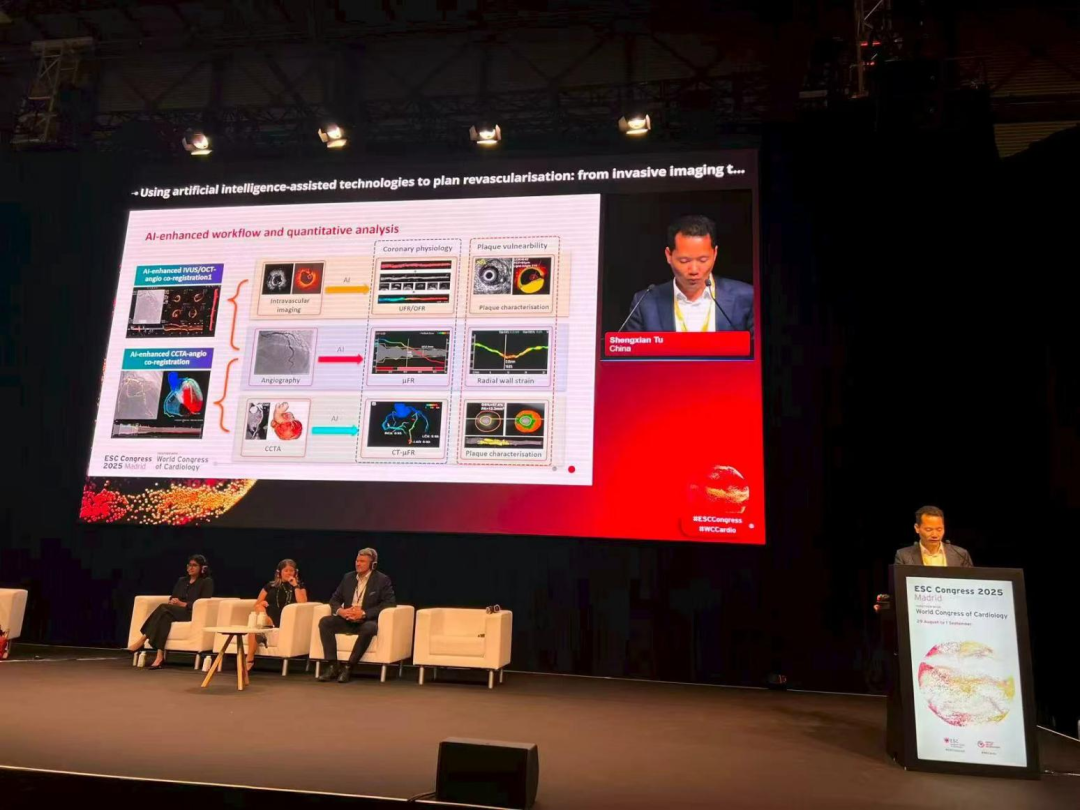
当地时间8月29日,上海交通大学涂圣贤教授受邀在大会进行“AI在冠脉血运重建策略及手术优化全流程应用中最新的研究进展与发展趋势”的报告,介绍了团队在应用AI工具,将冠脉CTA、冠脉造影、腔内影像等技术融合的成果,展现出当前我国科研团队在这一领域的创新实力。
会议期间,严道医声网特邀涂圣贤教授接受采访,介绍了团队近年来主要的研究方向和成果,以及当前生理学评估领域的进展,分享了对技术创新的心得体会。
严道医声网:请您介绍一下此次专题汇报的核心内容是什么?在指导血运重建决策方面,影像学技术有哪些新的进展?
涂圣贤教授:此次报告聚焦于AI在冠脉血运重建策略及手术优化全流程应用中最新的研究进展与发展趋势。近年来,AI在冠心病多模态影像评估工作流中发挥着越来越重要的作用,特别是在冠脉CTA与冠脉造影的融合,以及血管腔内影像与造影的融合方面,进展尤为突出。同时,AI在提取影像隐含的信息,并计算出临床相关的定量参数方面也发挥了关键作用。这些方面主要体现在影像技术的进展上,其中,由我们实验室研发的几项技术通过与上海博动医疗科技股份有限公司的合作转化,目前已在多个国家成功开展临床应用。以下是几个比较具有代表性的进展:
冠脉CTA与冠脉造影实时融合技术。这一技术在今年Euro PCR大会与OCC大会通过手术直播展示,通过AI实现了两者自动融合,将冠脉CTA提取出来的斑块直接与冠脉造影融合,为复杂病变和CTO患者的介入治疗策略制定提供了重要的参考。
单体位冠脉造影获得定量血流分数(µQFR或µFR)与血管径向壁应变(RWS)技术。我们于2022年提出此项技术,并荣获当年“Euro PCR最佳创新奖”。近几年,该技术在临床应用方面取得了一定进展,国内多个专家团队发表了多篇高质量论文,包括王建安院士团队在《Lancet》发表的FLAVOUR II、葛均波院士团队在《JACC: Cardiovascular Interventions》发表的心梗队列RWS研究,以及我们团队与阜外医院在《JACC》发表的FAVOR III China RWS研究等。
腔内影像多功能评估技术,2019年、2021年我们团队在《EuroIntervention》先后发表了“基于OCT的计算生理学技术(OFR)与虚拟组织学技术”的相关研究,可以从OCT影像中快速计算出FFR与自动获得斑块组织成分及斑块负荷,并由此衍生了新的易损斑块指标——脂质纤维帽比值(LCR)。这些技术的临床价值也在国内外的多个临床研究中得到验证,国内外企业也陆续推出类似的计算生理学与斑块识别技术,进一步拓宽了OCT的临床应用,并延展到IVUS。同时,我们团队利用FLAVOUR研究数据开展的核心实验室分析发现,基于AI可以从IVUS图像重建出三维支架,并量化支架的膨胀与计算支架术后的功能学参数UFR,这些参数能很好地预测支架植入后5年临床随访结局。
严道医声网:您和团队在国际上首创提出QFR等技术并推动其发展,回顾这段历程,您认为最值得骄傲的突破有哪些?
涂圣贤教授:我们团队于2016年首次提出QFR技术,众多国内外研发团队与临床研究者对技术的推动做出了贡献。回顾这段历程,我觉得最骄傲的有两个事情:第一个是我们提出基于单体位造影获得定量血流分数(μQFR)以及径向壁应变(RWS)的技术获得“2022年Euro PCR最佳创新奖”。这个奖项竞争非常激烈,由临床医生与投资人共同评选,每年只会选出一个项目,我们也有幸成为首个亚太地区获得该奖项的团队。
第二个则是在ESC 2024发布的《慢性冠脉综合征管理指南》中将QFR作为Ⅰ类推荐,用以指导患者治疗策略的制定。相对于IVUS和OCT经过了几十年的临床应用才在ESC 2024的同一个指南中获得I级推荐,QFR仅用了不到10年时间,这背后离不开众多研究者的努力与奉献。其中,由国内26家中心共同推动完成的FAVOR III China研究对本次指南的修订起到了关键的作用。这也是我觉得自豪的事情,用中国原创的技术,以及基于本土完成的研究改写了国际核心指南。我们还将在今年11月份的AHA大会公布FAVOR IV QVAS研究的结果,该研究历经了6年的时间,如果研究假设获得验证,或许未来能够改写心脏搭桥的临床指南。
严道医声网:您今年在《JACC: Asia》发表的文章中提到更先进的冠脉生理学评估技术——单一体位造影图像的μQFR,它与QFR相比有哪些区别?
涂圣贤教授:μQFR是我们在2020年独立自主研发的新一代QFR技术(海外部分区域叫做μFR)。相对于第一代QFR技术,它有几个特征:
1. 分叉定律被应用在QFR计算中以提升计算的准确度。μ的全称是Murray,代表Murray分叉定律,我们将分支血管自动检测出来并获得分支尺寸,基于Murray分叉定律来重建出更加精准的参考血管管腔以提升分叉病变评估的准确度。
2. 从单个造影体位就可以计算出QFR,大大提升了评估的便捷度,特别是在多支血管病变的评估、术中全流程介入手术指导中具有很大优势。例如我们在今年Euro PCR手术转播的病例,术中做了两次预扩张,需要评估每次扩张后血流动力学的改变,包括术前和术后总共需要进行4次μQFR分析;如果用两个体位计算会让操作繁琐,且增加患者造影剂的使用量。
3. 采用先进的AI技术自动计算血流速度以及勾画血管边界,大大提升QFR的智能程度,在造影质量良好的患者中可以实现全自动计算,整个QFR分析过程从原来每个血管大概需要5分钟的时间下降到每个患者1分钟甚至15秒就可以完成,这对QFR技术落地非常重要。
严道医声网:在推动AI辅助诊疗的发展中,您认为企业、医院、高校、监管机构各自应扮演怎样的角色?如何才能更好地构建一个协同创新的生态?
涂圣贤教授:高校有很好的人才资源,非常适合做一些前沿探索研究,包括一些核心技术的研发;企业是转化的主体,在技术落地的链条上承担了主要责任,需要链接各个环节,才能实现闭环;医院是临床问题与数据的来源,也是检验很多技术最终的场所;监管机构对于技术的准入非常重要。这几年,我们看到在多部门的呼吁与推动下,协同创新生态有了比较明显的改善,注册审批加速,创新产品的注册有了提前沟通的通道;高校和医院的政策更加有利于科研人员与临床医生的转化;企业则更需要创新的产品来增强其在市场的竞争力。
我认为这是一个好的发展趋势,协同创新生态就是各方做好自己擅长的事情,有良好的政策和机制来解决各类的责权问题,其发展就会比较顺利。当然,持续的创新非常需要创新的价值得到体现,否则创新的风险大、成本高,很难维持其持续性。AI辅助诊疗技术的服务收费问题一直是行业生态链条比较关键的一环,这方面还需要多方共同的努力,才能有利于AI在医疗的落地。