
随着全球人口老龄化及肿瘤诊疗技术的飞速发展,肿瘤患者的生存期显著延长,肿瘤本身及其治疗相关的心血管并发症日益凸显,成为影响患者预后的重要因素。其中,房颤作为最常见的持续性心律失常,在肿瘤患者群体中的发病率远高于普通人群,二者之间存在着复杂而紧密的关联。
一项前瞻性研究在对患者长达16.3年的随访中发现,有肿瘤病史的患者房颤发生率高达19%,而无肿瘤病史的对照组仅为9%,证实肿瘤是房颤发生的独立危险因素。
这种关联不仅体现在肿瘤患者更高的房颤患病率上,更有研究提示,新发的房颤有时可能是潜在恶性肿瘤的标志,尤其是在老年人群中,这种双向关系为临床诊疗带来了新的挑战。
中国心房颤动管理指南(2025)专门对肿瘤合并房颤的管理进行了论述,本文结合相关文献,将指南中关于肿瘤合并房颤的管理建议,从循证证据到临床实践,给予深度解读,以更好的指导临床。
2025版中国房颤指南核心要点
1.流行病学与风险
所有恶性肿瘤均增加房颤风险,患病率2%~28%;新发房颤可能反映了更晚期的肿瘤分期,预后差。
肿瘤合并房颤使全身血栓栓塞、脑卒中风险增加2倍,心衰风险增加6倍;癌症患者抗凝出血风险增加2倍。

2.发病机制
与心房基质改变、隐匿性癌症、手术或化疗或放疗相关;风险取决于癌症类型、分期及基础心血管疾病。

3.管理原则
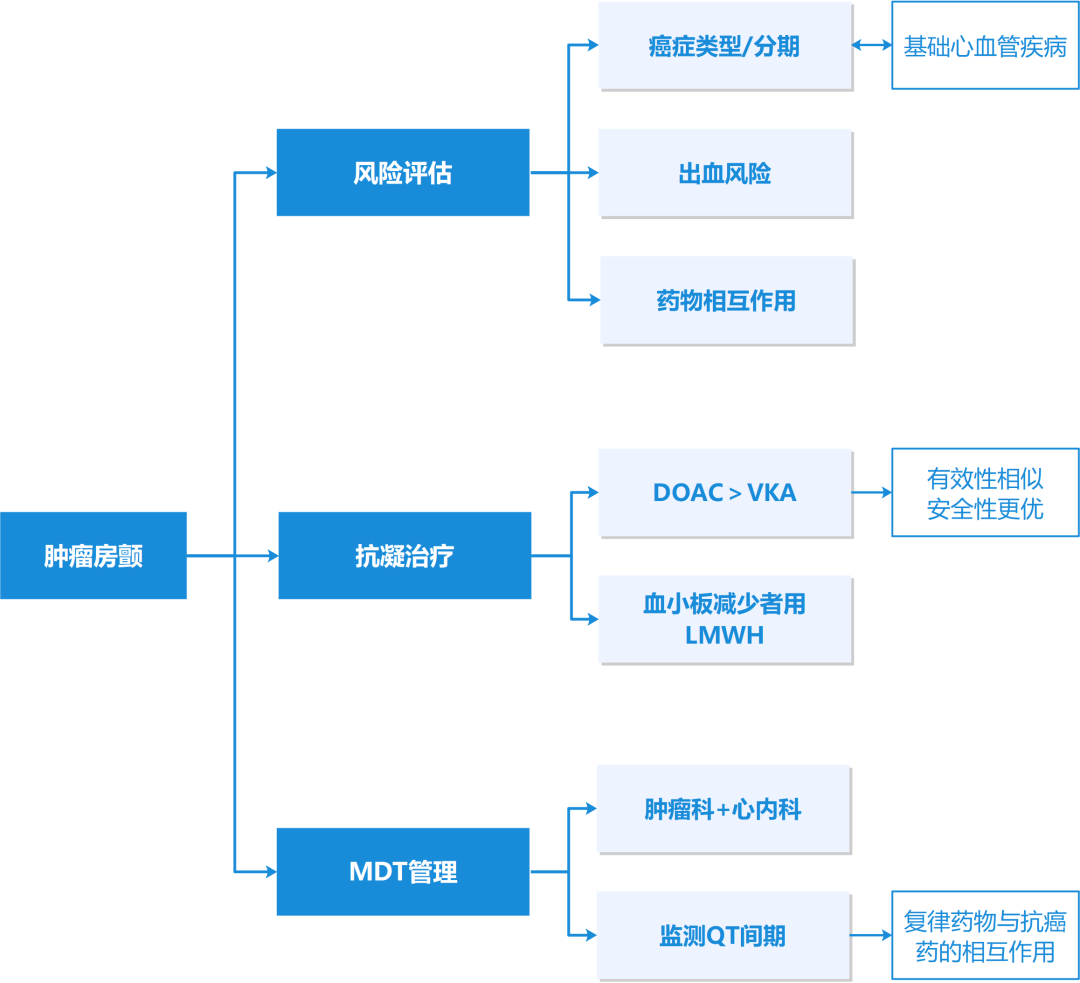
风险分层:该人群的风险分层很复杂,需动态评估癌症类型、分期、预后、出血风险及其他危险因素(短期内容易变化)。
抗凝治疗:DOAC与VKA有效性相似,但安全性更优;近期活动性出血或血小板减少者,短期可选用低分子肝素。
节律控制:需MDT(心脏科、肿瘤科等)决策,注意复律药物与抗癌药的相互作用(尤其QT间期延长效应)。

我们从2025版中国房颤指南中学习到哪些经验?
1.肿瘤患者房颤的血栓风险评分可能低估实际风险,需个体化调整抗凝强度。
传统风险评分工具综合考虑了充血性心力衰竭、高血压、年龄、糖尿病、卒中/短暂性脑缺血发作(TIA)/血栓栓塞史、血管疾病、年龄和性别等多个风险因素。然而,在肿瘤合并房颤的患者中,血栓风险评分的应用存在明显的局限性。首先,该评分系统并未包含任何与肿瘤相关的特异性风险因素,如肿瘤类型、分期、活动性、以及正在接受的治疗等,而这些因素均已被证实与血栓风险增加密切相关。其次,肿瘤本身即可通过多种机制(如高凝状态、炎症)显著增加血栓风险,这种由肿瘤本身带来的额外风险无法被血栓风险评分所量化。因此,单纯依赖血栓风险评分可能会低估肿瘤患者的实际血栓风险,导致部分高危患者未能接受及时的抗凝治疗。临床实践中,对于活动性肿瘤患者,即使其血栓风险评分较低,也应谨慎评估其抗凝的必要性。
2.DOAC在肿瘤患者中耐受性更好,尤其适用于无严重肾功能不全者。
与华法林相比,DOAC(包括达比加群、利伐沙班、阿哌沙班和艾多沙班)在预防卒中或系统性栓塞方面具有相似甚至更优的疗效,同时在降低大出血风险,特别是颅内出血风险方面,显示出明显的优势。对于肿瘤患者而言,DOAC的另一个重要优势是其固定的给药剂量和无需常规监测凝血指标(如INR),这极大地简化了管理,提高了患者的依从性,尤其是在需要频繁往返医院接受化疗等治疗的肿瘤患者中。
3.化疗期间需常规监测心电图(QT间期),避免抗心律失常药物与抗癌药协同延长QT间期。
氟尿嘧啶类药物可引起心肌缺血进而引发室性心律失常。新型抗肿瘤治疗,如酪氨酸激酶抑制剂,可以延长QT间期引起室性心律失常。抗肿瘤药物相关性心律失常的高危患者为先天性长QT综合征,既往尖端扭转型室速病史,或基线QTc>450ms。接受抗肿瘤治疗同时应用支持性药物(如止吐药,抗抑郁药等)可导致QT间期延长,因此,对该类患者进行临床治疗时应考虑药物相互作用及协同作用。
在临床实践中,处理肿瘤合并房颤时,可能的误区有什么?
1.仅依赖传统血栓评分(如CHA₂DS₂-VA)评估肿瘤患者风险,易忽视癌症本身的高凝状态。
2.未关注药物相互作用(如胺碘酮与某些化疗药联用),导致QT间期过度延长引发恶性心律失常。