

即使在药物洗脱支架(drug‐eluting stent,DES)时代,支架内再狭窄(in‐stent restenosis,ISR)的发生率仍较高。第二代支架在预防ISR方面并未显示出优势。与de novo(原位)病变的经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)相比,ISR的PCI与更高的主要不良心脑血管事件(major adverse cardiovascular and cerebrovascular events,MACCE)发生率相关。因其远期结局更差,而DES-ISR的治疗较裸金属支架(bare‐metal stent,BMS)-ISR更具挑战性。
近年来,支架内新生动脉粥样硬化(neoatherosclerosis,NA)在晚期支架失败中的作用日益受到关注。已有研究证实,支架内NA是临床驱动的靶病变血运重建(target lesion revascularization,TLR)的独立预测因素。支架内NA不仅与晚期支架血栓形成相关,也是晚期支架再狭窄的常见机制。与BMS植入相比,DES植入后NA发生更早、更频繁,对于植入超过3年的第一代DES,其发生率达65%。新一代与第一代DES的NA发生率相近。普遍认为,洗脱药物的抗增殖作用导致新生内皮化不完全,进而引起循环脂质过度摄取,加速动脉粥样硬化斑块的形成。

近日,《Health Science Reports》发表了首都医科大学北京安贞医院的研究成果: 《Effect of Neoatherosclerosis and Intervention‐Associated Neoatheroma Rupture on Clinical Outcomes in Patients With In‐Stent Restenosis: A Retrospective Study》,该研究纳入有症状的ISR患者且经光学相干断层扫描(optical coherence tomography,OCT)证实存在支架内NA,旨在探讨支架内NA的形态特征如何影响DES-ISR的临床结局。

方法
研究人群
本研究为单中心回顾性观察性研究。2015年7月至2019年12月,连续纳入56例符合以下标准的DES-ISR患者:表现为心脏缺血相关症状,诊断为稳定型或不稳定型心绞痛或非ST段抬高型心肌梗死(non‐ST‐segment elevation myocardial infarction,NSTEMI);PCI术前及球囊扩张后通过频域OCT(FD-OCT)评估ISR病变,证实存在含脂质核心的支架内NA(伴或不伴支架内钙化);靶病变最终采用DCB血管成形术或再次DES支架植入治疗。
靶病变采用切割球囊/刻痕球囊(球囊与支架直径比为0.9~1:1)及与原先支架尺寸相同的非顺应性球囊进行预处理。DCB或再次支架植入的选择由术者根据冠心病DCB应用指南推荐决定。
根据球囊扩张后是否存在OCT定义的介入相关NA内膜破裂,将患者分为两组。
OCT图像采集
采用频域OCT系统(St.Jude Medical)进行OCT检查。导管回撤速度为20mm/s。图像采集过程中,通过指引导管持续注入造影剂,连续图像被采集并数字化存储以备后续分析。
OCT图像分析
采用Light Lab OCT系统软件进行OCT分析。沿整个支架段对每帧图像进行定性评估。每1mm进行定量测量。
NA内膜横截面积(cross‐sectional area,CSA)定义为支架CSA减去管腔CSA,NA内膜CSA狭窄百分比定义为(NA内膜CSA/支架CSA)×100。
脂质核心定义为NA内膜内存在信号减弱、高衰减且边界模糊的区域;
支架内钙化定义为边界清晰、信号减弱且边缘锐利的区域。对于每个NA斑块,在每0.2mm切面处测量斑块长度、纤维帽厚度及脂质池弧度。
内膜破裂定义为血管腔表面的连续性中断。严重破裂定义为纤维帽完全断裂,伴内膜瓣撕裂及斑块核心组织广泛暴露(图1a)。轻度破裂定义为未累及整个纤维帽层的中断,或纤维帽断裂但仅有少量斑块核心暴露(图1b)。
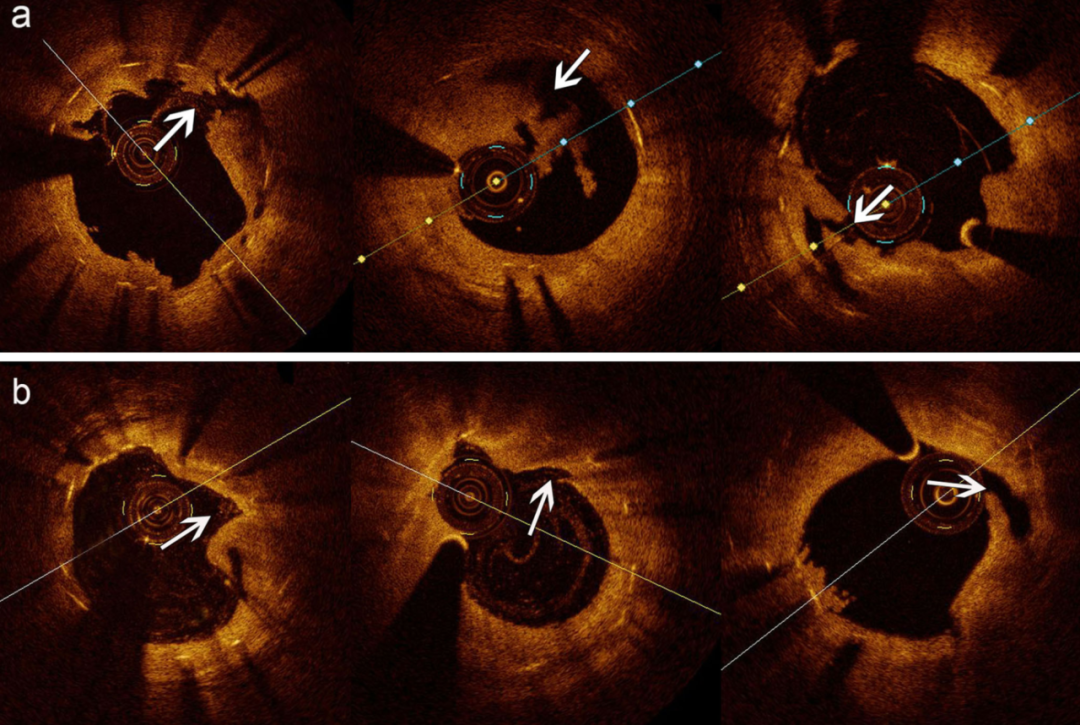
图1.(a)严重新生动脉粥样硬化内膜破裂(severe neoatheroma intima rupture,SNIR)。箭头所示为完全破裂的纤维帽及广泛暴露的斑块核心组织。(b)球囊扩张后无明显内膜破裂的NA斑块。箭头所示为纤维帽轻微断裂,脂质核心未暴露。
随访
所有患者PCI术后均接受双重抗血小板治疗(即阿司匹林联合氯吡格雷或替格瑞洛)后出院,随后通过临床随访或电话联系进行至少3年的随访。主要不良心脏事件定义为发生心源性死亡、心肌梗死(MI)或TLR(TLR定义为对先前支架段或支架近端/远端5mm范围内的病变再次行PCI或冠状动脉旁路移植术)。
结果
临床及病变特征
共分析56例有症状的ISR患者,均经OCT证实存在支架内NA。患者基线及病变特征见表1和表2。
表1.患者的临床特征。
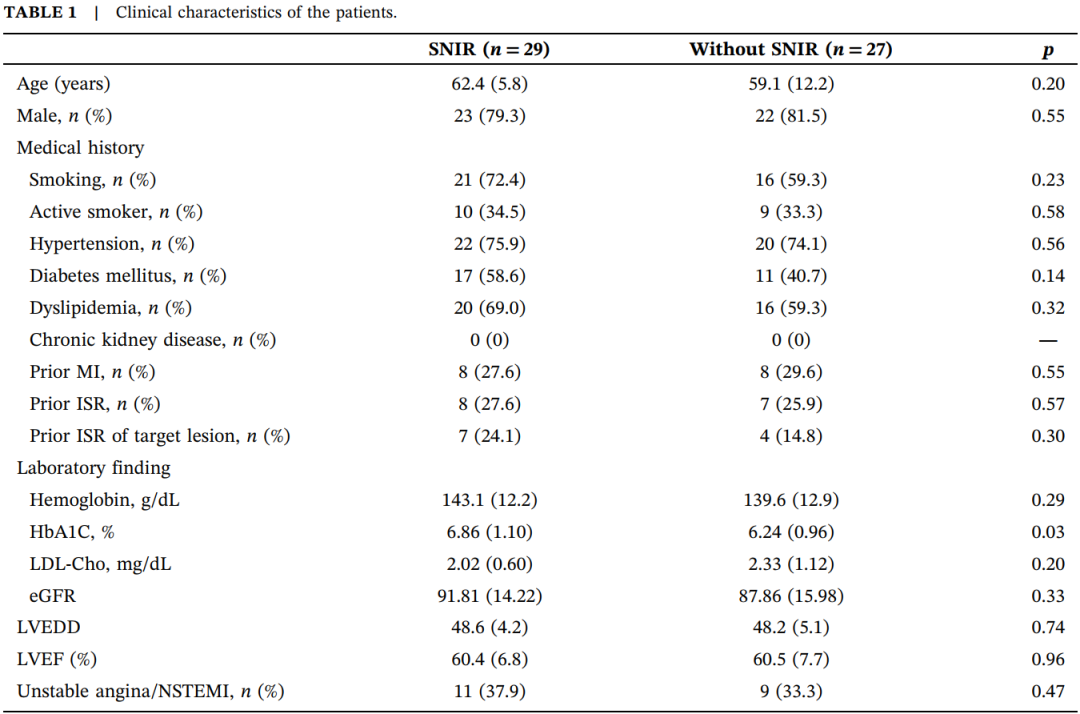
缩写:HbA1C,糖化血红蛋白;ISR,支架内再狭窄;LDL-Cho,低密度脂蛋白胆固醇;LVEDD,左心室舒张末期内径;LVEF,左心室射血分数;MI,心肌梗死;NSTEMI,非ST段抬高型心肌梗死。
表2.病变特征。
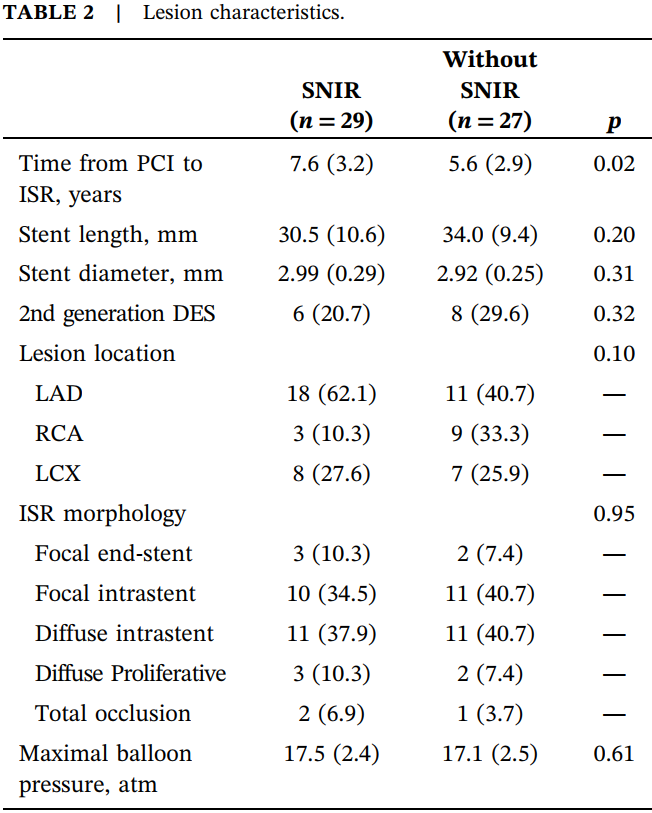
缩写:atm,大气压;DES,药物洗脱支架;ISR,支架内再狭窄;LAD,左前降支;LCX,左回旋支;PCI,经皮冠状动脉介入治疗;RCA,右冠状动脉。
29例患者在球囊扩张后出现SNIR。SNIR组糖尿病患者比例更高(58.6% vs. 40.7%),但差异无统计学意义。反映血糖控制情况的糖化血红蛋白(HbA1C)在SNIR组显著更高(6.86±1.10 vs. 6.24±0.96,p=0.030)。SNIR组PCI至ISR的时间显著更长(7.6±3.2 vs. 5.6±2.9年,p=0.016)。两组在病变位置、支架类型、支架长度及直径方面无显著差异。局灶性再狭窄是主要的ISR形态,两组ISR形态类型无显著差异。
OCT检查结果
OCT分析结果见表3。两组在支架面积、最大NA内膜厚度、近端或远端参考面积方面无显著差异。
SNIR组NA内膜面积有更大趋势(3.77±0.99 vs. 3.44±0.68,p=0.156),伴NA的最小管腔面积(MLA)有更小趋势(2.49±0.82 vs. 2.85±0.87,p=0.119),但差异均无统计学意义。
SNIR组脂质NA内膜比例显著更高(28.2±14.3 vs. 16.0±9.5%,p=0.001)。SNIR组NA斑块的纤维帽相对更薄(114.4±73.5 vs. 149.2±61.8,p=0.061),且脂质核心更大(图2a,b),最大脂质弧度和脂质池厚度分别为155.5±41.6 vs. 107.7±44.4度(p<0.001)和510.1±162.7 vs. 370.7±129.6µm(p=0.001)。
表3.光学相干断层扫描分析。
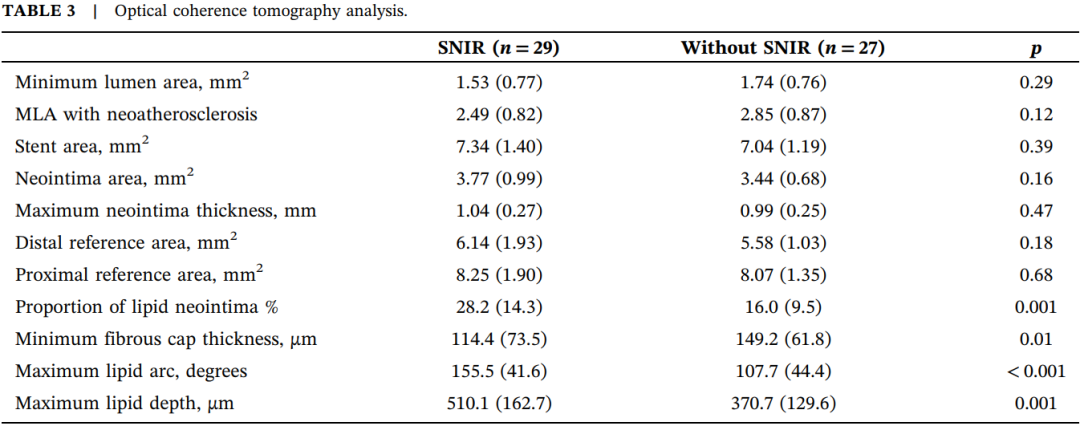
缩写:MLA,最小管腔面积。
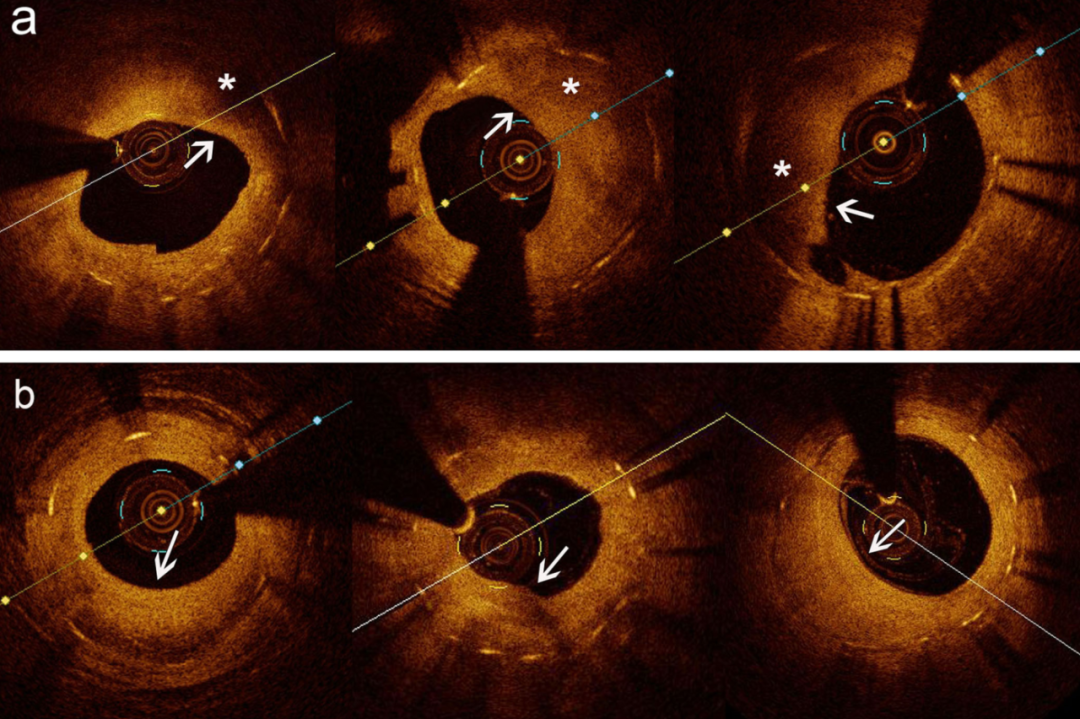
图2.(a)纤维帽薄且脂质核心大的NA斑块。箭头所示为较薄的纤维帽;星号标记为脂质核心。(b)纤维帽厚且脂质核心小的NA斑块。
临床结局
表4显示了PCI术后的即时结果及至少3年随访的临床结局。所有患者均达到TIMI III级血流。SNIR组再次支架植入的比例为48.3%,显著高于无SNIR组(7.4%),且急性管腔获得有更大趋势(3.69±2.07 vs. 3.04±1.04,p=0.149),这可能归因于再次支架植入能更有效预防血管弹性回缩。
SNIR组TLR发生率显著更高(37.9% vs. 11.1%,p=0.021)。Kaplan-Meier分析(图3)显示,SNIR组无事件生存时间显著短于无SNIR组(28.6个月,95% CI [24.2~32.9]个月 vs. 34.3个月,95% CI [31.5~37.1]个月,p=0.016)。Cox比例风险模型多因素分析(表5)显示,SNIR是TLR的独立预测因素(HR3.997,95% CI [1.109~14.400],p=0.034)。
表4.PCI术后即时结果及3年随访结局。
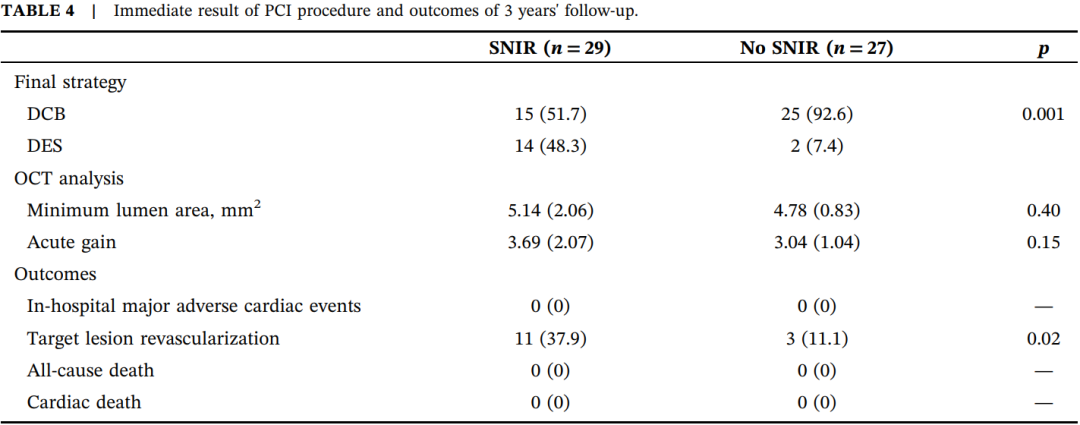
缩写:DCB,药物涂层球囊;DES,药物洗脱支架;MLD,最小管腔直径;OCT,光学相干断层扫描;TIMI,心肌梗死溶栓试验。
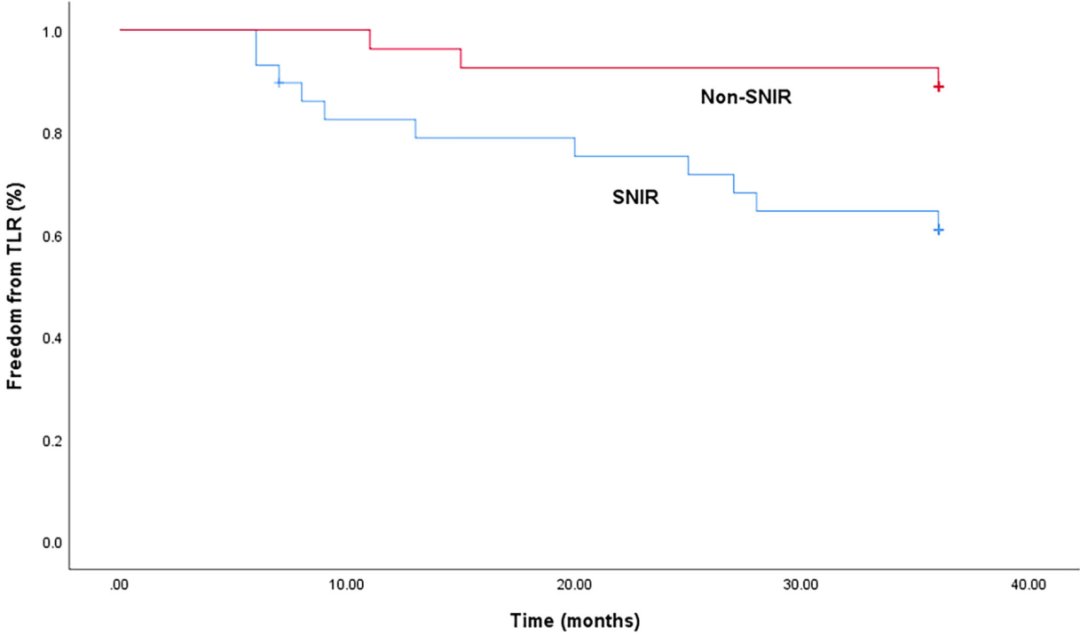
图3.靶病变血运重建(TLR)的Kaplan-Meier曲线。SNIR组无事件生存时间显著短于无SNIR组(28.6个月,95% CI [24.2~32.9]个月 vs. 34.3个月,95% CI [31.5~37.1]个月,p=0.016)。
表5.SNIR是TLR的独立预测因素。
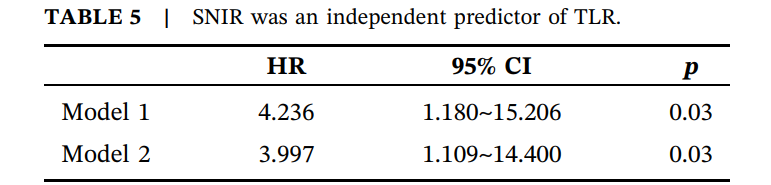
注:模型1:未调整。模型2:调整了吸烟、糖尿病、低密度脂蛋白胆固醇、高血压、既往ISR、PCI至ISR的时间、最终治疗策略。
值得注意的是,在SNIR患者中,观察到与DCB血管成形术相比,再次支架植入显著降低TLR发生率(14.3% vs. 60.0%,p=0.014),提示当存在严重介入相关NA内膜破裂时,再次支架植入比DCB更有效。
介入相关NA破裂的预测因素
如表6所示,多因素logistic回归分析显示,反映糖尿病控制情况的HbA1C(OR=1.868,95% CI 1.016~3.438,p=0.044)和PCI至ISR的时间(OR=1.278,95% CI 1.030~1.584,p=0.026)是SNIR的独立预测因素。
表6.临床因素与介入相关SNIR的关系。
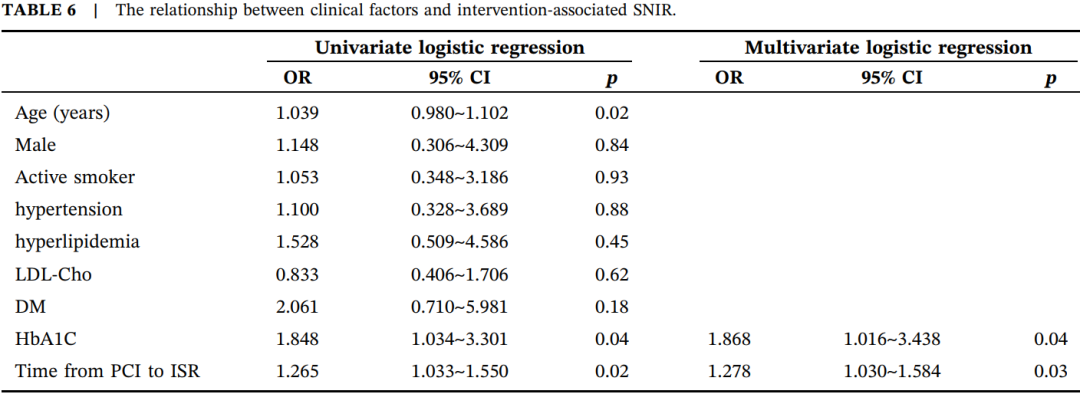
缩写:PCI,经皮冠状动脉介入治疗;DM,糖尿病;HbA1C,糖化血红蛋白;ISR,支架内再狭窄;LDL-Cho,低密度脂蛋白胆固醇。
讨论
本研究通过OCT发现,在存在支架内NA的患者中,球囊扩张后SNIR的发生率较高(46.2%)。这些患者的NA通常具有更大的脂质核心和更薄的纤维帽。SNIR患者的TLR发生率显著高于无SNIR患者(37.9% vs. 11.1%,p=0.021)。基于这些结果,合理推测支架内NA及介入相关NA斑块破裂在复发性ISR和再次TLR中起重要作用。
既往研究报道了了支架内NA的高发生率,且支架内NA是晚期再狭窄的常见机制。当靶病变段存在NA斑块时,球囊扩张可能导致NA内膜破裂。在de novo(原位)病变中,介入相关严重内膜破裂可能导致血管壁夹层,甚至阻塞血流;然而,在ISR患者中,由于支架的支撑作用,破裂局限于内膜,因此易被忽视。在原位冠状动脉粥样硬化中,愈合的斑块破裂会导致管腔狭窄快速进展;类似地,当支架内NA斑块破裂未表现为急性冠状动脉综合征或猝死时,其会伴随血栓形成、炎症反应、蛋白聚糖及胶原基质沉积而愈合,进而导致ISR的发生。根据本研究结果,我们认为介入相关NA斑块破裂后可能发生相同的现象,若破裂未被支架梁覆盖,可能形成血栓,并伴随炎症、蛋白聚糖及胶原沉积而愈合,导致支架再狭窄复发。
最新临床试验报道,在3年随访中,对于ISR的治疗,再次植入第二代DES较DCB血管成形术显著降低TLR需求。该研究未纳入腔内影像学数据,也未探讨新一代DES结局更优的原因。本研究发现,在SNIR患者中,再次支架植入较DCB血管成形术显著降低TLR发生率(14.3% vs. 60.0%,p=0.014),提示当存在介入相关严重新生动脉粥样硬化内膜破裂时,再次支架植入更有效。
我们推测,新一代DES可能通过有效封闭内膜破裂、避免血栓形成及过度内膜增生而降低TLR风险。需要大规模临床试验和研究来明确NA及介入相关斑块破裂在复发性ISR中的作用。尽管如此,对于ISR且介入相关斑块破裂风险高的患者,应采用腔内影像辅助术者制定PCI策略,并确保内膜破裂的封闭。
NA斑块的形态特征与介入相关SNIR密切相关。本研究显示,SNIR患者的NA脂质核心更大、纤维帽相对更薄,且脂质NA的比例更高。多因素logistic回归分析显示,糖尿病控制不佳(OR=1.868)和PCI至ISR的时间(OR=1.278)是SNIR的独立预测因素。
2型糖尿病(T2DM)患者心血管疾病高发,至少部分归因于糖尿病性血脂异常的促动脉粥样硬化环境。血糖控制不佳常伴随脂蛋白谱紊乱。持续性高甘油三酯血症促进低密度脂蛋白(LDL)氧化,同时高血糖导致LDL糖基化,均增加LDL颗粒的致动脉粥样硬化性。与非糖尿病相比,糖尿病斑块中III型胶原沉积增加,且与炎症、新生血管形成及斑块内出血相关,这可能是斑块进展的促成因素。血糖控制不佳的糖尿病患者的原位非罪犯斑块具有更大的脂质弧度、更长的脂质长度及更高的脂质指数。糖尿病已被确定为ISR的独立预测因素。对于支架内NA内膜,血糖控制不佳可能同样促进形成具有大脂质核心和薄纤维帽的NA,其在血管成形术过程中易发生破裂。
PCI至ISR的时间已被证实是NA的危险因素。本研究发现其也是SNIR的独立危险因素,这可能反映了NA随时间的进展。
结论
介入相关严重NA破裂会增加TLR复发风险,对此类患者再次支架植入较DCB更有效。具有显著脂质池的NA与介入相关SNIR密切相关。糖尿病控制不佳和PCI至ISR的时间是SNIR的独立预测因素。这需要大规模临床试验进一步证实。