
多瓣膜疾病(multivalvular disease,MVD)管理已成为当代心血管医学领域最为复杂的挑战之一。目前,主流学会指南对多瓣膜疾病的治疗提供的指导有限,尤其是在干预治疗的最佳时机(optimal timing)、治疗顺序(sequencing)以及患者选择(patient selection)方面缺乏明确建议。心脏瓣膜合作组织(Heart Valve Collaboratory,HVC)于2024年11月举办了多瓣膜病专题研讨会(workshop),会议聚焦于特定瓣膜组合(第一天针对主动脉瓣和二尖瓣疾病;第二天关注三尖瓣和左心瓣膜疾病)以应对这些挑战。本篇通讯总结该研讨会上针对同时存在主动脉瓣狭窄(aortic stenosis,AS)和二尖瓣反流(mitral regurgitation,MR)的重要见解,强调当前知识、临床挑战以及未来的研究计划。图1直观展示了本文涉及的疾病负担、管理决策、研究议程和关键知识空白(图1)。

图1. 主动脉瓣狭窄合并二尖瓣反流的管理
AFib = 心房颤动(atrial fibrillation);AI = 人工智能(artificial intelligence);AS = 主动脉瓣狭窄;AVR = 主动脉瓣置换术(aortic valve replacement);CT = 计算机断层扫描(computed tomography);HF = 心力衰竭(heart failure);LV = 左心室(left ventricle);MAC = 二尖瓣环钙化(mitral annular calcification);MR = 二尖瓣反流;MV = 二尖瓣;QoL = 生活质量(quality of life);RCT = 随机对照试验(randomized controlled trial);RV = 右心室(right ventricle);SAVR = 外科主动脉瓣置换术(surgical aortic valve replacement);STS = 美国胸外科医师学会(Society of Thoracic Surgeons);TAVR = 经导管主动脉瓣置换术(transcatheter aortic valve replacement);TEER = 经导管二尖瓣缘对缘修复术(transcatheter edge-to-edge repair)。
流行病学与临床负担
主动脉瓣狭窄合并二尖瓣反流(AS+MR)为最常见的左心多瓣膜疾病组合,在重度主动脉瓣狭窄患者中约占四分之一到三分之一。有注册研究报告称,重度主动脉瓣狭窄接受介入治疗的患者中,中度或重度二尖瓣反流的比例约为27%~40%,使这种多瓣膜疾病成为一种常见的临床情形。当重度主动脉瓣狭窄与二尖瓣反流同时存在时,二者血流动力学效应相互叠加,导致对心脏负担进一步加重。主动脉瓣狭窄引起的压力超负荷(pressure overload)可能加剧二尖瓣反流严重程度(后负荷不匹配,afterload mismatch),而二尖瓣反流导致的容量超负荷(volume overload)又进一步加剧主动脉瓣狭窄引起的舒张功能不全(diastolic dysfunction),共同加速左室重构及衰竭。此外,这种血流动力学异常的组合,还可导致单个瓣膜疾病严重程度诊断变得更加复杂。一直以来,重度AS+MR患者预后明显差于单纯主动脉瓣狭窄患者。观察性研究显示,与单纯重度主动脉瓣狭窄相比,重度主动脉瓣狭窄合并≥中度二尖瓣反流患者在1年时的死亡率高出约1.5~2倍。此外,此类患者在诊断后一年内的心衰住院率更高(例如风险增加约2.1倍),生活质量(KCCQ健康状况评分)显著更差(降低约15~20分)。这些数据凸显AS+MR显著的临床负担,支持对这一高危人群采取积极的管理策略。上述临床负担和管理复杂性的关键方面在表1中进行了总结。
表1. 主动脉瓣狭窄合并二尖瓣反流的临床负担及管理挑战现状
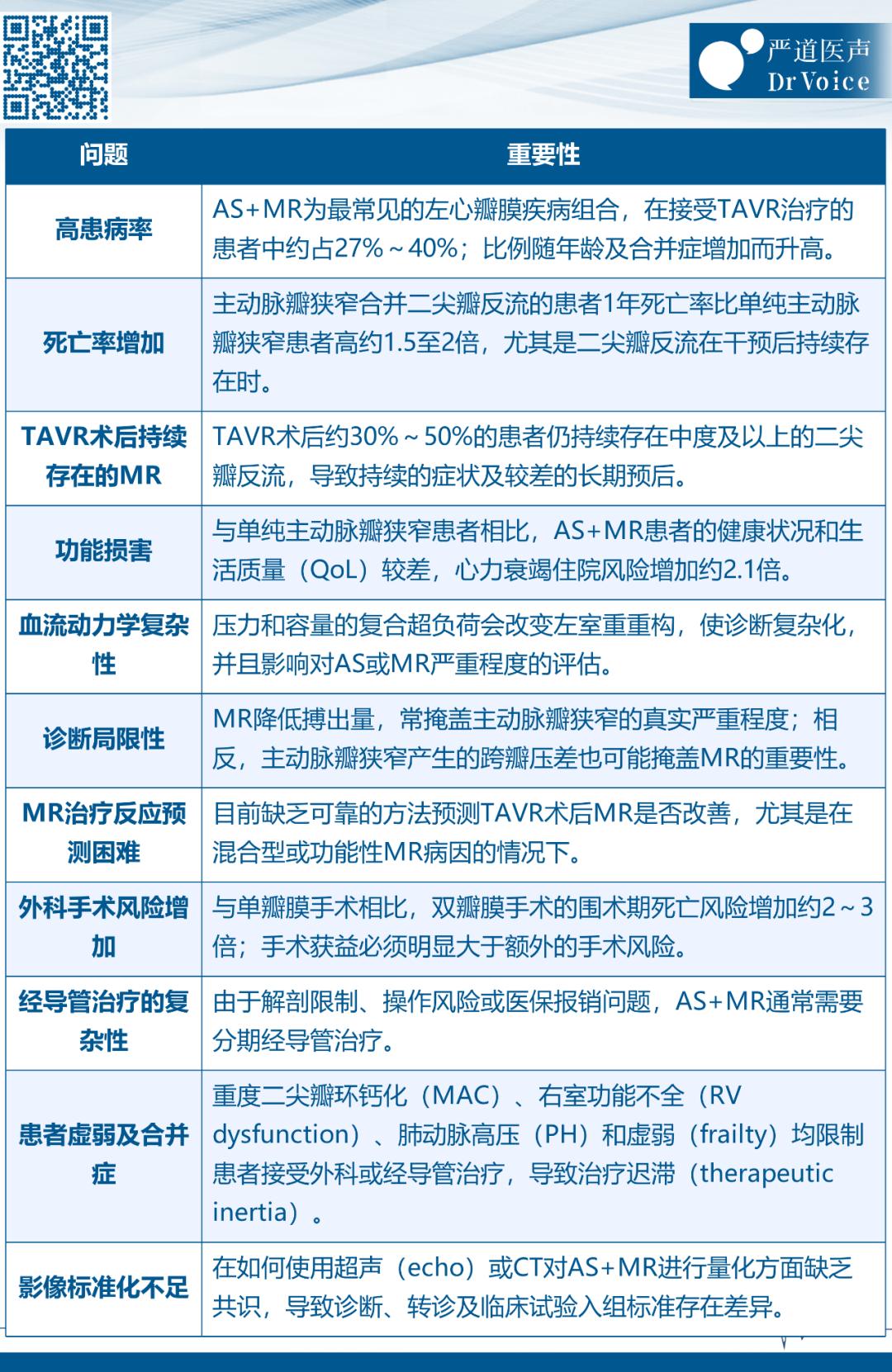 AS = 主动脉瓣狭窄;CT = 计算机断层扫描;HF = 心力衰竭;LV = 左心室;MAC = 二尖瓣环钙化;MR = 二尖瓣反流;PH = 肺动脉高压(pulmonary hypertension);QoL = 生活质量;RV = 右心室;TAVR = 经导管主动脉瓣置换术。
AS = 主动脉瓣狭窄;CT = 计算机断层扫描;HF = 心力衰竭;LV = 左心室;MAC = 二尖瓣环钙化;MR = 二尖瓣反流;PH = 肺动脉高压(pulmonary hypertension);QoL = 生活质量;RV = 右心室;TAVR = 经导管主动脉瓣置换术。
外科治疗及临床预后
对于外科手术低风险患者,重度主动脉瓣狭窄合并二尖瓣反流(AS+MR)的传统金标准治疗方式是外科双瓣膜手术,即在同一次手术中进行外科主动脉瓣置换术(SAVR)联合二尖瓣修复术(mitral valve repair,MVr)或二尖瓣置换术(mitral valve replacement,MVR)。外科手术的优势在于可同时彻底矫治两种病变,对于预期寿命较长且原发性二尖瓣反流可修复的患者,通常优先考虑外科治疗。然而,与单独瓣膜手术相比,主动脉瓣置换(AVR)联合二尖瓣手术的围术期风险明显增加。来自美国大型住院患者数据库的最新数据显示,SAVR联合二尖瓣修复术的住院死亡率约为5%~6%,而SAVR联合二尖瓣置换术的住院死亡率约为8%~10%,相比之下,单纯主动脉瓣置换术死亡率约为1%~3%。换句话说,双瓣膜手术的手术死亡风险是单瓣膜手术的2至3倍,反映手术复杂性及患者合并症负担增加的情况。外科预后的重要预测因素包括二尖瓣反流病因及患者心室功能。对于原发性(退行性)二尖瓣反流患者,二尖瓣修复术相较置换术具有明显生存获益(如在继发性二尖瓣反流修复术后5年生存率约62%,而原发性二尖瓣反流修复术后为约78%)。而左室射血分数显著降低(<30%)或存在其他合并症的患者面临显著增加的手术风险(例如,左心室射血分数<30%的患者手术死亡风险增加约3倍)。同时,二尖瓣环钙化也可能使二尖瓣手术复杂化,有时需行瓣膜置换而非修复。在一项小规模的单中心研究中,双瓣膜手术相较于单纯经导管主动脉瓣置换术(TAVR)并未显示出生存获益。事实上,在单纯接受SAVR治疗的患者中,约50%~70%的患者术后出现二尖瓣反流的减轻,而在单纯TAVR术后的患者中也有约50%的患者二尖瓣反流获得改善。尽管存在上述挑战,在经过适当选择的患者中,外科主动脉瓣置换术联合二尖瓣手术(AVR+MV)仍可有效挽救生命并提供持久疗效。目前指南推荐,对于重度主动脉瓣狭窄合并重度原发性二尖瓣反流应行双瓣膜外科手术,除非患者外科手术风险高或存在禁忌;而外科手术高风险患者则可考虑分期进行经导管治疗。对于重度主动脉瓣狭窄合并重度继发性二尖瓣反流患者,目前的证据尚不足以支持常规行双瓣膜手术,因此对于此类患者,采取双瓣膜外科手术或分期经导管治疗的决策应通过共同决策来完成。
尽管当前外科指南通常建议当第二个瓣膜病变达到重度时进行干预,但对中度继发性瓣膜病变的推荐并不明确。近期美国心脏病学会/美国心脏协会(American College of Cardiology/American Heart Association,ACC/AHA)指南中,已因缺乏证据取消在主动脉瓣置换术时同时处理中度二尖瓣反流的适应证。事实上,有研究提示,伴随重度二尖瓣反流时实施双瓣膜手术,或伴随中度二尖瓣反流时单纯实施主动脉瓣置换术(isolated AVR),其生存率均优于伴随重度二尖瓣反流时仅进行单纯主动脉瓣置换术。一项近期对13个非随机研究的荟萃分析提示,对于中度或以下的功能性二尖瓣反流(functional mitral regurgitation,FMR)且无病情恶化预测因素的患者,应保守地仅行主动脉瓣置换术治疗;而中度至重度功能性二尖瓣反流,特别是伴随房颤、左房扩大、左室质量指数(LV mass index)升高、肺动脉高压或主动脉瓣峰值跨瓣压差(peak transaortic gradients)较低等病情恶化预测因素的患者,则可能从双瓣膜手术中获益。对于中度主动脉瓣狭窄合并重度二尖瓣反流的患者,目前尚缺乏明确的推荐意见。一项单中心研究提示,在外科主动脉瓣置换术(SAVR)组中,患者5年内未进展至重度主动脉瓣狭窄的生存率更高;然而,全因死亡率并未显示出显著差异。最后,使用经导管技术治疗二尖瓣反流的解决方案,可能会改变实施双瓣膜手术的临床决策阈值。本次研讨会强调,鉴于临床实践存在广泛差异,迫切需要更多高质量的证据指导这些决策。
经导管治疗及临床预后
过去十年中,经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)的出现彻底改变了主动脉瓣狭窄的治疗格局,即便是高风险或年龄较大的患者,亦可接受这种微创治疗方式。对于不适合接受外科手术治疗的主动脉瓣狭窄合并二尖瓣反流(AS+MR)患者(例如STS 风险评分较高或存在虚弱情况),通常会考虑经导管治疗策略。通过TAVR优先治疗主动脉瓣狭窄,有时可因左室负荷减轻而改善继发性二尖瓣反流。事实上,据估计约30%~60%的患者在TAVR后显著的二尖瓣反流会获得改善,尤其是继发性(功能性)二尖瓣反流。例如,一项注册研究发现,TAVR术后30天约58%~69%的患者二尖瓣反流严重程度至少降低1个等级。然而,这也意味着仍有相当一部分患者术后存在持续二尖瓣反流。研究显示,中度或以上二尖瓣反流在TAVR术后约30%~50%的病例中持续存在。这类患者的预后令人担忧——与二尖瓣反流改善的患者相比,TAVR术后持续存在重度二尖瓣反流的患者,其死亡率和再住院率更高。一项多中心分析发现,TAVR术后中度及以上二尖瓣反流患者4年死亡率约为44%,而二尖瓣反流减轻或仅为轻度的患者死亡率约为32%~35%。类似地,在低流量、低压差重度主动脉瓣狭窄患者人群中,也有约44%的患者出现二尖瓣反流改善,而持续存在大于2+级的二尖瓣反流则是1年内死亡或心衰住院等主要结局事件的独立预测因素。TAVR后二尖瓣反流改善的重要预测因素包括二尖瓣反流病因及解剖因素:功能性二尖瓣反流(由左室扩张引起)且解剖条件较好的患者(如无严重二尖瓣环钙化、较小缩流颈[vena contracta,注:可以反映反流口面积,是定量评估瓣膜反流严重程度的重要指标])更可能出现二尖瓣反流的减轻;而原发性二尖瓣反流、瓣环严重钙化、房颤或左心房显著扩大的患者,术后常出现持续的二尖瓣反流。
这些观察结果引出了关键问题:哪些主动脉瓣狭窄合并二尖瓣反流患者可以单纯接受TAVR 治疗,哪些患者应同时或分期接受二尖瓣干预?本次研讨会强调,这一问题并不存在普遍适用的标准答案;必须由心脏团队(heart team)逐个病例仔细评估,包括患者的手术风险、二尖瓣反流(MR)的机制以及治疗目标。
对于仍属于高风险或不可手术的重度AS+MR患者,经导管二尖瓣治疗已成为TAVR的重要辅助手段。目前主要存在两种策略:一种是分期治疗策略(staged strategy),即首先进行TAVR,随后评估二尖瓣反流情况并视需要再进行二期治疗;另一种是同期经导管策略(concomitant transcatheter strategy),即在同一手术中同时治疗两个瓣膜。目前分期治疗策略(TAVR → 再评估 → 经导管二尖瓣缘对缘修复术 [transcatheter edge-to-edge repair,TEER])更为常见,这样可以在等待期间观察MR是否改善,并在需要时计划下一步二尖瓣干预。然而,分期治疗延长了整体治疗过程,且若二尖瓣反流严重,患者可能在等待期间面临心力衰竭(heart failure)的风险。同期治疗方法(例如在同一手术中依次进行TAVR和TEER)因一次手术即完成所有治疗而具备吸引力,但这一策略需要丰富的经验并存在较高的手术复杂性。早期对联合TAVR+TEER治疗的经验显示其技术成功率较高(两个瓣膜均成功干预的比例约为85%~95%)。一些小规模研究提示,联合进行TAVR和TEER是可行的,且早期预后可接受,例如高风险患者的30天死亡率约为4%~7%,似乎与分次进行的治疗相当甚至稍优。然而必须注意的是,同期治疗选择的患者人群非常特殊,且目前尚无随机研究数据证明联合治疗在临床预后方面的优势。因此,对于AS+MR患者是单纯接受TAVR治疗,抑或TAVR后计划分期的二尖瓣干预,还是同时进行双瓣膜经导管治疗,仍需根据个体情况进行决策。研讨会专家小组强调,有必要获得更多证据,以明确治疗顺序的优化方法,例如:若选择分期治疗,在TAVR后治疗二尖瓣反流的理想时间间隔是多少;若选择联合TEER治疗,哪些患者或解剖因素可以预测这一联合策略的成功或失败?
关键治疗挑战与尚未解决的问题
主动脉瓣狭窄合并二尖瓣反流(AS+MR)的治疗需应对若干独特挑战。首先,准确评估疾病严重程度存在困难——重度二尖瓣反流可导致较低的前向每搏输出量,从而可能低估主动脉瓣狭窄的跨瓣压差;而主动脉瓣狭窄亦可能掩盖MR的真实影响。通常需要采用先进影像技术(如综合超声心动图、CT、磁共振成像)以确定每种瓣膜病变的严重程度及其相互影响。存在MR的情况下以相同标准量化AS严重程度(反之亦然)更为重要,因为分类错误可能导致不理想的治疗决策。其次,双瓣膜疾病患者的心力衰竭管理较为复杂:临床医生必须在后负荷降低(以缓解AS压力负荷)与前负荷优化(以管理MR)之间取得平衡,同时避免低血压或肺水肿的发生。重度 AS+MR患者易发生急性失代偿,在病情晚期,若两个瓣膜病变无法及时纠正,可能需要临时机械循环支持,甚至考虑心脏移植或左室辅助装置(left ventricular assist device,LVAD)。另一个挑战是确定每个病变干预治疗的时机。一些临床情景仍存在不确定性,例如:重度AS合并中度MR时——应当在实施主动脉瓣置换术(AVR)或经导管主动脉瓣置换术(TAVR)时同时外科或经皮干预MR,还是可以推迟,仅首先治疗AS?反过来,对于中度AS合并重度MR的患者,应当首先进行二尖瓣手术或经导管二尖瓣缘对缘修复术(TEER),等待AS进一步进展再干预,抑或应一开始便同时干预两种病变?研讨会的讨论表明,目前尚缺乏共识,反映出现有证据的不足。此外,当AS与MR均为重度时,决定采取同期(single-stage,外科或经导管)还是分期(2-stage)治疗也颇具挑战性,而MR病因(原发性与继发性)、患者年龄以及治疗中心的专业经验均会影响决策。
研讨会确定的尚未解决的关键问题包括:
患者选择(Patient Selection):哪些患者真正能够从在主动脉瓣狭窄治疗的基础上额外接受二尖瓣干预中获益?例如,对于可能自行改善的继发性二尖瓣反流的老年患者,单纯经导管主动脉瓣置换术(TAVR)是否就已足够,抑或同时联合经导管二尖瓣缘对缘修复术(TEER)才能使患者获益更多?反过来,在相对年轻、原发性二尖瓣反流(primary MR)的患者中,是否可以接受TAVR联合TEER而暂不行外科手术,还是说这样做可能会牺牲远期耐久性(durability)?
最佳治疗顺序(Optimal Sequencing):如果选择联合经导管策略,是在TAVR后立即进行二尖瓣修复更佳,还是延迟数天至数周分期治疗更合适?优先治疗主动脉瓣狭窄是否总能使后续的二尖瓣修复更安全,或者延迟治疗会否使患者在此期间面临心力衰竭(heart failure)风险?目前尚无临床试验回答这一问题。
影像学评估与随访(Imaging and Monitoring):在治疗一个瓣膜病变后,如何通过随访确定第二个瓣膜是否需要干预?TAVR术后残余二尖瓣反流(residual MR)的程度达到何种水平、持续多长时间时应启动下一步干预?目前亟需定义能够指导这些决策的高级超声心动图标准。
二尖瓣反流病因的影响(MR Etiology Influence):二尖瓣反流的病因(退行性瓣叶病变 [degenerative leaflet disease] 与左室功能不全 [LV dysfunction] 导致的功能性病变)是否会改变AS+MR的治疗策略?直观上确实如此——退行性二尖瓣反流通常不会在不干预的情况下自行缓解——但每种情形下具体启动干预的阈值尚缺乏明确的数据定义。
主动脉瓣狭窄合并二尖瓣反流(AS+MR)管理中最迫切的未解决问题在表2中列出。解决这些问题需要开展有针对性的研究工作,具体讨论见后文。
表2. 主动脉瓣狭窄合并二尖瓣反流管理中的未解决知识空白

心脏瓣膜合作组织(Heart Valve Collaboratory,HVC)研讨会强烈建议开展专门的研究计划,以强化主动脉瓣狭窄合并二尖瓣反流(AS+MR)管理的循证依据。拟议的科学倡议和战略重点摘要见表3。研究建议包括前瞻性注册研究(prospective registries)和随机临床试验(randomized trials):
多中心注册研究(Multicenter Registry):建立大型前瞻性AS+MR患者注册数据库,以了解其自然病程(natural history)和治疗结局。一个规模约为1000至2000名患者的多中心注册研究,可以允许进行详细的亚组分析(例如,重度主动脉瓣狭窄+中度二尖瓣反流、中度主动脉瓣狭窄+重度二尖瓣反流,以及重度主动脉瓣狭窄+重度二尖瓣反流亚组)。核心数据要素应包括标准化的超声心动图测量(由核心实验室审核以确保一致性),对二尖瓣反流机制的评估(原发性 vs 继发性),二尖瓣环钙化的量化,以及对结局和生活质量的长期跟踪。这一注册研究能够解答一些基础性问题,例如:在接受外科主动脉瓣置换术(SAVR)或经导管主动脉瓣置换术(TAVR)治疗主动脉瓣狭窄(AS)的患者中,未经处理的中度二尖瓣反流(MR)的自然病程如何?反过来,如果单独干预二尖瓣反流,中度主动脉瓣狭窄(AS)的病情将如何变化?哪些患者因素可以预测TAVR后MR的改善,以及单纯接受TAVR治疗后的长期生存情况?在真实世界中,不同管理策略(药物治疗vs TAVR vs 外科手术 vs 联合治疗)的临床预后如何?这些数据可为进一步的假设生成和试验设计提供依据。
随机临床试验:提出了几个试验概念,以直接比较不同的治疗策略:
1. 单纯TAVR治疗 vs TAVR联合二尖瓣缘对缘修复术(TAVR+M-TEER):针对外科手术高风险且重度主动脉瓣狭窄(AS)合并重度继发性二尖瓣反流(secondary MR)的患者,可开展随机临床试验比较单纯TAVR治疗与在同一次手术中同时进行TAVR联合二尖瓣缘对缘修复术(TEER)的效果。主要研究终点可以设定为1年内死亡或因心力衰竭住院的复合终点,以评估前期同时进行双瓣膜治疗是否能改善患者的临床结局,或仅仅增加了手术风险及成本。这一试验将明确在无法接受外科手术的患者中,在TAVR时同时干预二尖瓣反流(MR)的获益情况。
2. 分期治疗的最佳时机(Optimal Timing of Staged Therapy):对于首先接受TAVR治疗的重度主动脉瓣狭窄(AS)合并重度二尖瓣反流(MR)患者,可进行随机试验,比较早期(例如TAVR术后1个月)即计划进行TEER与延迟干预策略(观察等待,若6~12个月后MR仍显著再考虑TEER)的效果差异。关键结局指标包括1年时MR减轻程度、左室重构(LV remodeling)情况以及临床结局。这项试验将明确早期进行第二次瓣膜干预是否对患者有益,抑或许多患者病情好转后无需再行干预。
3. 外科手术 vs 复合治疗策略(Surgery vs Hybrid Approach):针对外科手术中等风险(美国胸外科医师学会 [Society of Thoracic Surgeons,STS] 风险评分约4%~8%)且适合两种治疗策略的患者,可进行随机试验,比较传统的开放式双瓣膜手术(主动脉瓣置换术 [AVR] 联合二尖瓣修复术 [MV repair])与复合治疗方法(先进行TAVR,再行微创外科或经导管二尖瓣修复术)。1至2年内的终点指标包括无需再次干预的生存率、术后恢复时间及生活质量(quality of life)。随着经导管治疗方法的扩展,这项研究将阐明在这一风险水平患者中,混合治疗的临床结局是否能接近传统外科手术的效果,从而为希望避免开放式手术的患者提供更多治疗选择。
高级影像与数据分析(Advanced Imaging and Analytics):研究议程还强调了在影像和数据分析领域进行创新的必要性。针对主动脉瓣狭窄合并二尖瓣反流(AS+MR),需要开发标准化的多模态影像学方案,例如联合应用三维超声心动图(3-dimensional echocardiography)和心脏计算机断层扫描(computed tomography,CT),以更好地预测哪些二尖瓣反流(MR)在经导管主动脉瓣置换术(TAVR)后可以获得改善。临床试验和注册研究应纳入核心实验室(core laboratory)分析,以减少MR严重程度评估的差异。此外,将人工智能(artificial intelligence,AI)和机器学习(machine learning)应用于影像和临床数据,有望帮助识别特定模式(例如,建立基于瓣膜形态和心室指标预测TAVR术后MR持续存在的预测模型)。此类工具最终可能会指导个体化决策(例如,应用AI风险评分,以决定患者是仅行TAVR治疗还是联合TAVR和经导管二尖瓣缘对缘修复术 [TEER] 治疗)。
表3. 推动主动脉瓣狭窄合并二尖瓣反流(AS+MR)管理的科学重点与战略建议

综上所述,这些研究和创新举措将填补主动脉瓣狭窄合并二尖瓣反流(AS+MR)领域的证据空白,为当前缺乏明确共识的最佳管理策略提供清晰指引。心脏瓣膜合作组织(Heart Valve Collaboratory,HVC)的目标是通过促进机构间的协调,以及使利益相关方(stakeholders)在研究重点方面达成一致,来推动上述工作的开展。
基于此次研讨会的讨论,明确提出了以下几项建议,以改善主动脉瓣狭窄合并二尖瓣反流(AS+MR)患者的临床治疗:
即刻优先事项(Immediate Priorities):建立国际性的AS+MR注册研究(registry),通过标准化的数据收集与影像学评审,开始积累相关临床证据。同时,召开专家小组(包括心脏团队 [heart teams]、影像学专家 [imagers] 和外科医生 [surgeons]),制定用于评估AS+MR严重程度的共识定义(例如:在MR存在时如何对AS进行分级、干预治疗后MR改善的统一标准)。这将确保未来研究能采用统一的术语,同时在等待临床试验结果期间,为临床医生提供过渡性的指导。
中期目标(Midterm Goals):启动前述拟议的随机临床试验,以直接比较不同的治疗策略。这些试验将为指南的制定提供最高等级的临床证据。此外,还需投入力量验证新兴技术,如预测临床预后或自动化影像分析的人工智能(AI)算法,从而支持多瓣膜疾病(multivalvular disease,MVD)情境下的临床决策。
长期愿景(Long-Term Vision):将注册研究和临床试验的结果整合到最新的瓣膜性心脏病(valvular heart disease)指南中,特别是针对主动脉瓣狭窄合并二尖瓣反流(AS+MR)的管理建议。最终,将为AS+MR开发的协作框架扩展至其他常见瓣膜组合(例如主动脉瓣狭窄合并三尖瓣反流 [tricuspid regurgitation] 或二尖瓣反流合并三尖瓣反流),以及适用于那些不适合任何常规治疗的“C队列”(Cohort C)患者群体。最终目标是实现多瓣膜病(MVD)的管理基于循证医学(evidence-based),实现标准化(standardized)并根据每个患者的独特情况实现个体化(personalized)治疗。
2024年心脏瓣膜合作组织(Heart Valve Collaboratory,HVC)研讨会强调,主动脉瓣狭窄合并二尖瓣反流是一项迫切的临床问题,也体现了更广泛的多瓣膜病(multivalvular disease,MVD)管理挑战。AS合并MR的患者具有较高的发病率与死亡率,而目前的治疗方式受限于缺乏充足的临床数据。通过召集专家并明确提出有针对性的研究计划,HVC已经迈出了弥补这一证据空白的关键第一步。当前迫切需要的是协调一致的策略,包括协作研究(collaborative research)、指南制订(guideline development)和技术创新(innovation),以改善AS合并MR患者的临床预后。由此获得的经验不仅有益于这一庞大的患者群体,同时也可作为解决其他复杂瓣膜病组合的范本。通过持续的合作与探索,心血管医学界致力于为所有多瓣膜病患者提供更加个性化(personalized)、循证的(evidence-based)医疗服务,即使在“主动脉瓣狭窄并非孤立存在”的情况下,也能进一步接近最优的临床结局。
参考文献
https://www.sciencedirect.com/science/article/pii/S0735109725066446