健心知著
2025.04.25
第466期

新型BifurcAID风险评分预测冠脉真分叉病变介入预后

刘健、范朋飞、聂文畅
北京大学人民医院
健心荐语
冠状动脉分叉病变占所有经皮冠状动脉介入(PCI)治疗的15%至20%,真分叉病变治疗会带来额外的手术挑战, 并且与更高的不良临床事件风险相关。然而,目前缺乏真分叉病变PCI后结局的预测模型。
文章介绍
本研究旨在通过制定一种新的评分系统来预测真正分叉病变PCI后1年内主要不良心血管事件(MACE)风险。本文于2025年3月发表于JACC Cardiovascular Intervention杂志。
研究方法
研究纳入了2012年至2019年期间接受PCI治疗真分叉病变的共计1896例连续患者。由独立核心实验室审查所有血管造影片,并对分叉病变进行分类。多变量模型识别了与1年MACE相关的因素,包括全因死亡、心肌梗死(MI)和靶血管血运重建(TLR)。根据回归系数以创建累积风险评分,该评分用于将患者分为低风险、中等风险和高风险队列。
研究结果
1857例(97.9%)患者完成1年随访,累计MACE发生率为9.8%(185例)。基线临床特征列于表1。糖尿病在MACE组中更为常见(53.0% vs 40.5%;P=0.001);NSTEMI患者的患病率更高(16.2% vs 9.4%;(0.005)和LVEF在分叉病变PCI后1年发生MACE的患者中显著降低。MACE组中,NSTEMI的患病率更高(16.2% vs 9.4%;P=0.005)、LVEF更低。
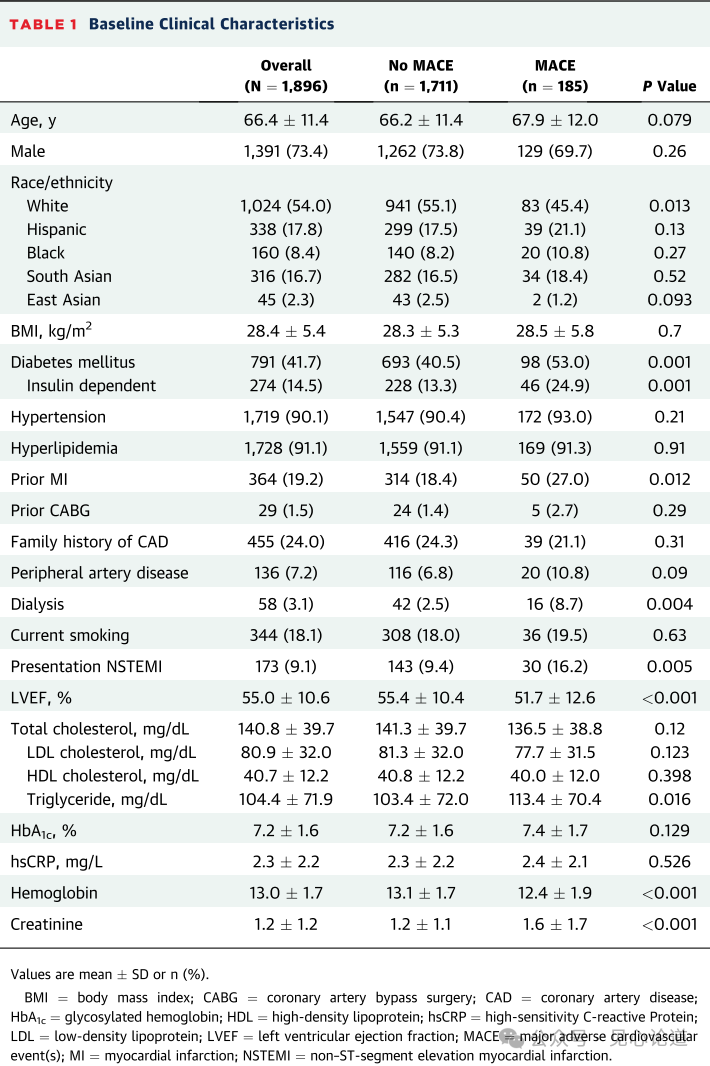
表1:基线临床特征
与非MACE组相比,MACE组的左主干分叉病变更为普遍(22.7% vs 8.0%;P<0.001)(表2),无MACE组中前降支/对角支更为常见(67.4% vs 49.2%;P < 0.001)。多血管病变在MACE患者中更为常见(74.6% vs 58.0%;p <0.001)。两组在参考血管直径、管径狭窄、病变长度、钙化程度等主支病变特征上均无差异。MACE组边支病变更长(12.4±8.6 mm vs 11.0±7.4 mm;P = 0.021),中重度钙含量较高(16.2% vs 8.2%;P < 0.001) (表2)。
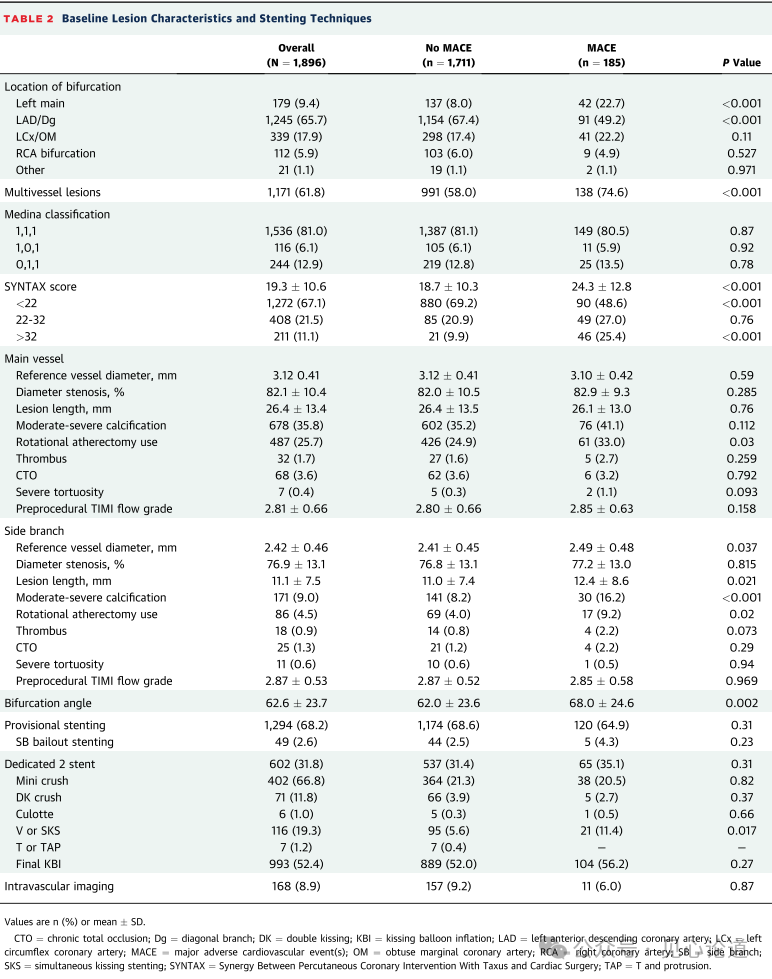
表2:基线病变特征和支架置入技术
通过多变量模型共确定了11个MACE的预测因子:5个临床因素(胰岛素依赖型糖尿病、LVEF≤30%、NSTEMI表现、年龄>80岁和非白人种族),以及6个血管造影病变特征(左主干分叉病变、回旋支/钝缘支分叉病变、多血管病变、边支血栓、边支中重度钙化以及边支病变长度>10 mm)。基于其回归系数对每个变量赋分,建立的BifurcAID风险评分范围为0至26分(表3),低风险为评分0至6,中风险为评分7至9,高风险为评分≥10。该风险评分的预测能力优于任何单独变量。
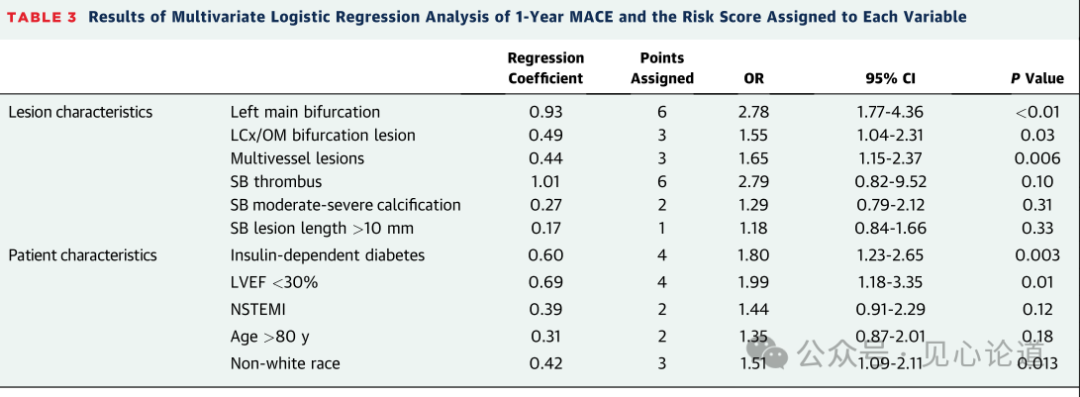
表3:1年MACE的多因素Logistic回归分析结果及各变量的风险评分
按BifurcAID风险评分对入组患者分层后的1年随访结果显示,低风险患者的MACE发生率为4.9%,与低风险组相比,中风险患者的MACE发生率为12.9%(OR:2.63;95% CI:1.74-3.98;P < 0.001),高风险组的MACE发生率为25.4%(OR:5.18;95% CI:3.56-7.53;P < 0.001)(表4)。除MACE外,与低危患者相比,高危患者的死亡率、心肌梗死、TVR、TLR 也更高。
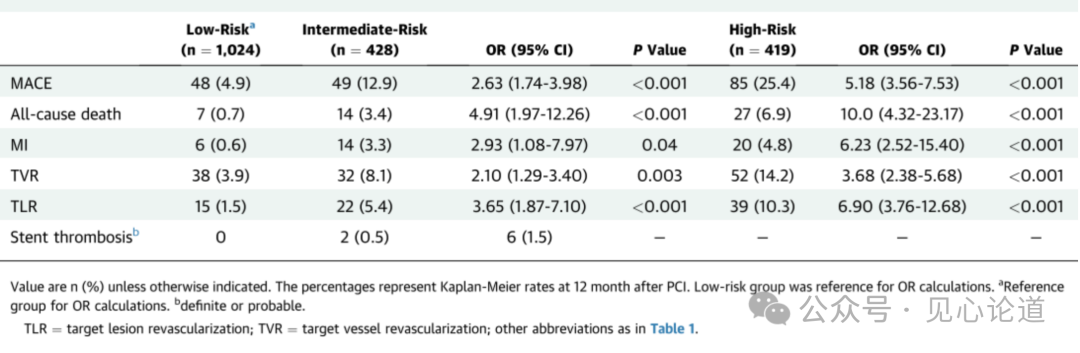
表4:低风险(:0-6)、中风险(评分:7-9)和高风险(评分≥10)患者的临床结局
结 论
研究开发了一种新的BifurcAID评分系统来预测接受PCI治疗的真分叉病变患者的1年MACE,该系统提供了一种更全面的风险分层方法。
讨论
新评分系统与目前对分叉病变管理复杂性的理解一致,为临床医生提供了一种新的工具,以更好地预测和预防PCI术后真分叉病变患者的MACE风险。同时,需要进一步的研究来评估该评分系统如何指导更积极的药物治疗或量身定制的干预策略,最终改善分叉病变PCI患者的预后。