

2025年4月(总第16期)
作者:王义为 毛予 翟蒙恩 马燕燕 李兰兰 刘洋 杨剑
////////////////////////////////////////
引言:经导管二尖瓣“环中瓣”置换术(TMViR)是一种新兴的替代治疗方法,适用于因既往二尖瓣成形术失败而复发的二尖瓣反流(MR)患者。然而,该术式在术中仍可能面临常见问题及并发症,尚需进一步探索解决策略。

患者为67岁男性,因重度MR及中度三尖瓣反流,曾接受外科二尖瓣修复术及三尖瓣环成形术,植入了一枚36 mm Edwards Physio瓣环。三个月前,患者因乏力、胸闷及活动后呼吸困难(NYHA分级 IV级)再次入院,超声心动图提示二尖瓣反流复发,重度反流(反流容积36.0 mL;Vmax = 167 cm/s),最大跨瓣压差为13 mmHg,左心室扩大,射血分数为46%。
西京医院杨剑教授团队对患者的经食道超声(TEE)及CTA影像进行了详细评估,虑到患者症状明显、且再次开胸手术风险极高(STS评分 11.192%;EuroSCORE II评分 8.3%),最终决定实施TMViR(见图1A–E)。


图1.(A-E)术前影像学评估。(A) 术前超声心动图提示重度二尖瓣反流。(B–E) 术前CTA用于评估二尖瓣瓣环及左心室流出道结构。(B) 二尖瓣成形环面积为 7.0 cm²。(C, D) 模拟植入Mi-thos生物瓣膜后,新的左心室流出道面积为 374.6 cm²,未见梗阻发生。(E) 术中瓣膜植入投影角度为 RAO 46°,CAU 22°。
为实现精准评估,杨剑教授团队基于CTA数据构建了患者个性化的3D打印模型。首先将DICOM格式影像导入Materialise Mimics 21.0软件(比利时鲁汶),完成图像分割并导出为STL文件,随后使用Materialise 3-Matic 14.0版本对STL文件进行后处理。最终,模型被导入至Polyjet 850多材料全彩3D打印机(Stratasys公司,美国明尼苏达州伊甸草原)进行打印。该打印机使用不同柔软度的材料,精准还原瓣环和心肌组织等不同结构的真实质地(图1F–H)。
术前利用模型进行了台架测试,清晰观察到释放后的生物瓣膜展开情况,有助于预测围术期可能出现的主要并发症。由于36 mm Physio瓣环的面积为7.0 cm²,且其为D型半刚性结构,使用常规“瓣中瓣”技术(Valve-in-Ring)存在较高并发症风险,故最终选择经心尖路径植入Mi-thos瓣膜系统(图1I)。

1.手术在全身麻醉及机械通气下进行,并在术中采用透视和TEE引导。首先在左前胸部行一4 cm小切口,经心尖建立穿刺通道。经右侧股动静脉分别穿刺置入6F鞘管,随后通过静脉鞘管将临时起搏电极导入右心室。同时,经右股动脉置入6F猪尾导管至左心室。
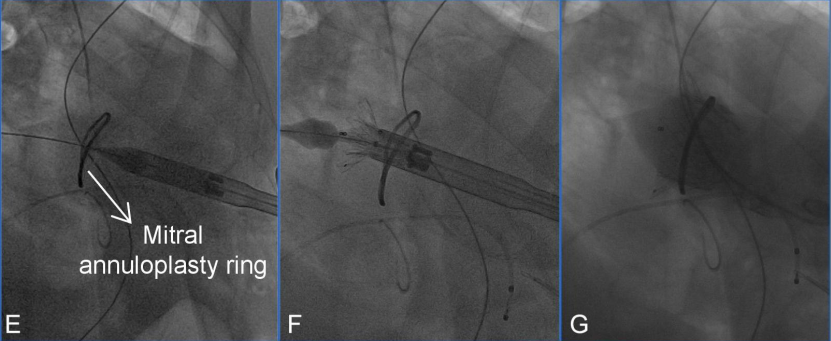
2.在成功建立标准心尖通道并使用六边形缝合方式固定穿刺口后,为了更清晰地显影左心室与左心房结构,术中调整至颅侧右前斜位角度进行操作。造影检查评估二尖瓣反流情况(图D)、左心室形态及瓣环结构。

图D:术中造影提示二尖瓣严重反流
3.根据术前基于患者个体CTA数据制作的3D打印模型模拟评估(图A–C)。

图A-C:术前使用3D打印模拟手术(A) 调整瓣膜释放位置及其与瓣环的同轴对齐。(B, C) 生物瓣膜完全展开,可分别在左心房和左心室视角下观察其状态。
4.在体外将33 mm Mi-thos生物瓣膜与输送系统装配完毕,随后,于心尖处完成穿刺,并置入6F鞘管,然后送入6F猪尾导管和J头0.035英寸导丝并跨越手术修复后的二尖瓣环,导入左心房。接着,更换为260 cm的Lunderquist超硬导丝(Cook Medical公司,美国印第安纳州布卢明顿)。
4.随后,沿导丝将输送系统以逆行方式经心尖途径通过二尖瓣成形环推进至左心房。通过回撤输送系统的外鞘,释放出设计用于贴合D形二尖瓣瓣环的心房裙边,该裙边在TEE和造影的引导下精确覆盖于原瓣环及成形环之上,而瓣膜的心室部分仍部分保留在鞘管中。

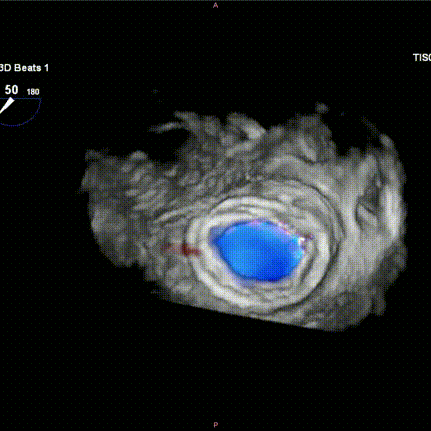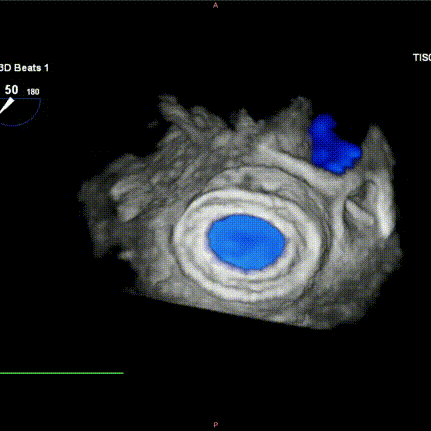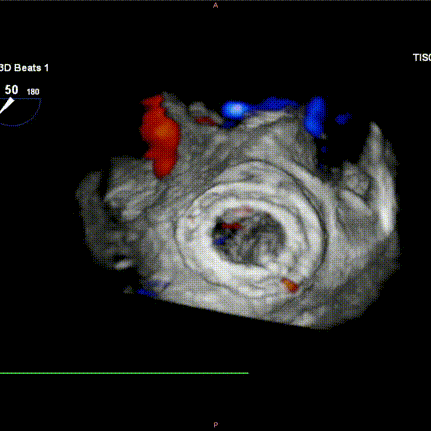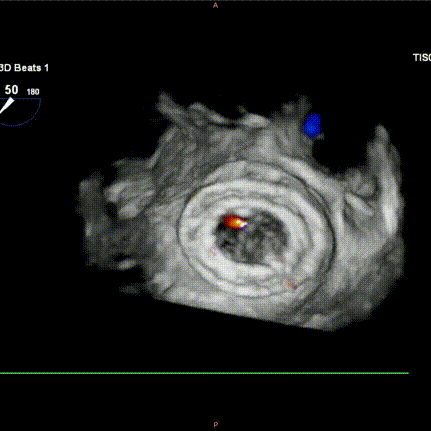
图H-I:瓣膜释放后食道超声检查提示瓣膜位置稳定,功能良好,且无瓣周漏发生。
5.在确认Mi-thos瓣膜的位置和对位无误后,缓慢回撤输送系统,使其准确定位于瓣环上。随后,140次/分快速起搏下释放心室部分的瓣膜,并通过其自带的固定倒钩装置牢固锚定于原生二尖瓣位置上。
6.术中左心室造影即刻显示Mi-thos生物瓣膜位置良好、形态理想,未见瓣内反流、瓣周漏(PVL)或左心室流出道梗阻(LVOTO)现象(新生左心室流出道面积为 374.6 cm²);TEE进一步评估瓣膜位置及功能,显示平均跨瓣压差为3 mmHg。

7.最后,输送系统经心尖切口顺利取出,使用术前预置的心尖缝线成功止血,切口关闭后,患者顺利撤机,并被转入心脏重症监护病房。
术后恢复情况
患者术后恢复过程顺利,术后第5天,患者以良好的一般状态出院。出院前经胸超声心动图检查提示,瓣膜位置和功能良好,无明显瓣内或瓣周反流,也未见 LVOTO;最大和平均跨瓣压差分别为6mmHg和2mmHg。患者症状较术前明显改善,NYHA分级 II 级。
本病例报告展示了Mi-thos系统在瓣环成形失败后所致二尖瓣反流患者中,通过经心尖路径实施TMVR的可行性与安全性。该装置操作便捷,术中可有效稳定患者状态,显示出在特定患者中实施微创治疗的广阔前景。其结构设计优势可有效减少常见TMVR并发症,而 3D打印技术在术前评估和模拟中的应用,进一步提升了TMViR的可行性与安全性,为制定精准、个性化的手术策略提供了有力支持。
