
心包积液是指在脏层和壁层心包之间积聚过多的液体,可由特发性、病毒性、细菌性、自身免疫性或心肌梗死后等引起。恶性心包积液占13%~23%,通常由肺癌或乳腺癌转移引起。原发性心包肿瘤如间皮瘤和肉瘤则较为罕见。近期,《European Heart Journal - Case Reports》发表了“Heart-breaking tumours: a case series of malignant pericardial effusion”,突出了原发性心包肿瘤的诊断和治疗挑战。

病例1
患者男性,49岁,非洲黑人,在接种第一剂COVID-19疫苗4周后出现胸痛和呼吸困难。入院时除血压略高(180/100 mmHg)外,其他检查结果正常。心电图示I、II、V4-V6导联PR段压低,V2-V6、I、II导联为凹面向上的ST段抬高(图1)。
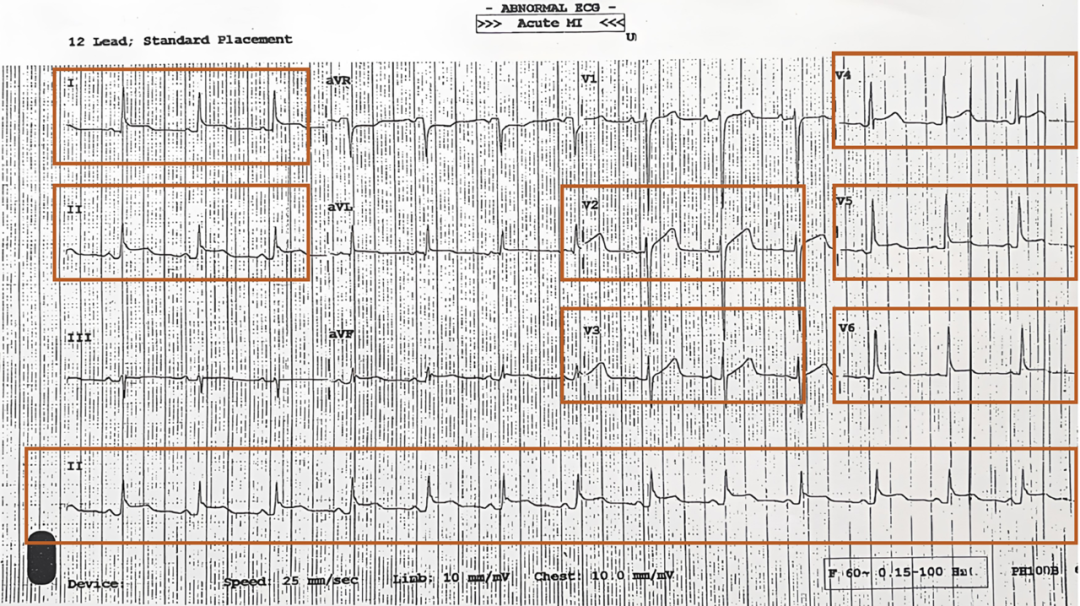
图1 入院心电图示V2-V6、I、II导联为凹面向上的ST段抬高。
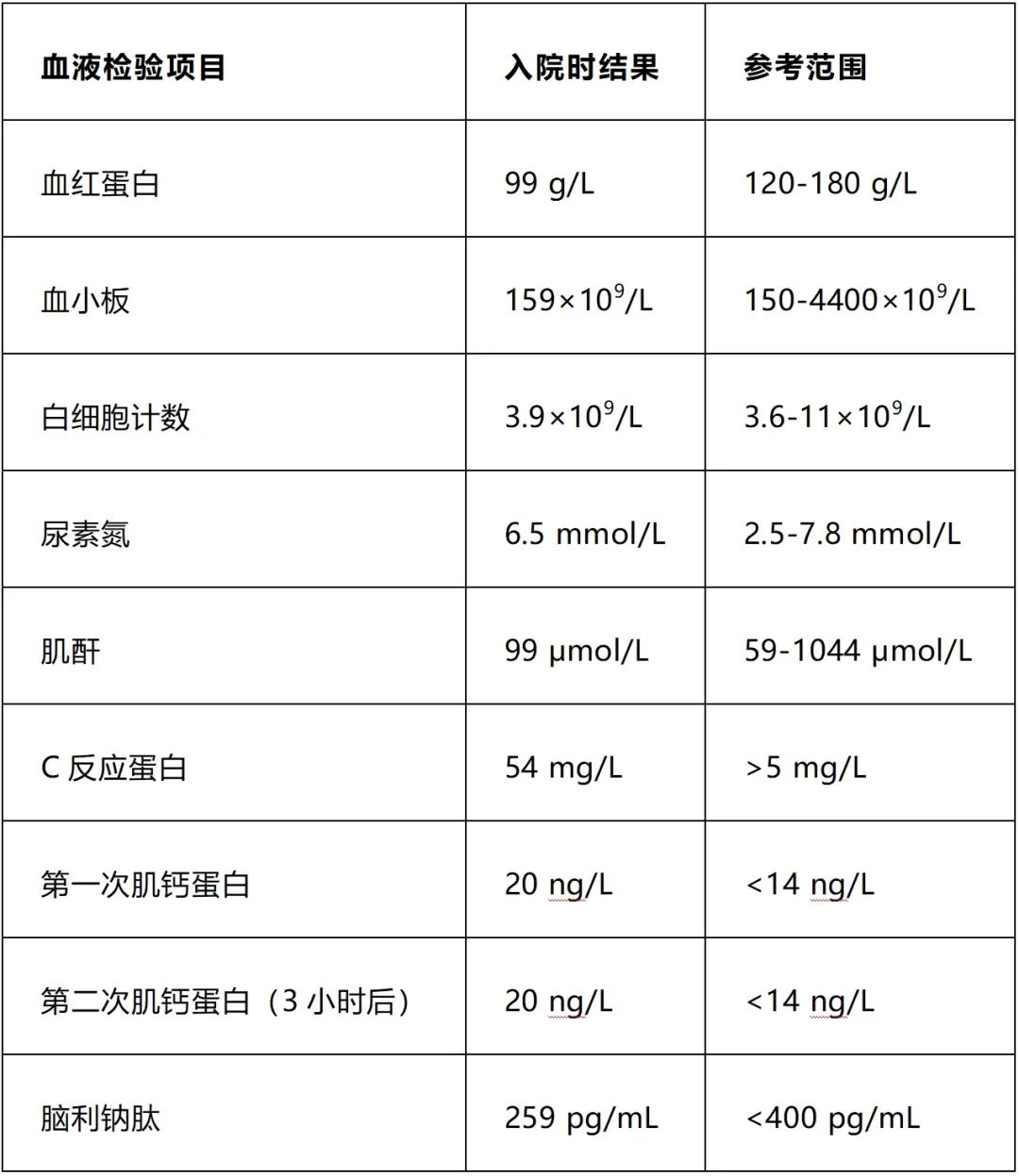
初始检验显示C反应蛋白(CRP)升高(54 mg/L)(表1),但血清肌钙蛋白水平没有连续升高,表明疑似继发于 COVID-19 疫苗接种的心包炎。治疗重点是控制心包炎。
表1 入院时检验结果
患者未按时进行随访超声心动图检查,4周后因呼吸困难加重再次入院。床旁超声心动图显示大量心包积液和右心室舒张期塌陷,提示心脏压塞,需要紧急穿刺引流。心包积液为血性,但细胞学检查未发现恶性细胞。
患者在一家纸板厂工作,无石棉接触史,有2型糖尿病和高血压病史。
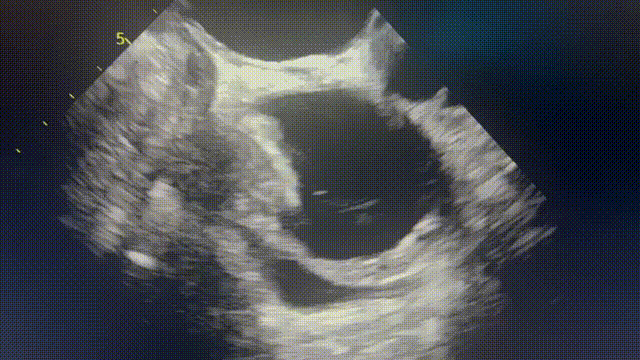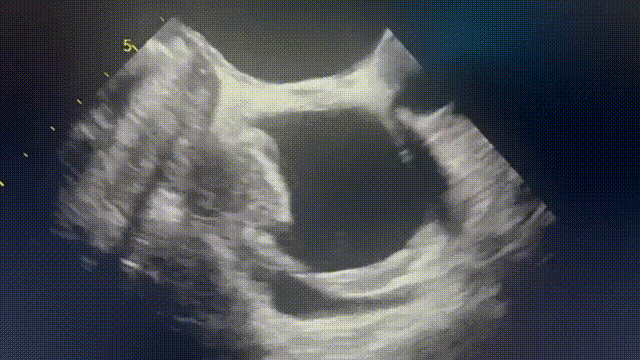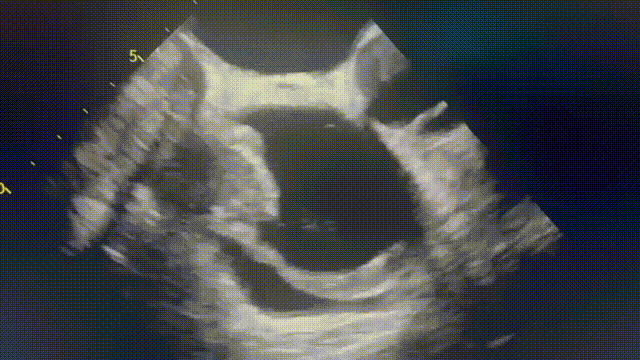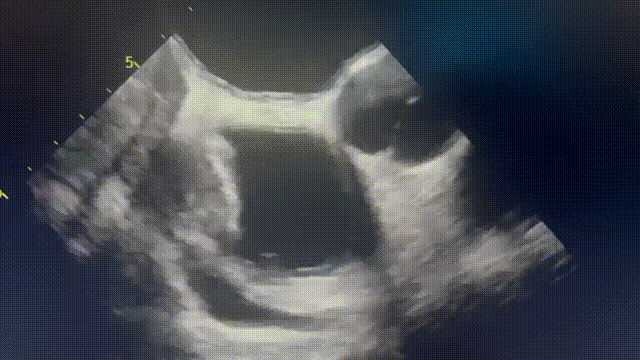
行胸部、腹部和骨盆CT,显示右心房外侧壁有一个可疑病变(图2A),经食管超声心动图也证实了这一处病变(图2B和视频1)。PET-CT显示右心房肿块有FDG强摄取,无转移灶。由于肿块较小,经皮心内活检被认为检出率低,因此计划进行手术切除活检,患者拒绝,心包引流后出院。
患者仍旧未按时进行随访复查,但其后再次被迫入院。心脏磁共振(CMR)显示肿块增大至6cm×3cm, T2呈高信号, T1呈等信号,在首过灌注和延迟钆图像上有一些增强(图2C、D)。影像学提示恶性原发性心脏或心包肿瘤。
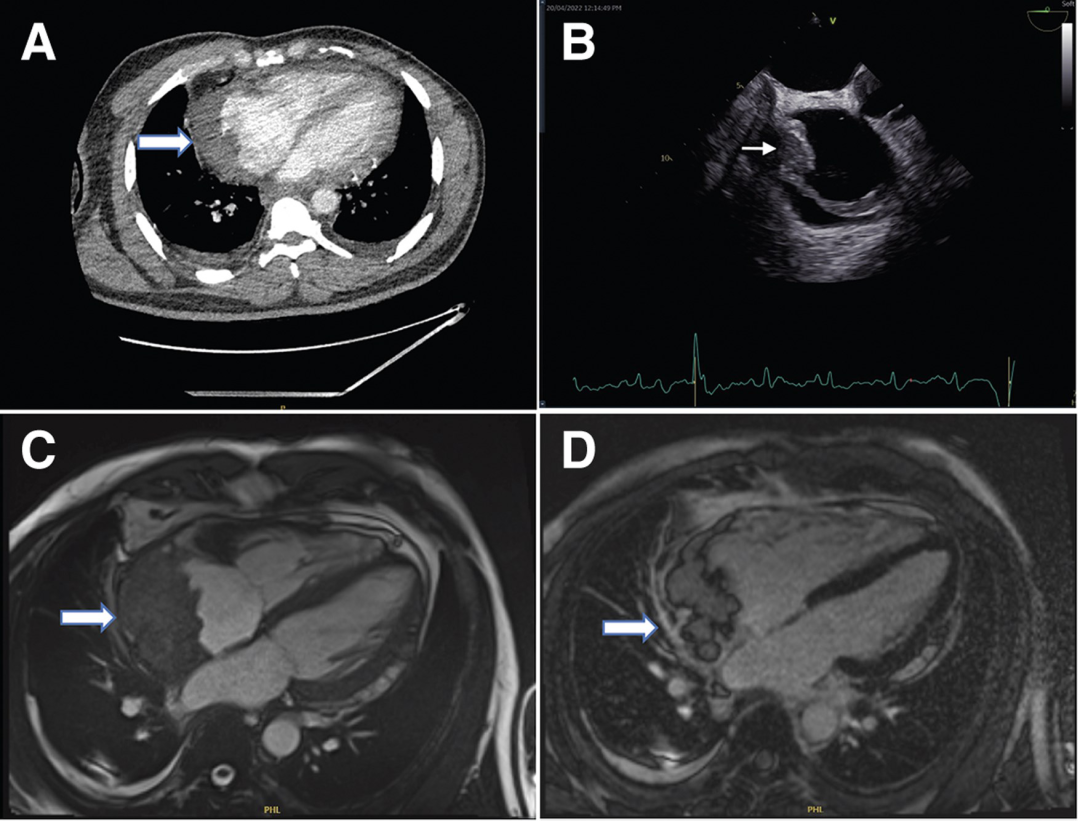
图2
(A)胸部增强CT显示右心房外侧壁有充盈缺损。(B)经食管超声心动图也证实了这一处病变(箭头)。(C)心脏磁共振四腔balanced SFPP电影序列显示一个6×3cm的大肿块,边缘不规则,似乎起源于心包并压迫右心房。(D)四腔延迟钆增强序列显示肿块不均匀增强,无心肌延迟钆增强。
此次入院后进行了右入路胸腔镜心包活检。病理检查显示恶性双相性间皮瘤(恶性双相间皮瘤(malignant biphasic mesothelioma),也称为混合性间皮瘤,是一种罕见的恶性肿瘤),包含上皮样和梭形细胞,主要表达间皮标记物,(图3A)。
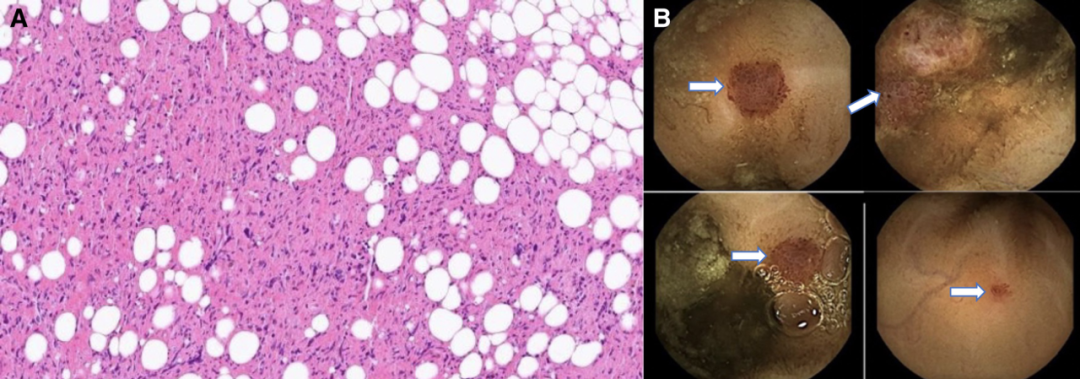
图 3
(A) 组织病理学显示上皮样细胞和梭形细胞增殖。(B) 小肠胶囊内镜检查显示多个红斑片状病变和一个大的红斑息肉样病变。
随后,患者还因反复出现的缺铁性贫血接受了食管胃十二指肠镜检查(OGD)。OGD显示一个小的幽门前溃疡。结肠镜检查未发现异常。
由于结果不明确,患者接受了胶囊内镜检查。小肠内有多个小的红斑片状病变和一个大的红斑息肉样病变,含有丰富的血管,不像是血管发育异常(图3B)。可能的鉴别诊断包括肠道转移、类癌或Kaposi肉瘤。患者HIV检测为阴性,进一步的心包活检人类疱疹病毒8型(HHV-8)也为阴性,因此不太可能出现Kaposi。
患者因肿瘤的压迫效应,发展为心房颤动以及肾脏并发症和严重贫血。在确诊4个月后死亡。
病例2
患者男性, 43岁白人,有哮喘和近期COVID-19疫苗接种史,出现3周的咳嗽和呼吸困难。入院时体温39.1°C,感染标志物升高(白细胞计数17.8×109/L,CRP 185 mg/L)。心电图示窦性心动过速,胸部X光显示心脏轮廓增大。
最初被诊断为社区获得性肺炎,但抗生素治疗后症状持续。血培养阴性,全身CT证实心包后间隙有大量心包积液(图4A、B)。
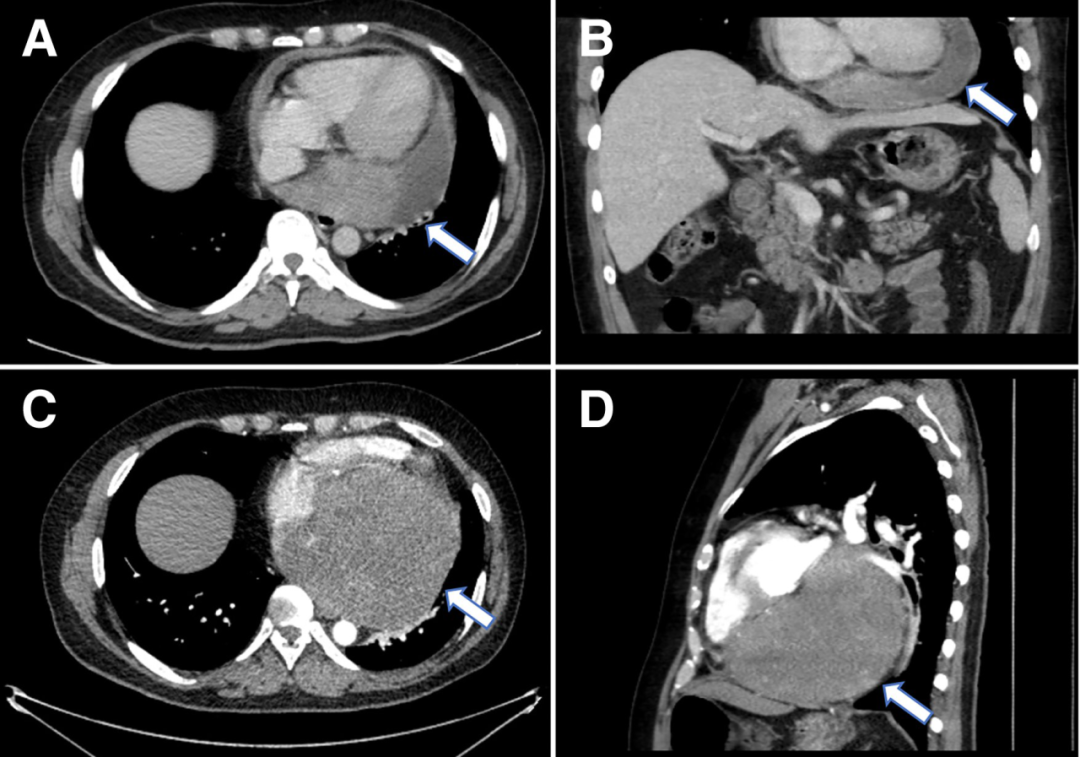
图 4
(A, B) 增强CT显示心包积液主要积聚在心包后间隙,最大深度为 4.5 cm。(C、D) 复查增强CT显示压迫左心房和左心室的心包病变显著增大。
超声心动图显示心脏左侧后方有4cm深的心包积液。使用秋水仙碱和抗生素治疗无效。尝试经胸腔镜心包开窗术,但由于致密粘连而失败。
8个月内的连续超声心动图随访显示积液逐渐增加,导致心房被压迫和二尖瓣反流。10个月时复查增强CT显示心包后肿块增大,压迫左心房和左心室(图4C、D)。
CMR显示心包内有一个14cm×10cm的占位, T1抑脂序列信号强度增加, T2序列信号强度增加,有一些早期和晚期钆增强。组织特征提示为肉瘤(图5A、B)。尝试超声引导下活检,但由于肿块位置而放弃,随后进行了CT引导下活检,但活检结果不明确。
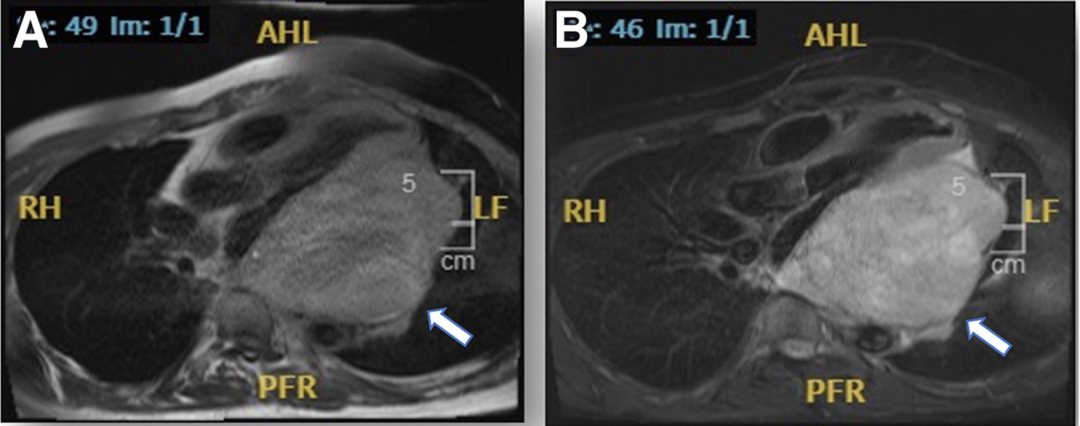
图 5
三腔视图CMR显示14 × 10 cm 椭圆形肿块,压迫左心房和右心房下腔静脉入口,显示T1加权快速自旋回波抑脂序列信号强度异质性增加(A)和T2加权快速自旋回波序列信号强度异质性增加(B)。
患者被推荐接受新辅助化疗,随后尝试通过左后外侧开胸进行肿瘤切除。然而,这个高度血管化、侵犯心肌的肿瘤使手术切除难以完成。活检确认为心包滑膜肉瘤。他接受了6个周期的化疗(多柔比星和异环磷酰胺),随访CT显示肿瘤略有缩小。
尽管接受了治疗,自就诊后24个月,患者最终还是死亡。
讨论
初始症状和临床表现对于确定心包积液的来源至关重要。心脏压塞而无炎症表现会使潜在恶性病变的可能性增加3倍。同样,有恶性肿瘤病史的患者出现潜在恶性病变的可能性是其他患者的20倍,而那些反复发作心包炎或对非甾体抗炎药无反应的患者出现肿瘤性病变的可能性是其他患者的10倍左右。
尽管石棉接触是其他类型间皮瘤的关键危险因素,但目前尚无强烈证据表明与心包间皮瘤的病因有关。滑膜肉瘤则与t(X;18)(p11;q11)染色体易位有关,主要影响年轻人的关节旁组织,起源于心包则非常罕见。
由于原发性心包恶性肿瘤的罕见性,生存数据仅限于病例系列和回顾性研究。2009年的一项研究报道了心包间皮瘤的中位生存期为6个月,这与我们的病例一致。另一项研究报道心包滑膜恶性肿瘤的中位生存期为27个月,与我们患者自就诊以来24个月的生存期一致。
在病例1中,尽管细胞学检查阴性,但由于心脏压塞,怀疑存在恶性病变。CT显示一个边界不清的肿块,心包活检确认为心包间皮瘤。这强调了在细胞学检查阴性时需要进一步检查和进行心包活检,因为这可以提高对罕见肿瘤的诊断敏感性。
单独使用细胞学检查的假阴性率在4%~14.7%之间。将细胞学检查与活检结合使用,可使对恶性病变的诊断敏感性提高约8%。至少需要60 mL心包引流液才能对恶性心包积液进行细胞学诊断,其敏感性可达91.7%~92.1%。
检出罕见肿瘤需要采用跨学科方法进行多模式成像、引流液分析、活检和病理学检查。上述病例展示了这些方法在区分良性肿瘤和恶性肿瘤方面的有效性,病理学分析是金标准。
肿瘤的快速、浸润性生长特性通常使完全手术切除变得不可行。对于滑膜肉瘤,与单一药物相比,联合使用异环磷酰胺和多柔比星的反应率为58.6%。尽管第二例患者症状有所改善,但肿瘤缩小幅度很小,因此无法进一步手术切除。
此外,随着 COVID 疫苗与心肌心包炎之间关联的增加,特别是在12~39岁男性中,临床医生很容易形成诊断偏见,认为一定会是心肌心包炎,从而忽视了需进一步排查心包肿瘤。如果症状持续或以更严重的方式出现,则需重新审视诊断是否全面了。