健心知著
2024.10.23
第415期

人工智能辅助定量冠状动脉斑块联合血流动力学分析可增强ACS罪犯病变的可预测性

刘健、马铭潞、苏晓凤
北京大学人民医院
健心荐语
急性冠脉综合征(ACS)目前仍是全球死亡的主要原因,在致死性冠状动脉事件或严重阻塞性冠状动脉狭窄发生之前的早期诊断阶段,我们需要对未来ACS事件风险进行评估。导致ACS的动脉粥样硬化性冠状动脉病变的生物力学基础包括斑块成分与斑块周围血流动力学环境之间的复杂相互作用。因此,结合斑块和血流动力学分析可以增强对ACS风险特征的识别。尽管如此,斑块和血流力学分析一直依赖于操作者,基于人工智能(AI)的定量分析的综合风险模型尚未完全建立。
文章介绍
本研究旨在基于人工智能分析确定预测ACS的斑块和血流动力学特征,研究它们对狭窄严重程度和不良斑块特征(APC)的附加价值,并探索它们对选择适当治疗策略的潜在影响。本文于2024年9月发表于JACC: Cardiovascular Imaging杂志。
研究方法
本研究纳入了在ACS事件发生前1个月至3年接受过冠状动脉CT血管造影(CTA)检查的ACS患者,根据有创冠状动脉造影确定冠状动脉CTA中的罪犯病变和非罪犯病变。主要终点是ACS罪犯病变风险模型的可预测性。参考模型包括冠状动脉疾病报告和数据系统(CAD-RADS)以及高危斑块(定义为具有≥2个不良斑块特征的病变)。新的预测模型是在参考模型上加入人工智能辅助的定量冠状动脉斑块和血流动力学分析(AI-QCPHA)特征。并在验证队列中评估模型性能。
研究结果
351例患者(年龄范围65.9±11.7岁)中有2088个非罪犯病变和363个罪犯病变,接受冠状动脉CTA检查到发生ACS事件的中位时间间隔为375 d (Q1-Q3:95-645 d),其中223例(63.5%)患者发生了心肌梗死。在推导队列(n=243)中,最佳AI-QCPHA特征是病变的血流储备分数、斑块负荷、总斑块体积、低衰减斑块体积和平均总心肌血流量百分比。在验证队列(n=108)中,加入AI-QCPHA特征后的新预测模型比参考模型的可预测性更高(AUC:0.84 vs 0.78;P < 0.001)。AI-QCPHA特征在不同时间点对ACS的风险预测具有一致的增强效果。
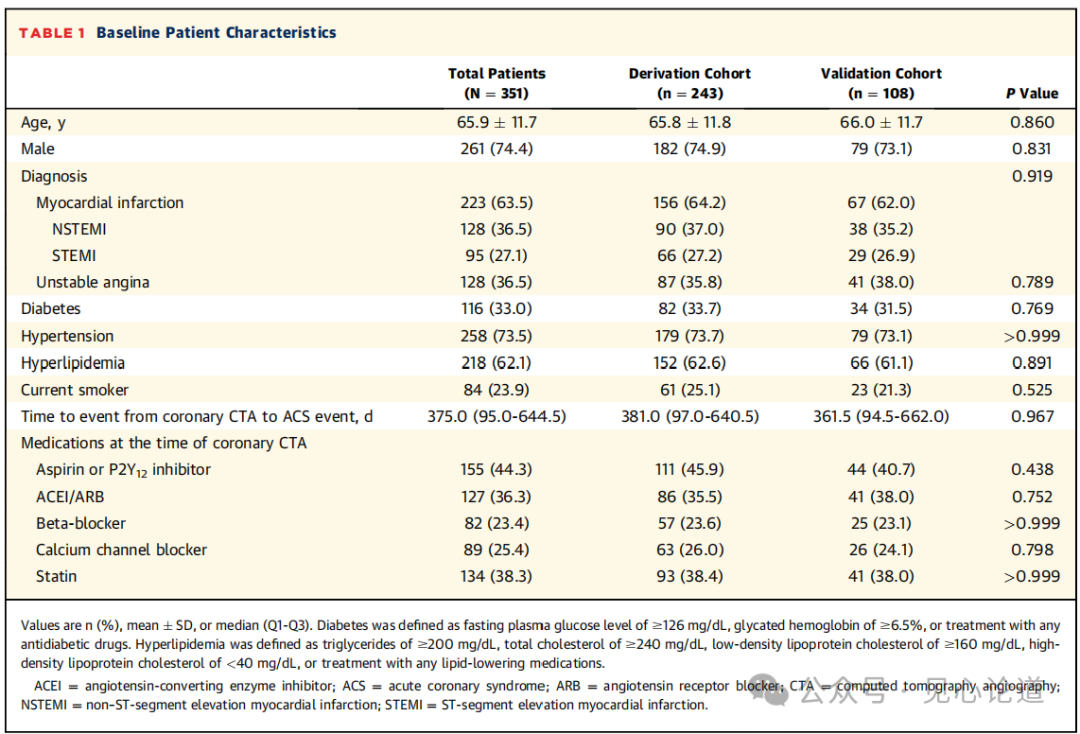
表1:基线患者特征
患者平均年龄为 65.9 ± 11.7 岁,其中 74.4% 的患者为男性。从接受冠状动脉 CTA 检查到发生 ACS 的中位事件时间为 375天 (Q1-Q3: 95.0-644.5),其中223 例患者 (63.5%) 发生了 MI。总体患者特征在推导队列和验证队列之间保持良好平衡。
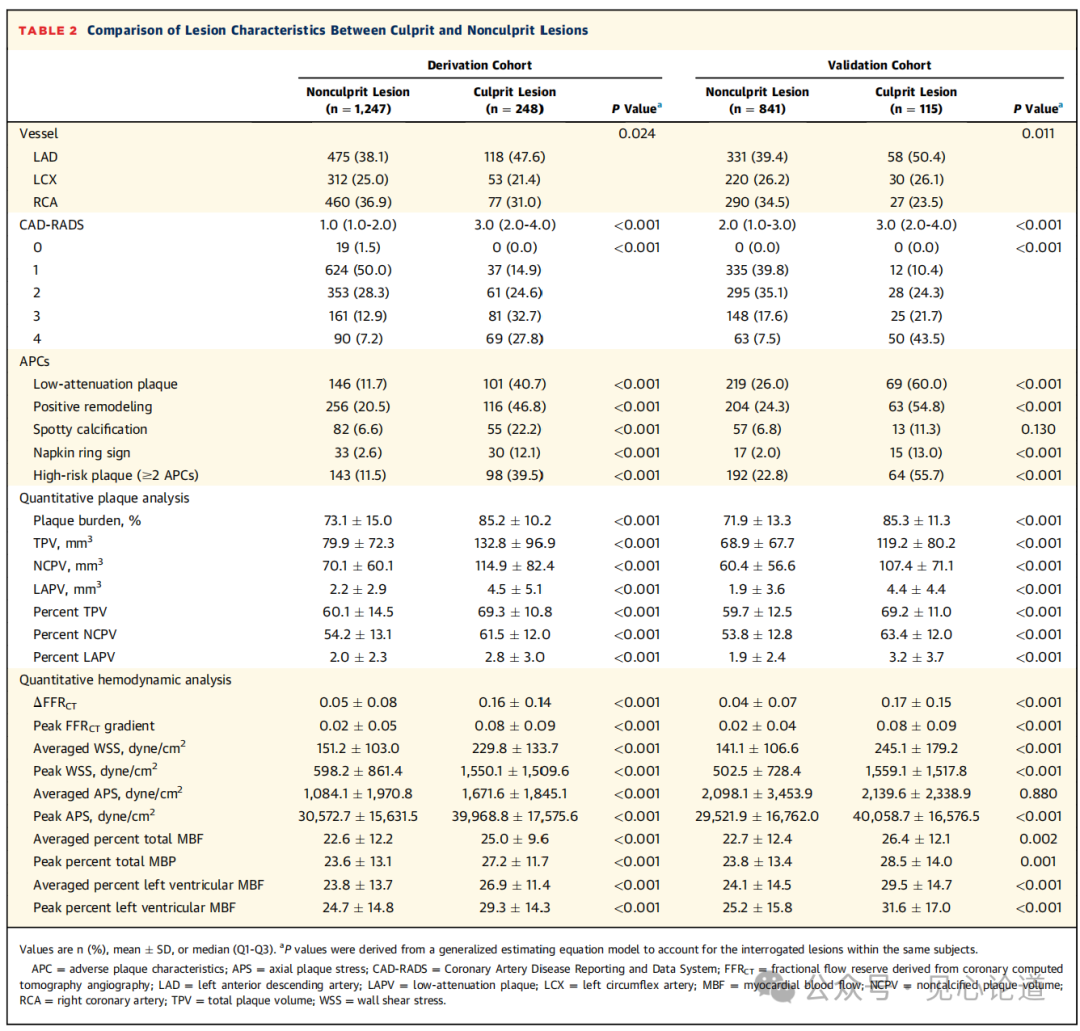
表2:罪犯病变与非犯罪病变的特征比较
在推导队列中,与非罪犯病变相比,罪犯病变具有更高的CAD-RADS(3.0[Q1-Q3:2.0-4.0]比1.0[Q1-Q3:1.0-2.0];P<0.001)和更高的高风险斑块(HRP)比例(39.5%比11.5%;P<0.001)。在AI-QCPHA中,相对于相应的血管体积,罪犯病变显示出更大的斑块负荷、总斑块体积(TPV)、非钙化斑块体积(NCPV)、低衰减板块(LAPV)和归一化体积(P<0.001)。所有血流动力学参数,包括ΔFFRCT、峰值FFRCT梯度、壁剪切应力(WSS)、轴向斑块应力(APS)、总心肌血流量百分比和左心室心肌血流量百分比,在罪犯病变中也高于非罪犯病变。这些结果在验证队列中相似。
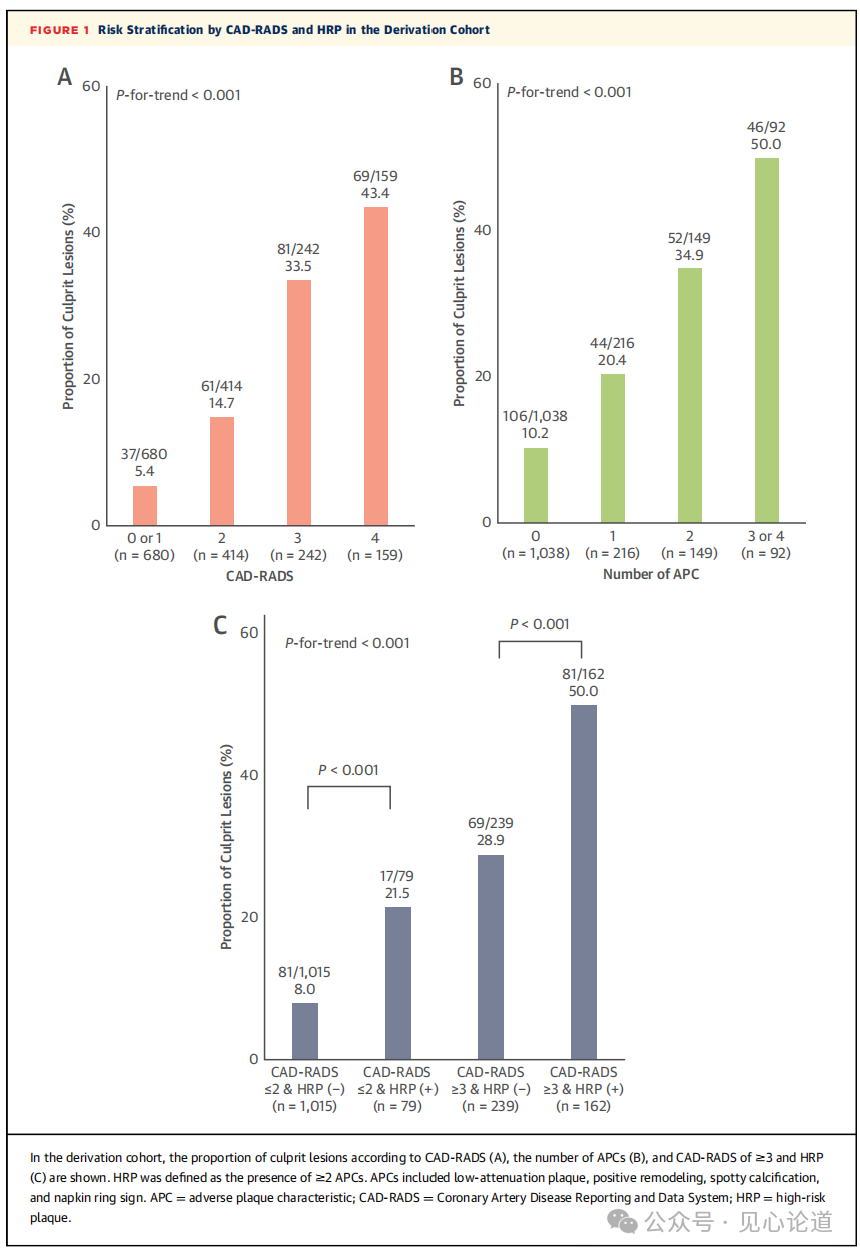
图1:CAD-RADS和HRP在模型推导队列中的风险分层
在推导队列中,罪犯病变的比例随着CAD-RADS的增加(CAD-RADS中0或1、2、3和4分别为5.4%、14.7%、33.%和43.4%;趋势P<0.001)或APC数量的增加(0、1、2和≥3个APC分别为10.2%、20.4%、34.9%和50.0%;趋势P<0.001)而显著增加。在CADS-RADS≤2(21.5%对8.0;P<0.001)或CAD-RADS≥3(50.0%对28.9%;P<0.001)的病变中,HRP病变的罪犯病变比例高于无HRP病变。
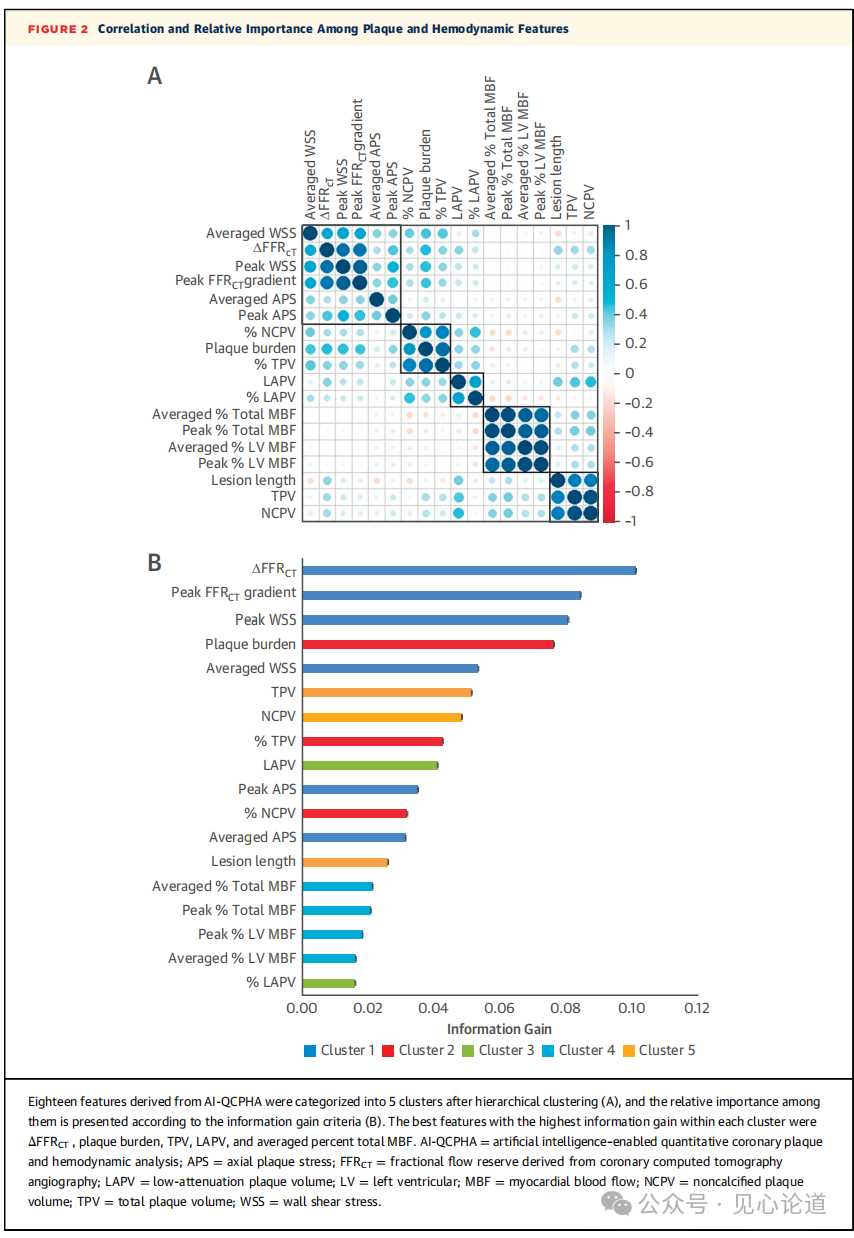
图2:斑块和血流动力学特征的相关性和相对重要性
图2展示了推导队列中AI-QCPHA的18个特征的协方差矩阵。分层聚类显示5个聚类,主要代表血流动力学、相对斑块负荷、富含脂质的斑块体积、心肌区域和斑块绝对数量。每个集群的最佳特征是ΔFFRCT、斑块负荷、TPV、LAPV和平均总MBF百分比。
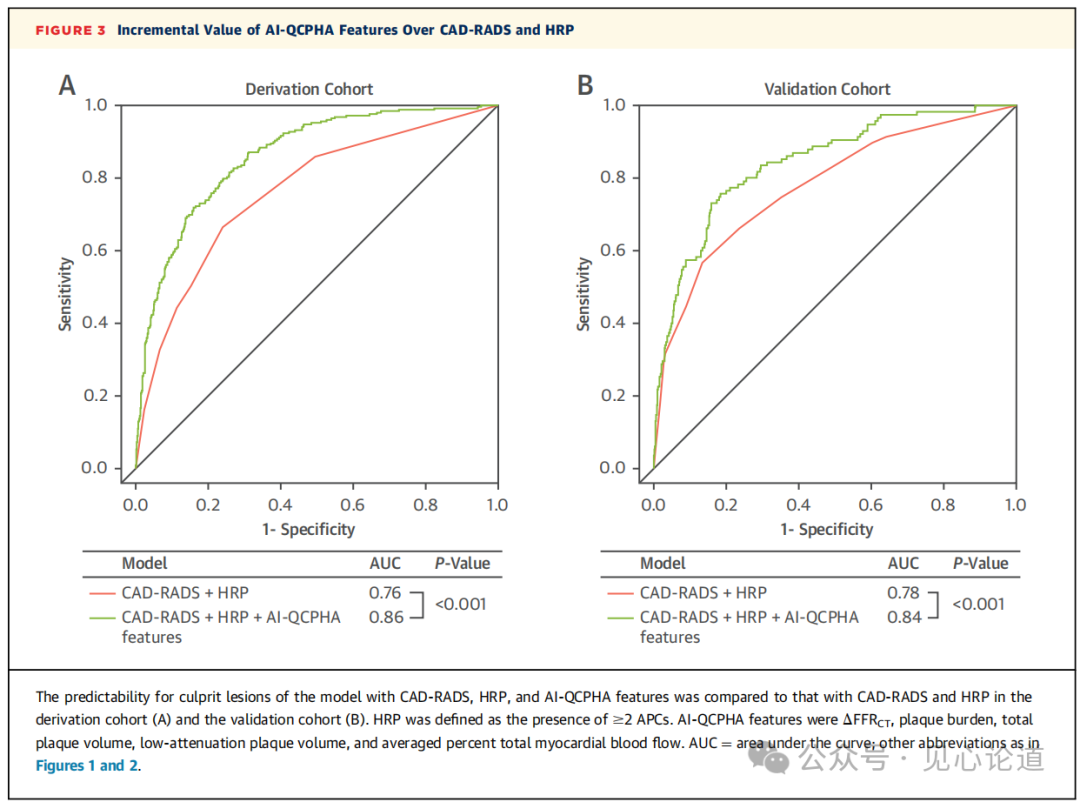
图3:AI-QCPHA特征相对于CAD-RADS和HRP的增量值
上述5个AI-QCPHA特征为推导队列中CAD-RADS和HRP的罪犯病变提供了额外的诊断性能(AUC:0.86 vs 0.76;P<0.001)。验证队列中证明了上述5个AI-QCPHA特征的附加作用(AUC:0.84 vs 0.78;P<0.001)。
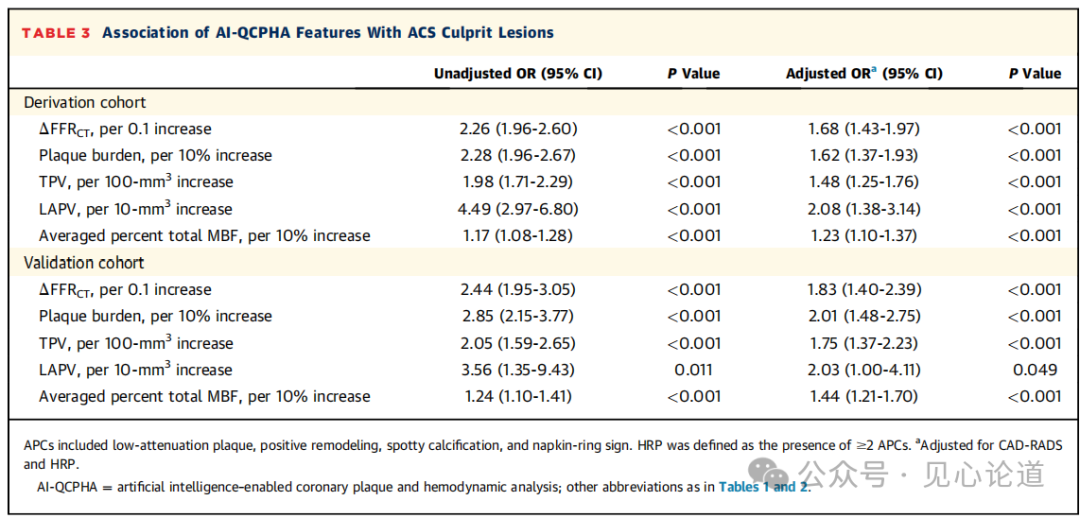
表3:AI-QCPHA特征与ACS罪犯病变的关系
在推导和验证队列中,所有5个AI-QCPHA特征都与独立于 CAD-RADS 和 APC 的罪犯病变风险较高相关。
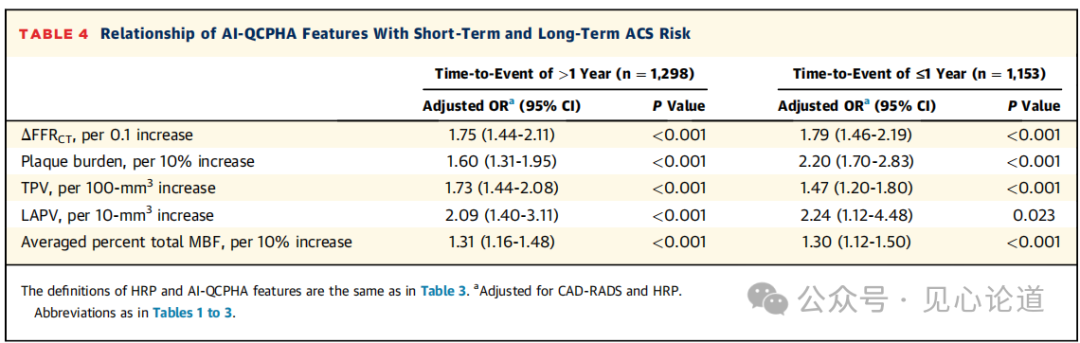
表4:AI-QCPHA特征与近期和远期ACS风险的关系
当根据接受冠脉CTA检查与事件发生时间间隔(1年)探索AI-QCPHA特征与罪犯病变风险的关系时,结果示无论时间间隔是否大于1年,ΔFFRCT、斑块负荷、TPV、LAPV和平均总MBF百分比的增加均与罪犯病变的较高风险显著相关。
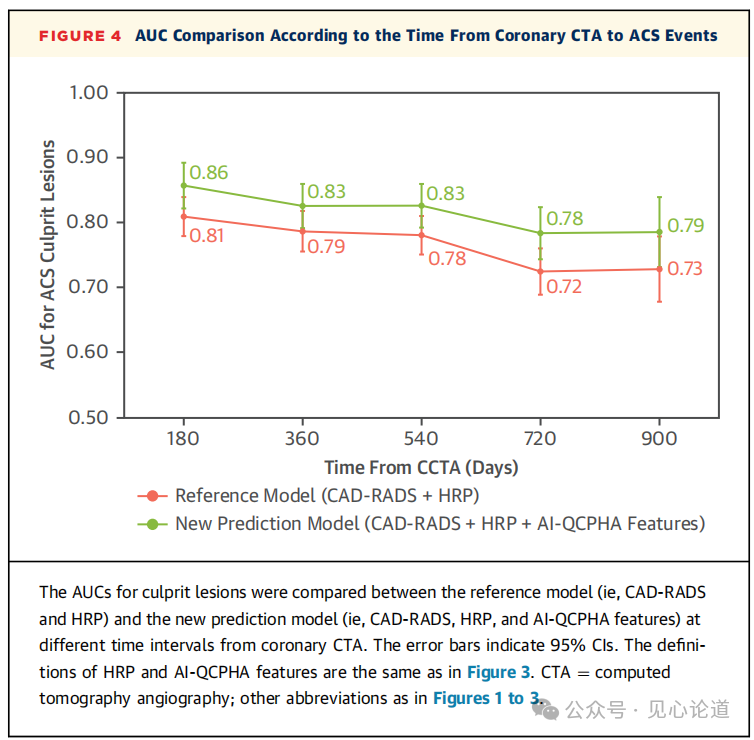
图4:冠脉CTA与ACS发生时间的AUC比较
当在不同时间点检查参考模型(即CAD-RADS + HRP)和新预测模型(CAD-RADS + HRP + AI-QCPHA特征)的可预测性时,无论事件发生的时间如何,新预测模型始终具有比参考模型更高的预测性,即使这两个模型在预测长期事件时的整体可预测性都有下降的趋势。
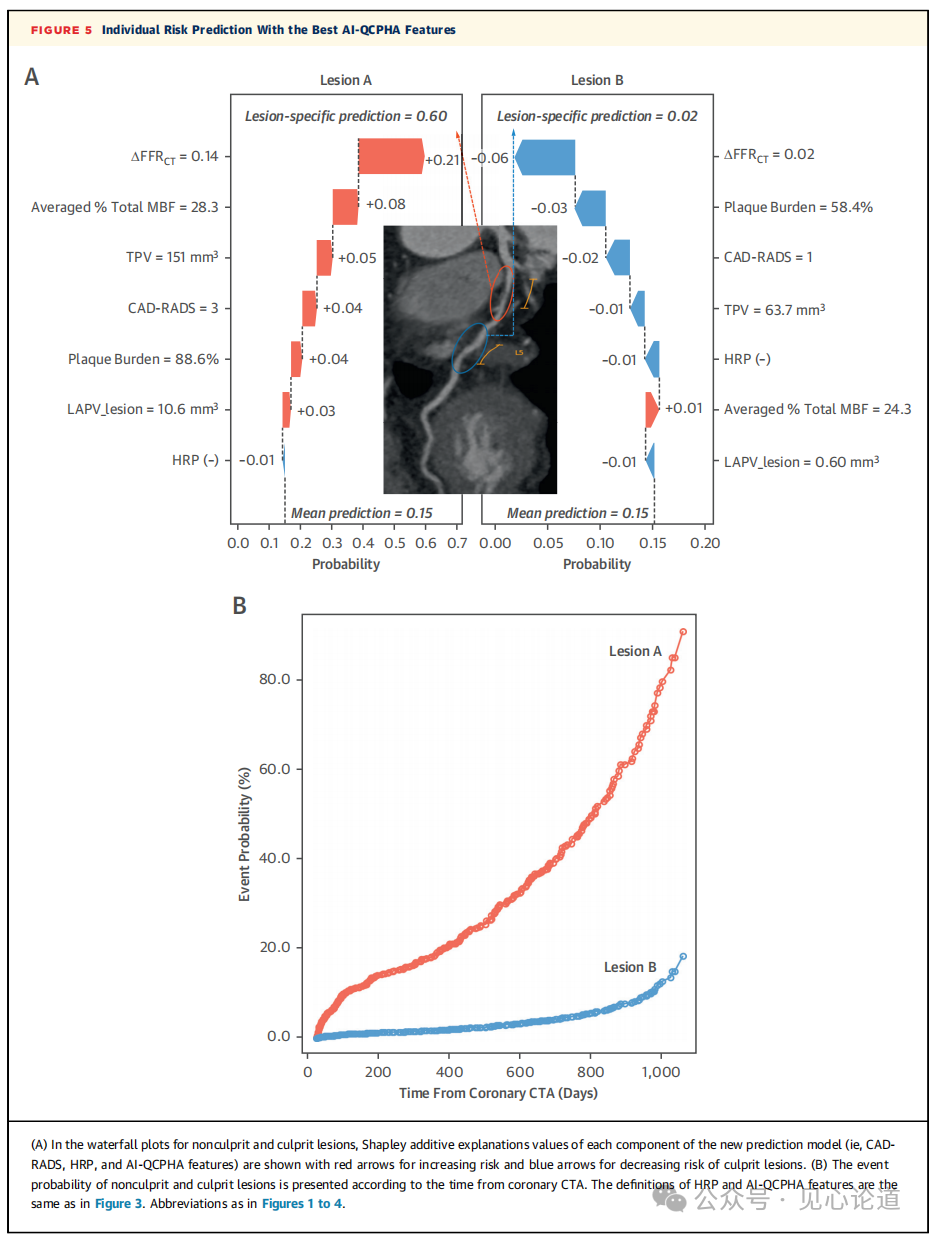
图5:基于最佳AI-QCPHA特征的个体风险预测
图5描绘了一个典型案例,说明了在将病变分类为罪犯病变或非罪犯病变时,新预测模型的每个组成部分是如何对预测结果做出贡献的。在本病例的罪犯病变中,ΔFFRCT 在评估病变是 ACS 罪犯病变时提供了最高的增量(图5A)。图5B根据接受冠状动脉CTA的时间间隔,呈现了非罪犯和罪犯病变的事件概率。
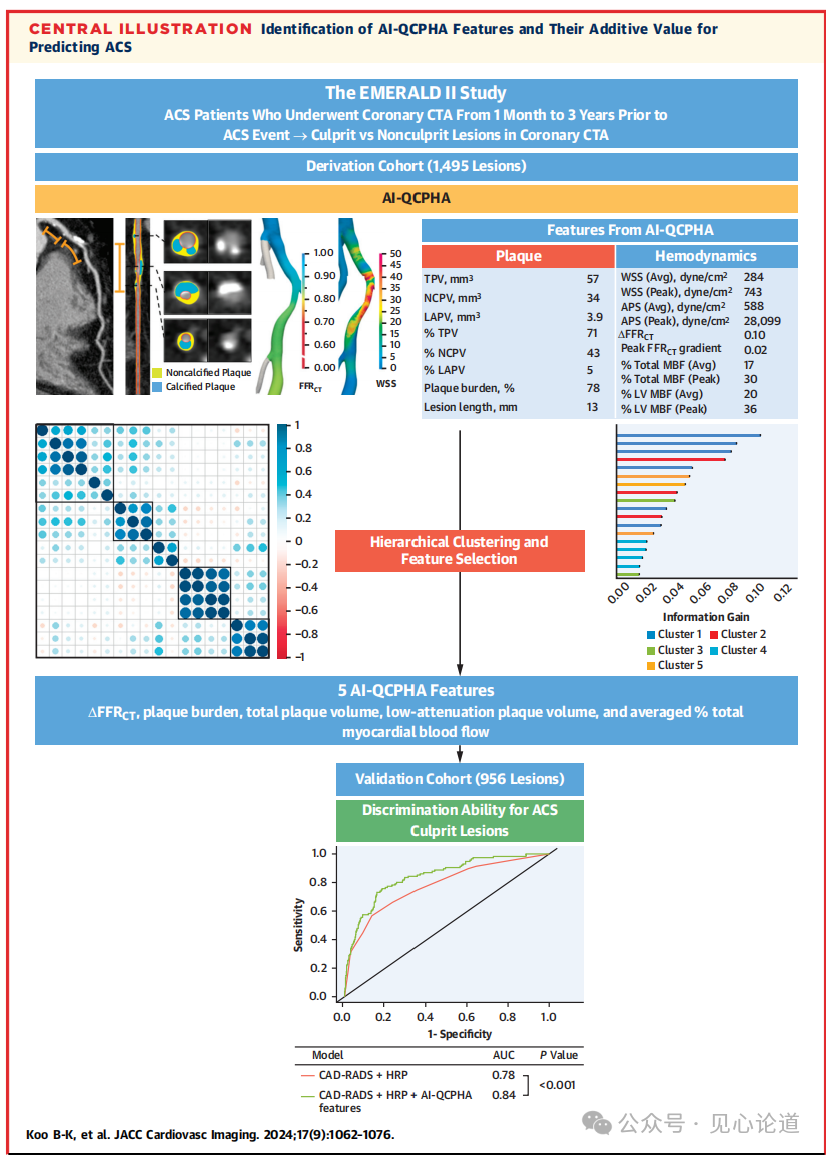
中央插图:AI-QCPHA特征的识别及其预测ACS的附加价值
结 论
与传统冠状动脉CTA分析相比,人工智能辅助定量冠状动脉斑块联合血流动力学分析增强了ACS罪犯病变的可预测性。
讨论
冠状动脉CTA是诊断冠状动脉疾病的重要方法,可发现与心脏病风险相关的血管狭窄和斑块特征。但过去的分析方法复杂,依赖专家经验,限制了它们的广泛应用。本研究通过加入AI技术,提高了预测急性冠状动脉综合征的能力,使风险评估更准确、高效。本研究有几个局限性。首先,本研究为回顾性研究。其次,对照组仅有自身对照,缺乏ACS患者间的对比。第三,虽然推导队列的风险模型在独立验证队列中进行了验证,但缺乏外部验证队列。第四,冠状动脉CTA和ACS事件之间的患者水平因素,包括血糖、血脂、生活方式改变和用药史等,未被纳入研究。尽管该研究存在一些局限性,但其发现为未来的研究和临床实践提供了有价值的信息。