
2024年,由美国心脏协会(AHA)、美国心脏病学会(ACC)等机构联合发布的《非心脏手术围术期心血管管理指南》为全球临床医生提供了非心脏手术 (NCS) 患者心血管管理的最新临床指导。新版指南包含基于 2014 年围手术期指南的最新循证建议,内容更加全面和详尽,针对非心脏手术围术期心血管管理中的关键问题,提供了更为细致的决策指导。
为了使中国的心血管医生能够更便捷地接触和理解国际前沿的医疗标准,北京积水潭医院刘巍教授团队投入巨大精力,对这份重要指南进行了全文翻译,并展开了深入解读。这项工作的意义重大,现计划通过连续的系列发布,使得国际先进的心血管管理理念和实践经验更好在中国落地生根,为我国心血管疾病患者的健康保驾护航。

目录
9. 围术期心肌损伤与梗死的监测与管理
9.1 非心脏手术后心肌损伤的监测与管理
9.2 心肌梗死的术后管理
10. 特殊人群
10.1 肝肾移植前的术前评估
10.2 肥胖与减肥手术
11. 成本效益考虑
11.1 生物标志物的成本效益考虑
11.2 12导联心电图的成本效益考虑
11.3 冠状动脉CT血管造影的成本效益考虑
11.4 负荷试验的成本效益考虑
12. 证据空白与未来研究方向
9. 围术期监测和管理心肌损伤及心肌梗死
9.1. 非心脏手术后的心肌损伤(MINS)监测和管理
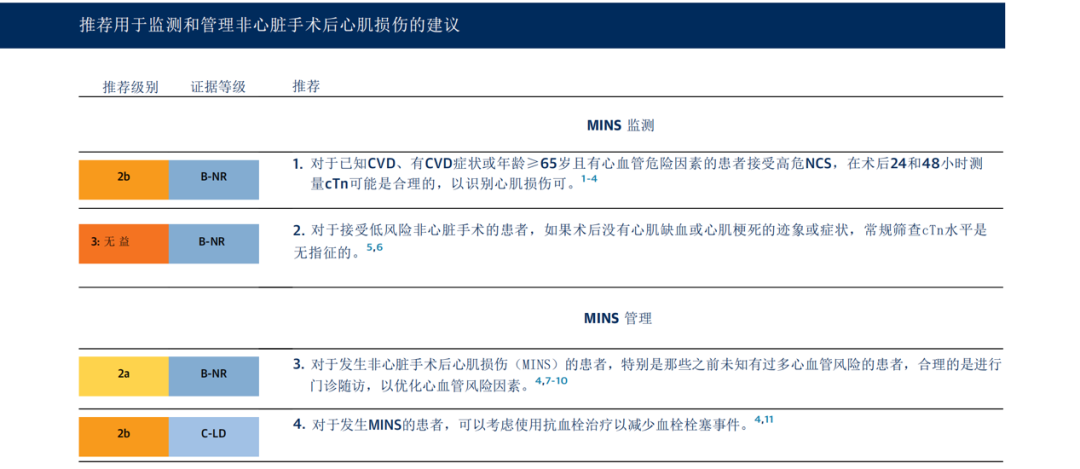
概述
在接受NCS的患者中,约有20%的患者发生围手术期心肌损伤,其临床表现从无症状心肌损伤到明显的术后心肌梗死,后者定义为缺血症状或心电图(ECG)变化、病理性Q波,或影像学显示存活心肌的丧失或丢失(见图6)【1,4,12-14】。术后心肌损伤(MINS)包括1型和2型心肌梗死,以及无症状的心肌损伤,因为手术患者可能由于麻醉、镇痛或手术部位疼痛的干扰而无法报告症状【4,14】,MINS的诊断需要假定缺血原因(不包括肺栓塞、中风和败血症等非缺血性病因)引起的cTn升高>1倍(>99%的参考上限),并与不良的短期和长期预后有关。【1,12,14-17】。MINS的30天死亡率很高(约10%)【9】,死亡风险与最高cTn水平成正比(最高四分位组为17%,最低四分位组为1%)【15】,且MINS对30天术后死亡率的人群归因风险为34%【1,16】。即使在80%-90%的无缺血症状或体征的MINS患者中,30天的死亡率仍然显著【1,4,14】。MINS的预测因素包括心血管危险因素及疾病、肾脏疾病和紧急或急诊手术【9,16,17】。尽管MINS的机制可能是多样的,但大多数情况下推测为动脉粥样硬化性冠心病(CAD)所致,因此对MINS患者进行药物治疗可能有助于减轻术后心血管风险。有关更多详细信息,请参阅AHA科学声明《非心脏手术后心肌损伤患者的诊断与管理》【12】。
推荐依据的支持性文本
1.在已知心血管疾病(CVD)、心血管危险因素及接受高风险手术的患者中,进行术后肌钙蛋白(cTn)监测以识别高风险患者可能是合理的【14】。在一项前瞻性队列研究中,纳入了21842名≥45岁患者进行非心脏手术后的高敏肌钙蛋白T(hs-cTnT)监测。无缺血特征的术后cTn升高与30天死亡风险增加3倍独立相关,而伴随缺血特征的术后cTn升高则与30天死亡风险增加5倍相关(相对于无MINS的患者)【1】【15】。第四次《心肌梗死全球通用定义》和近期AHA的科学声明均建议对高风险患者进行术后连续cTn监测,以便及时发现MINS【12】【13】【18】。为正确解读术后cTn的升高,基线术前值或术后连续监测结果是有用的,可以帮助判断心肌损伤是急性还是慢性。根据实际情况,可以使用常规的第四代或高敏cTn试剂进行围术期监测。虽然cTn监测能有效识别心脏事件风险>20%的患者,但对于MINS患者的最佳管理策略仍不明确,需要进一步研究【19】。在已确诊动脉粥样硬化性心血管疾病(ASCVD)且正在接受最优GDMT(指南指导药物治疗)治疗的高风险患者中,目前尚不清楚MINS的诊断是否会改变临床管理。因此,制定明确的管理策略以指导术后cTn监测是迫切需要的。
2.目前尚无足够数据支持在低风险人群中进行术后肌钙蛋白监测【5】【6】。由于围术期心血管事件的发生概率较低,在无症状且接受低风险非心脏手术的患者中进行术后cTn监测可能无法识别心肌损伤或提供临床获益。因此,不应在低风险人群中常规进行cTn监测。
3.尽管尚不清楚如何在MINS患者中有效减少不良心血管事件,但其预后影响显著。术后肌钙蛋白浓度升高一致显示手术患者短期及长期死亡风险增加。一项单中心研究纳入了约5000名患者,发现接受心脏科会诊或转诊至心脏科的MINS患者在前30天的死亡率较低【7】。另一项研究显示,在确诊MINS后尽早进行心脏科会诊与早期死亡风险显著降低相关【8】。在手术过程中,患者应被告知其MINS的诊断。对于MINS的最佳药物治疗仍不确定。在一项小规模的MINS患者观察研究中,加强心血管药物治疗与1年主要不良心血管事件(MACE)发生率降低相关【20】。在推测患有CAD的MINS患者使用抗血小板药物及他汀类药物的证据仅来自观察性队列研究。一项对POISE试验的事后分析表明,在围术期MI患者中,阿司匹林和他汀类药物的使用与30天死亡率的降低相关【9】。在另一项观察研究中(n=5109),术后使用他汀类药物与1年死亡率降低相关【10】。在非手术CVD患者及自发性MI患者中,他汀类药物在MINS中的作用可通过相关试验进行推测【21】【22】。在一项前瞻性研究中,少于三分之一的MINS患者进行了GDMT强化治疗【14】。制定MINS的最佳药物治疗策略是当前亟待解决的证据缺口。
4.术后使用直接口服抗凝药(DOACs)可能降低长期心血管事件风险。唯一一项针对MINS进行药物治疗的RCT——MANAGE(非心脏手术后心肌损伤管理)试验,随机将1754例术后患者在MINS的35天内随机分配给达比加群110 mg抗凝治疗,每日2次,与安慰剂对照。该研究显示,达比加群显著降低了主要血管事件的复合终点,未增加严重出血风险,但与轻微及胃肠道出血风险增加相关。此外,近一半的患者在试验结束前中断了试验药物使用,且由于入组进展缓慢及样本量减少,主要终点在事后被调整。在一项针对MINS患者的倾向匹配回顾性观察分析中,出院时使用抗血小板治疗与1年死亡率降低相关【11】。由于术前血小板及凝血相关基因的高表达已被确定为后续MINS的危险因素,因此存在使用抗血栓药物的合理机制假设【23】。需要进一步的研究来了解MINS的病理生理机制,并确认术后抗血栓治疗在这些患者中的作用。
9.2.心肌梗死的术后管理

概述
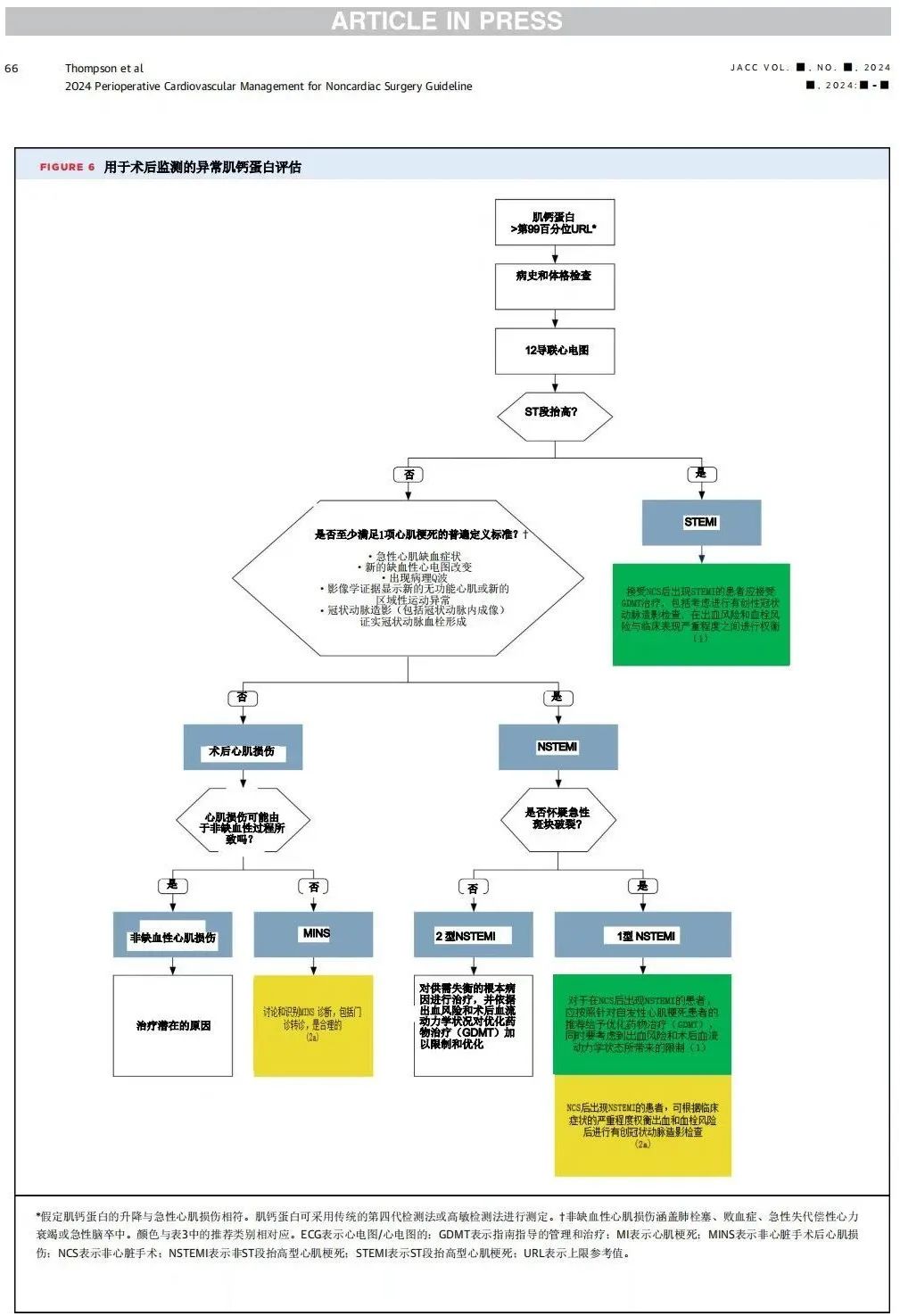
围术期的心肌梗死(MI)发生率根据定义、患者危险因素和手术类型的不同,范围从0.9%到15%不等【2】【4-8】。非心脏手术(NCS)后的围术期MI患者由于供需失衡更可能表现为2型MI而非1型MI(例如急性斑块破裂)【1】【9】【10】。在围术期,由于镇静和镇痛会限制患者的症状,识别MI可能会更加困难【11】。围术期STEMI和NSTEMI患者的死亡风险很高,约有三分之一的患者会出现30天内死亡或再住院【4】【6】【11-16】。死亡的危险因素包括cTn浓度峰值、出血事件和外周动脉疾病【13】。理想情况下,围术期1型MI的管理应包括自发性MI患者【由动脉粥样硬化性心血管疾病(ASCVD)引起】的推荐药物治疗。在怀疑2型MI的患者中,应针对引起供需失衡的潜在原因进行治疗(例如高血压、低血压、心动过速、贫血)。由于非缺血性病因(如心力衰竭、败血症或肺栓塞)也可能导致心肌肌钙蛋白(cTn)升高,因此需要鉴别诊断。如果怀疑急性冠状动脉闭塞,需要先评估个体化风险分层,再考虑进行冠状动脉造影(ICA)。进行风险分层时应考虑残余出血风险、手术类型及手术时间等因素的影响。有关术后心肌损伤或MI患者的诊断及管理的算法,请参见图6。
推荐依据的支持性文本
1.由急性斑块破裂引起的围术期STEMI患者只占围术期MI患者的少数,但住院死亡率高达30%至35%【1】【2】【11】。围术期STEMI患者应立即启动指南规定的药物治疗(GDMT),并评估术后风险,包括出血和低血压。应强烈考虑行紧急冠状动脉造影(ICA),并根据临床表现的严重程度评估出血、血栓风险及临床表现的严重程度。围术期STEMI患者的管理决策应由包括外科医生、麻醉师和心脏科医生在内的多学科团队协作进行。
2.围术期NSTEMI患者应按照未进行手术的自发性MI患者GDMT建议进行治疗。在某些情况下,GDMT需要根据血流动力学状态和出血风险进行调整。药物治疗应包括至少一种抗血小板药物,前提是其获益可以大于出血风险,并应结合高强度的他汀类药物治疗。如果患者的血流动力学状态允许,可以考虑使用β受体阻滞剂、ACEI和硝酸酯类药物,以缓解心绞痛症状并降低长期心血管风险。
3.对于围术期NSTEMI患者,某些情况下可以考虑进行冠状动脉造影(ICA)。在回顾性观察分析中,与保守治疗相比,MI的侵入性治疗可以降低住院死亡率【2】。然而,鉴于PCI后可能需要全身抗凝和长期抗血小板治疗,应综合考虑术后残余出血风险、手术类型及手术时间,再决定是否行侵入性治疗。此外还应考虑临床表现的严重程度、cTn浓度峰值、缺血性心电图变化及患者的其他特异性因素【3】。GDMT治疗后症状持续存在、不稳定的血流动力学状态、持续的生物标志物升高或影像学提示新发局灶性室壁运动异常或心室功能下降的患者,可能在围术期紧急ICA后获益最大。对于未进行手术的MI患者,是否进行侵入性治疗,应由包括外科医生、麻醉师和心脏科医生在内的多学科团队共同决定。
10. 特殊人群
10.1. 肝肾移植前的术前评估
概述
终末期肾病或肝病患者的心血管危险因素和冠状动脉疾病(CAD)的患病率高于一般人群【1-6】,且更容易面临心力衰竭(HF)和肺动脉高压(PH)等其他心血管疾病的风险【7】。最近研究表明,在肾移植术前的冠心病筛查与常规术前的冠心病筛查相比,术后结局相似。美国肾脏数据系统(U.S. Renal Data System)和医疗保险(Medicare)索赔数据表明,肾移植术前一年,进行更多的侵入性或非侵入性CAD筛查,也不会降低术后30天死亡率或急性心肌梗死(MI)的发生率【8】。在ISCHEMIA-CKD(国际慢性肾病患者医疗及侵入性方法对比效果研究)试验中,纳入了非手术的晚期慢性肾病(CKD)、冠状动脉复合病变(CCD)及运动负荷试验中表现为中至重度缺血的成年患者。试验结果显示,与仅有初步药物治疗的患者相比,初步的侵入性治疗(冠状动脉造影)和血运重建联合药物治疗,在中位随访2.2年时,未能降低死亡或MI的风险【9】。2022年美国心脏协会(AHA)发布的科学声明《肾移植及肝移植患者术前冠心病筛查的最新证据》【1】总结了最新数据,并定义了肾移植及肝移植患者术前冠心病筛查及管理的方法。
10.2. 肥胖与减肥手术
概述
肥胖已成为全球性的流行病,影响超过三分之一的美国成年人口【1-3】。对于体重指数(BMI)≥35 kg/m²的患者,减肥手术是最有效且可以长期进行的减重干预方法,能够显著减轻体重,并改善或解决肥胖相关的疾病,例如2型糖尿病、高血压和血脂异常【4-6】。一项基于人群的回顾性队列研究(n=2638)显示,在中位4.6年随访期间,有心血管疾病(CVD)的肥胖患者进行减肥手术可以降低MACE发生率【7】。减肥手术的患者通常较年轻,可能意味着风险不高;然而,减肥手术并不是没有风险的。大型荟萃分析表明,减肥手术的围术期MI发生率为0.37%,全因死亡率为0.08%【7-9】。一项回顾性多中心研究(n=494,611)发现,在接受了Roux-en-Y胃旁路手术或胃袖状切除术的患者中【10】,既往有心脏病史的患者会增加围术期心脏骤停和30天死亡率风险。该研究还显示,胃袖状切除术的不良事件发生率低于Roux-en-Y胃旁路手术。另一项观察性研究揭示,在接受减肥手术的肥胖患者中,既往有ACS或HF病史会增加围术期心血管并发症风险【11】。因此,在术前评估中应格外关注既往病史和危险因素。越来越多的肥胖患者开始使用GLP-1受体激动剂减肥。关于这些药物在非心脏手术(NCS)前是否需要停药,在第7.8节《围术期血糖管理》已有说明。
11. 成本效益考虑
11.1. 成本效益考虑
健康经济学旨在评估使用医疗技术时产生的价值(如:成本与健康效益之间的关系)。在医疗时,技术使用与效益之间的关系是直接的;然而,在诊断检查时,这种关系是间接的,且取决于一定条件。因为诊断结果必须被临床医生采用才能产生价值【1】。诊断价值可能因患者的临床情况和手术风险的高低而显著不同。某些情况下,临床医生可以利用诊断检查的结果改善患者健康,在此情况下,价值由医疗检查成本与患者健康改善(即成本效益)之间的关系决定。而其他情况下,临床医生对检查结果的了解并未改善患者健康,那么不进行检查可能更有价值。最后,在某些情况下,诊断检验可能会对患者造成伤害(如:意外发现导致的额外检查,从而使患者面临额外风险或治疗延误),在这种情况下,不进行检查可能更有价值。因此,诊断检查的关键成本效益考虑因素包括:医疗检查的成本、检查环境,以及临床医生利用检查结果改善患者健康的程度。
11.1.1.生物标志物的成本效益考虑
B型利钠肽(BNP)和N末端B型利钠肽(NT-proBNP)
术前BNP或NT-proBNP水平可用于评估接受高风险非心脏手术(NCS)的已知心血管疾病(CVD)、有CVD症状或年龄≥65岁且具有心血管危险因素患者的围术期风险。然而,目前尚无研究表明BNP或NT-proBNP可以让临床医生改善患者预后并影响医疗成本【1】。因此,术前BNP或NT-proBNP在这些患者中的使用价值并不确定(即无法确定医疗成本与健康效益之间的关系)。同样,对于无CVD或心血管风险因素的患者,没有证据表明,计划进行低风险NCS时,术前检验BNP或NT-proBNP水平可以改善患者预后并影响医疗成本。除了可以直接节约成本外,不进行低价值的BNP或NT-proBNP检验还可消除后续的其他化验检查。
心肌肌钙蛋白(cTn)
术前cTn水平可用于评估接受高风险NCS的已知CVD、有CVD症状或年龄≥65岁且具有心血管危险因素患者的围术期风险。然而,目前尚无研究表明cTn可以被临床医生用于改善患者预后及影响医疗成本。因此,术前cTn检验在接受高风险NCS患者中的使用价值是不确定的(即无法确定医疗成本与健康效益之间的关系)。
11.1.2. 12导联心电图(ECG)的成本效益考虑
12导联心电图是一种低成本的诊断工具(2022年医疗保险报销价格为14.57美元),如果它能够适度改善患者健康,则被认为是具有成本效益的【1】。对于接受高风险NCS且有活动性CVD症状或MACE风险增加的患者,术前心电图可预测短期死亡率和MACE【2-6】。然而,心电图在这些情况下的价值取决于它是否增加了病史和体格检查之外的额外风险评估,以及临床医生是否能够利用心电图结果改善患者健康。一项针对2967名NCS患者的研究报告称,心电图并未在患者病史的危险因素基础上,提高术后死亡和MI的预测能力【4】。目前尚无研究表明心电图结果可以改善医生决策或改善患者长期临床预后和经济成本。因此,对于接受高风险NCS患者的术前心电图使用价值是不确定的(即无法确定医疗成本与健康效益之间的关系)。相反,有多项研究一致认为,在低风险患者接受低风险NCS时,术前常规进行心电图对患者预后的影响很小,不进行心电图可以节省成本【7-10】。此外,还可消除因附带检查而引发的后续治疗【11,12】。
11.1.3. 冠状动脉CT血管造影(CCTA)的成本效益考虑
虽然CCTA可评估心肌缺血的解剖学信息,但与功能性负荷试验相比,CCTA会增加冠状动脉造影的使用,导致更高的医疗成本【1】。PROMISE试验(疑似冠心病患者解剖学与功能学诊断检查策略的随机对照研究)在疑似CAD患者中比较了CCTA与功能性检查,结果提示,CCTA在中位2年随访期间,未能更好地改善临床预后【2】。各项诊断检查的平均费用为:运动心电图,174美元;CCTA,404美元;药物性负荷超声心动图,501美元,运动性负荷超声心动图,514美元;运动性磁共振检查,946美元,负荷性磁共振检查,1132美元【3】。90天时,CCTA与功能性检查的平均费用相似(CCTA:2494美元,功能性检查:2240美元;差异为254美元;95% CI:-634美元,906美元),二者3年的总费用也相似(CCTA:7213美元;功能性检查:6586美元;差异为627美元;95% CI:-463美元,1609美元)。但CCTA增加了心脏的介入治疗。一项基于PROMISE试验数据的Markov微观模拟模型研究比较了CCTA联合非侵入性血流功能储备(FFR)与功能性检查的区别,结果显示,与功能性检查相比,CCTA联合FFR可以更有效地选择ICA【4】。在患者的整个生命周期中,CCTA联合FFR较功能性检查提供了更高的质量调整生命年(25.15 vs 24.68;差异为0.46;95% CI,0.44-0.49)和更低的成本(7222美元 vs 7989美元;差异为-767美元;95% CI,-805美元至-729美元)。虽然PROMISE数据提供了重要结论,但该研究未纳入接受NCS的患者,因此在进行NCS的术前评估时应谨慎处理。
11.1.4. 负荷试验的成本效益考虑
尽管负荷超声心动图比运动负荷心电图(exercise ECG)具有更高的准确性,但其每次使用成本也更高【1】。在一项研究对象为疑似心绞痛的稳定患者(不限于NCS)的RCT实验中,报告了两种检查的显著差异。运动负荷心电图结果为55.7%阴性,7.2%阳性,37.1%不确定;而负荷超声心动图结果为94.8%阴性,4.7%阳性,0.5%不确定【2】。负荷超声心动图会导致较少的门诊及急诊就诊次数、更少的冠状动脉造影(6.3% vs 13.4%;P=0.02)、更低的平均成本(P=0.04),但在3年时的死亡、MI、计划外血运重建和因胸痛住院的复合事件上与运动负荷心电图并无统计学差异(3.7% vs 3.2%;P=0.38)【3】。对于具有良好功能状态和稳定症状,以及接受低风险NCS的低风险患者,术前负荷试验没有好处【4,5】。PROMISE的最小风险工具已被用于识别适合推迟诊断检查的低风险患者【6,7】。模拟试验表明,在低风险患者中推迟诊断测试可能会有更大的健康效益及更低的成本【7】。在PROMISE计算出最低风险的患者中,10%的患者节省的成本为749美元(95% CI,-1647至-158美元),20%的患者节省的成本为677美元(95% CI,-1333至-71美元)。尽管PROMISE数据提供了重要的见解,但该研究并未纳入接受NCS评估的患者,因此在进行NCS术前评估时应谨慎处理。
12. 证据空白与未来研究方向
自2014年指南发布以来,非心脏手术(NCS)患者围术期管理取得了许多进展。然而,关于围术期,医学中仍然存在许多关键问题,以下描述了未来研究中应关注的研究空白。
围术期护理方案和风险评估
• 目前很少有研究关注多学科护理模式对围术期检查(如:非侵入性应激检查的合理使用)或心血管预后的影响。特别是,需要进一步研究如何通过远程诊疗/远程医疗进行术前评估,并为高风险患者协调专业护理。
• 尚无证据表明应优先使用哪一种围术期风险评分。需要更多研究确定如何更好地使用风险评分指导围术期管理,并能降低术后主要心血管不良事件(MACE)。
围术期管理
• 目前尚未确立最佳的指导围术期护理的血压评估方法、血压阈值和测量频率。需要高质量的随机对照试验(RCT)来确定能降低心血管不良事件发生率的具体围术期血压阈值。
• 在NCS患者新发AF时,尚无RCT研究如何控制心率和节律。需要进一步研究确定最佳的术后AF监测和管理方案。
• 对于稳定患者进行NCS前的冠状动脉血运重建是否能改善预后,尚缺乏充分证据。也没有RCT证实,高风险患者进行NCS前的血运重建可以改善预后。
• 指导LVAD植入后进行NCS的最佳时机研究数据有限。
• 对于近期卒中患者,在选择性NCS前的最佳延迟时间尚不明确。NCS在近期卒中患者中引发的额外心血管和脑血管风险尚不明确。
术前评估
• 除了单纯的术前cTn升高之外,没有证据表明进一步检测(如:负荷试验或冠状动脉造影)对患者有益。
• 尚无研究表明心电图结果是否能改善临床决策或改善患者长期临床预后和降低经济成本。
• 对于接受NCS的稳定患者,缺乏支持常规术前评估左心功能(如:FoCUS、超声心动图)的证据。
围术期药物治疗
• 对于PCI术后接受NCS的患者,短期DAPT的有效性与安全性仍需进一步研究。
• 需要大规模的RCT阐明在低风险患者或手术中,围术期使用他汀类药物对长期预后的影响,并确定这类药物最佳的起始时间、药物种类和剂量(如:负荷剂量)。
• 目前没有关于血管紧张素受体/中性内肽酶抑制剂,沙库巴曲缬沙坦在围术期作用(危害或益处)的数据。鉴于RAASi在预防MI、卒中、HF和肾功能下降中的重要作用,需要大规模RCT来确定拟行NCS患者的RAASi术前管理。
• 需要大规模RCT来评估围术期停用、继续使用或开始使用CCB的风险和益处。
• 围术期继续使用慢性α-2受体激动剂的RCT研究尚未进行。
• 尚无确定的证据支持将糖蛋白IIB/IIIA抑制剂作为接受NCS患者的桥接策略。
• 围术期β受体阻滞剂的最佳使用方案尚不明确,包括确定可能受益最大的患者亚组、药物选择、β受体阻滞剂的起始时间以及术前剂量滴定的安全性。
• 围术期糖尿病患者管理的挑战包括评估影响预后的血糖控制标志物、如何选择合适的血糖控制方法以及新型老型降糖药物。关于围术期最佳血糖水平或术后重新启用SGLT2i的研究有限。
• 是否应在选择性NCS前暂停GLP-1受体激动剂1次,以降低术中胃内容物误吸的风险,仍需进一步研究。
术中管理
• 目前支持在非心脏手术中常规使用术中经食管超声心动图(TEE)的有效性证据有限。
• 目前没有高质量证据支持在有心源性休克风险的NCS患者中常规使用机械循环支持(MCS)。
• 目前没有大规模RCT证明肺动脉导管能够改善患者预后或具有成本效益。
围术期监测
• 非心脏手术后心肌损伤(MINS)是一个未被充分认识的临床问题,需要进一步研究以理解其潜在病理生理机制。目前关于降低MINS诊断后风险的最佳治疗方案(包括抗血小板药物和他汀类药物)的数据有限。