编写:王霜,校审:王斌
作者单位:武汉大学中南医院心血管超声医学科
导语:三维(3D)心腔内超声心动图(ICE)正成为经食道超声心动图的一种有希望的补充和潜在的替代方法,用于结构性心脏干预的成像指导。为了建立标准化的实践,2024年6月发表在《JACC:Cardiovascular Imaging》的多学科专家立场声明可作为3D-ICE在各种结构性心脏手术中适应症和应用的综合指南,该文件涵盖3D-ICE成像的基础知识、基本观点和专门针对ICE指导的结构性心脏手术量身定制的工作流程建议,如经房间隔穿刺、心内结构装置封堵、经导管二尖瓣和三尖瓣干预。同时本声明还讨论了当前的挑战、未来的发展等内容,来促进这种创新成像方式的安全性和有效性,扩大其未来的临床应用。
目前,多模态成像技术推动了经导管结构性心脏病介入治疗领域的发展。术前、术中和术后评估技术包括超声心动图(经胸超声心动图(TTE)、经食道超声心动图(TEE)和心腔内超声心动图)、心脏计算机断层扫描(CT)和X线透视检查。随着结构性心脏手术的建立和手术技术的成熟,人们希望在保持安全性和有效性的同时提高手术效率。虽然TEE被认为是介入成像引导的金标准,但实时3D-ICE正在成为一种补充或在某些手术中作为一种替代方案,提供实时二维(2D)、双平面或3D容积成像和多平面重建(MPR)。虽然实时3D-ICE作为一种独立的成像方式具有效率优势,但在图像分辨率和视野方面存在显著的限制,在某些手术中只能作为辅助工具。实时3D-ICE对手术结果和患者预后的影响还需要进一步的研究。
从2D到3D TEE和ICE成像的演变
结构性心脏介入领域的快速发展始于经导管主动脉瓣置换术,由于早期手术的复杂性和并发症,需要TEE成像作为透视的辅助。经导管瓣膜介入成像的重要性和复杂性导致“结构性心脏成像”作为一个完整的亚专业出现,并具有建议的核心能力和培训与实践标准。随着3D操作/渲染软件和成像融合的发展,其持续的相关性得到了证明,TEE在结构性心脏病诊断和手术指导中的应用已成为标准。随着“微型”3D TEE探头的发展,手术可能不在需要全身麻醉,,但可以提供与标准探头类似的宽视野和图像分辨率。最近的一项多中心研究表明,左心耳封堵(LAAO)患者在清醒镇静和微型TEE引导下是安全的,患者的手术时间较长,但术中并发症发生率较低。然而,随着环形和相控阵系统的发展,3D-ICE也在发展。与2D-ICE相比,允许更大的范围探头操作和多平面图像采集,以及更高的手术精准度,可以在某些不太复杂的手术中替代TEE,或者作为TEE成像有限时的补充。
结构性心脏病干预的范围:TEE vs ICE
结构性心脏干预的范围不断扩大(中央插图),包括:1)心内结构的装置封堵,包括卵圆孔未闭、房间隔缺损、室间隔缺损、左心耳(LAA)、瓣周漏和瘘管;2)经导管二尖瓣(MV)干预,如经导管缘到缘修复(TEER)、经导管二尖瓣置换术、经导管二尖瓣环成形术和腱索置换术;3)经导管三尖瓣(TV)干预,包括TEER、经导管三尖瓣环成形术、经导管原位和异位三尖瓣置换;4)经导管主动脉瓣置换术等介入治疗;5)经导管肺动脉瓣介入治疗,如经导管肺动脉瓣置换术(TPVR)和瓣膜成形术;6)其他手术:肿瘤或血栓机械性抽吸。
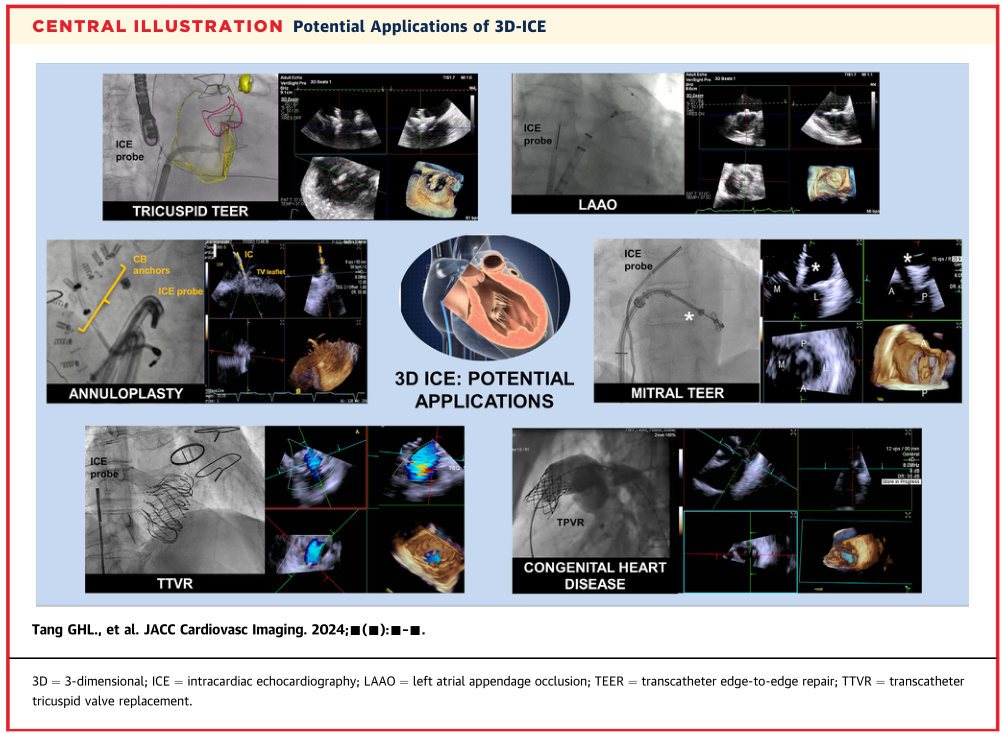
中央插图:3D-ICE的潜在应用
这些手术通常在TEE和透视指导下进行。尽管TEE与3D MPR因其出色的视野和分辨率而成为最常用的手术指导成像方式,但它有重大的局限性。首先,长时间使用TEE通常需要全身麻醉,并且有食道损伤的风险。第二,由于解剖异常(如食管裂孔疝、食管狭窄)或心内装置(如手术和经导管瓣膜、环成形带/环、TEER装置、间隔或LAA封堵器、输送导管)和原生结构(如致密的纤维化组织或钙化)的干扰,可能会影响术中TEE图像质量。第三,远场超声成像的物理限制与声衰减和波束加宽,这限制了成像结构远离食道,如TV成像。表1列出了主要的结构性心脏干预措施及其使用TEE或3D-ICE指导的适用性。

ICE在结构性心脏病干预中的演变
单平面2D-ICE成像可以有效地指导简单的结构性心脏病干预,如房间隔缺损/卵圆孔未闭或无并发症的LAA封堵(LAAO),但指导更复杂的手术,如复杂的LAAO和TEER,可能具有挑战性。与2D-ICE相比,3D-ICE技术在应对这些挑战具有多个优势。目前的3D-ICE导管具有双平面和多平面成像、实时体积成像、彩色血流多普勒评估、数字转向以及在某些情况下独立的换能器尖端旋转。这些3D功能提供了各种安全性和工作流程改进:1) MPR可以在LAAO中实现术中装置的实时尺寸测量,潜在地消除了术前成像以及相关风险(例如,心脏CT成像引发的造影剂肾病,TEE相关并发症);2)3D-ICE有助于在二尖瓣和三尖瓣手术中准确定位装置,潜在地减少了手术时间,并最大限度地降低了装置相关并发症的风险,如单瓣叶装置附着。
左心耳封堵
多个单中心和多中心研究表明3D-ICE导管在LAAO手术指导中的安全性和有效性。对3D-ICE引导的LAAO的需求源于几个因素,包括麻醉师的短缺,超声心动图专家指导TEE手术的报销不足以及手术量的增加。3D-ICE的发展使一些中心能够创建一个LAAO程序,允许在没有麻醉师或超声心动图专家在场的情况下完成手术,依靠护士麻醉师指导的镇静。ICE成像存在一些必须要考虑的局限性。ICE导管插入需要额外的静脉通道,鞘管的大小取决于所使用的特定装置(表2)。
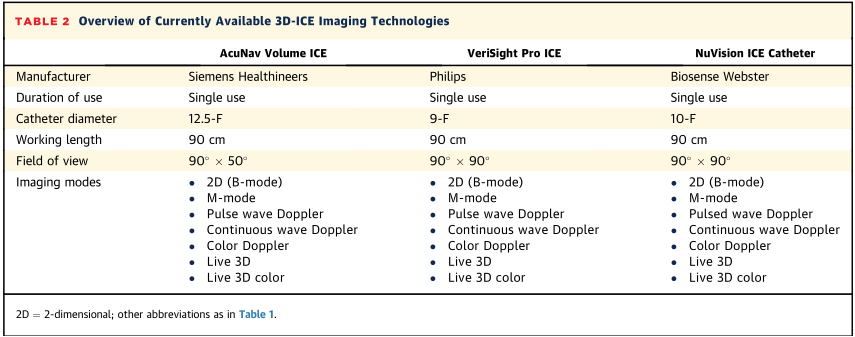
表2 当前可用的3D-ICE成像技术概述
美国LAAO登记处最近的报告显示,2,272例病例(5.7%)使用ICE,31835例(80.0%)使用TEE,结果发现,即使在调整后,45天时使用ICE患者需要干预的心包积液发生率显著高于对照组(1.0% vs 0.5%;P=0.02),尽管82%的手术人员总共进行了<10次ICE指导手术,但随着手术人员进行更多的ICE指导手术,这一比例有所下降。这可能与ICE探头成像深度有限以及未能迅速识别该并发症有关。45天内,ICE的主要不良事件发生率(5.2% vs 4.6%)和死亡率(1.0% vs 0.7%)均高于TEE。有证据表明,对于某些仅使用ICE的手术,可能会增加手术时间和造影剂的用量。Ferro等人的一项研究证实ICE手术花费更长的时间,使用了更多的造影剂,需要>30例ICE病例才能将手术时间减少20分钟以上。在一项在47天TEE随访的小型单点研究中,未发现装置的残余漏≥5mm,尽管1-2mm残余漏发生率为23 .3%,3-4mm的残余漏发生率为13 .3%。但是, Ferro 等人发现装置周围残余漏发生率之间没有差异(ICE和TEE的任何大小残余漏分别为16.2%和17.7%;P < 0.19)。鉴于同一登记处最近的数据显示LAAO后的小残余漏(>0-5 mm)与血栓栓塞和出血事件的发生率较高相关,因此有必要努力降低这些发生率。
目前,3D-ICE探头是一次性使用且昂贵的,因此在一定程度上抵消了意识镇静与全身麻醉相比的成本节省。然而,ICE LAAO手术后当天出院的发生率更高(29% vs 24%;P < 0.001)。提高小型和微型TEE的创新已经在进行中,并将提高它们的空间分辨率和3D成像能力。这些进步将使小型TEE成为那些对极简LAAO感兴趣操作者的一个有吸引力的选择,这些操作者担心学习曲线长、额外的静脉通道或ICE探头的成本。
SCAI/HRS(心血管造影和介入学会/心律学会)建议指出:左心耳封堵的ICE指导应留给经验丰富的项目/植入者/介入成像医生。当开始ICE指导左心耳封堵时,建议使用TEE和ICE联合一段时间,直到对ICE导管和介入成像和植入团队的图像采集工作流程感到满意为止。此外,当使用ICE时,建议术前当日使用心脏CT或TEE进行基线成像,提供LAA形态学的详细信息。不建议单独进行透视检查而不使用TEE/ICE。
其他结构性心脏手术
支持使用3D-ICE用于其他结构性心脏手术的数据仅限于病例报告或系列报道。在TV干预中,将3D-ICE导管置入右心房可作为TEE的重要辅助手段,并有助于减少手术时间。对于MV干预,最近的一项多中心回顾性登记评估了3D-ICE的安全性和可行性,12例有TEE禁忌症或不耐受的患者接受二尖瓣TEER,仅使用3D-ICE作为手术指导。TEE的禁忌症分为颈/胸椎疾病、食管/胃疾病和凝血功能障碍/血小板减少症。33%的病例仍采用全身麻醉。所有患者均使用了二尖瓣反流装置,67%的患者出现轻微或较少二尖瓣反流(所有≤2+)。
3D-ICE成像技术
虽然“4D”这个术语是由一些设备公司创造的(以时间为第四维),但超声心动图本质上是对心脏结构的实时成像。因此,本写作小组一致认为,鉴于所有超声心动图模式本质上都是“实时”的,将时间作为M模式或2D成像的一个“维度”似乎不合逻辑,“实时3D-ICE”一词是对该技术更准确的命名。目前有3种实时3D-ICE成像技术(表2)。
3D ICE指导的结构性心脏手术和工作流程建议
经房间隔穿刺
经间隔穿刺是左侧经导管介入如LAAO或MV介入的关键步骤,需要逐步入路以减少并发症。通过将3D-ICE导管推进至右心房,可以获得双腔静脉视图。手动导管操作有助于理解穿刺针在前/后位的放置。双平面成像的最新进展使同时在0和45-60°进行观察,允许同时评估上下平面和前后平面。对于MV介入治疗,测量房间隔高度至关重要,可以通过MPR或单2D视图来完成(图1)。当使用单个2D视图时,保持针头在视线内,应顺时针旋转3D-ICE导管,直到MV平面可见。从这些图像中,可以测量二尖瓣手术中经间隔穿刺的高度,以及到LAA的穿刺轨迹,确保准确的穿刺位置。在取出3D-ICE导管之前,应排除心包积液。然而,由于该探头的成像深度有限,左心室和右心室的长轴图像不足以排除积液,因此应进一步操作探头对左心室短轴切面成像。在取出经房间隔导管后,应评估医源性房间隔缺损以确定分流的方向。

图1 房间隔穿刺的关键视图
LAAO手术
根据SCAI/HRS的建议,LAAO的手术计划中先应进行术前CT成像或TEE,特别是仅限3D-ICE的手术。虽然可以从右心房看到LAA,但建议将导管推进至左心房以获得最佳视角(图2)。解剖标志(如华法林嵴和左上肺静脉)的方向可能因3D-ICE导管的位置而异,可能导致混淆。
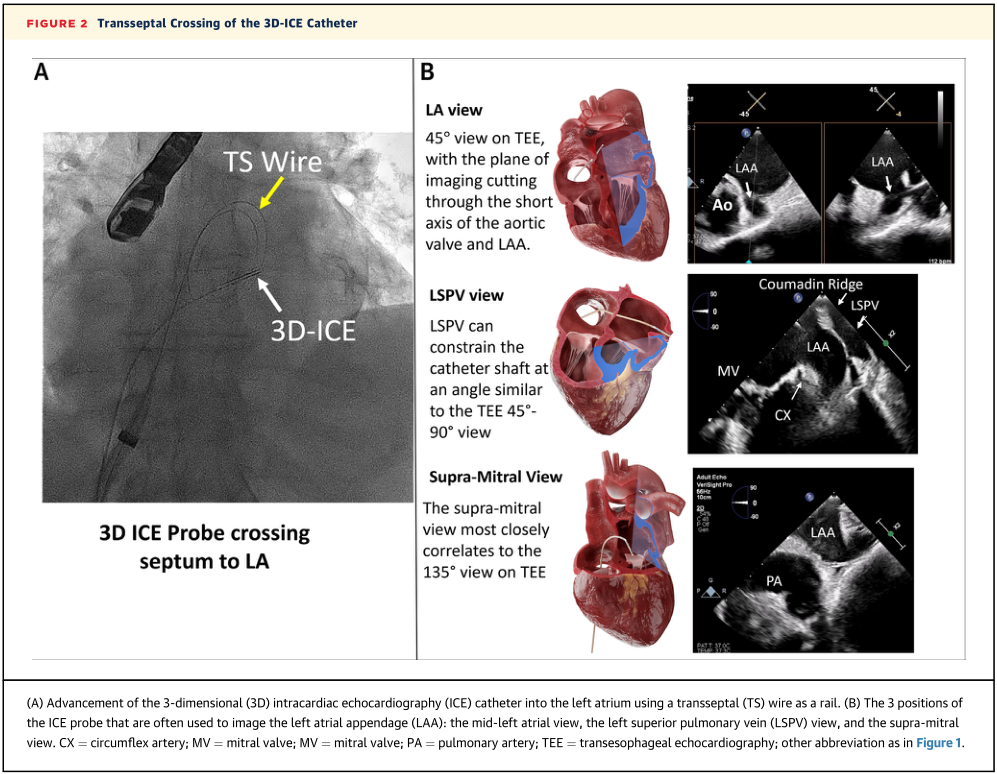
图2 3D-ICE导管经间隔穿入
在这种情况下,脉冲波多普勒可用于确认LAA位置。ICE探头通常有3个位置对LAA进行成像,分别为左心房视图、左上肺静脉视图、二尖瓣上方视图。从这三个视图,使用机械旋转和仰角倾斜的二维双平面成像应该可以评估封堵装置的完整周长。MPR或2D成像(单平面或双平面)可以从任何位置评估心耳,而不需要过度操作左心房的ICE导管(图3),特别是使用数字转向(旋转和仰角倾斜)扫描LAA开口。这些模式中的任何一种都可以用于优化装置放置、装置压缩和装置周围残余漏的评估,并且它们确保满足特定装置规定的释放标准。在手术结束时,可以很容易地对房间隔进行评估;但是,考虑到ICE成像深度非常有限,而且三维ICE的成像精度也非常低,因此,最好使用TTE来评估心包积液。

图3 LAAO手术
三尖瓣干预
ICE导管的“主”视图是右心室流入/流出视图,当3D-ICE导管从下腔静脉进入右心房并向TV弯曲时,沿着探头的长轴看到前/后方向。从该视图扫描整个TV的双平面成像可以识别瓣叶,从而以识别反流射流并表征瓣叶长度和对合间隙(图4)。考虑到TV的正常尺寸可达6.0cm2/m2,3D-ICE体积成像的空间和时间分辨率通常不足以对完整的瓣环和瓣叶解剖结构进行成像。因此,用于三尖瓣手术的3D-ICE通常是TEE的辅助成像方式。重要的是,应该始终考虑探头长轴的方向,以优化用于创建图像的成像晶体的数量;使用弯曲转轮或尖端旋转(取决于装置)应允许导管与解剖结构最佳对齐。
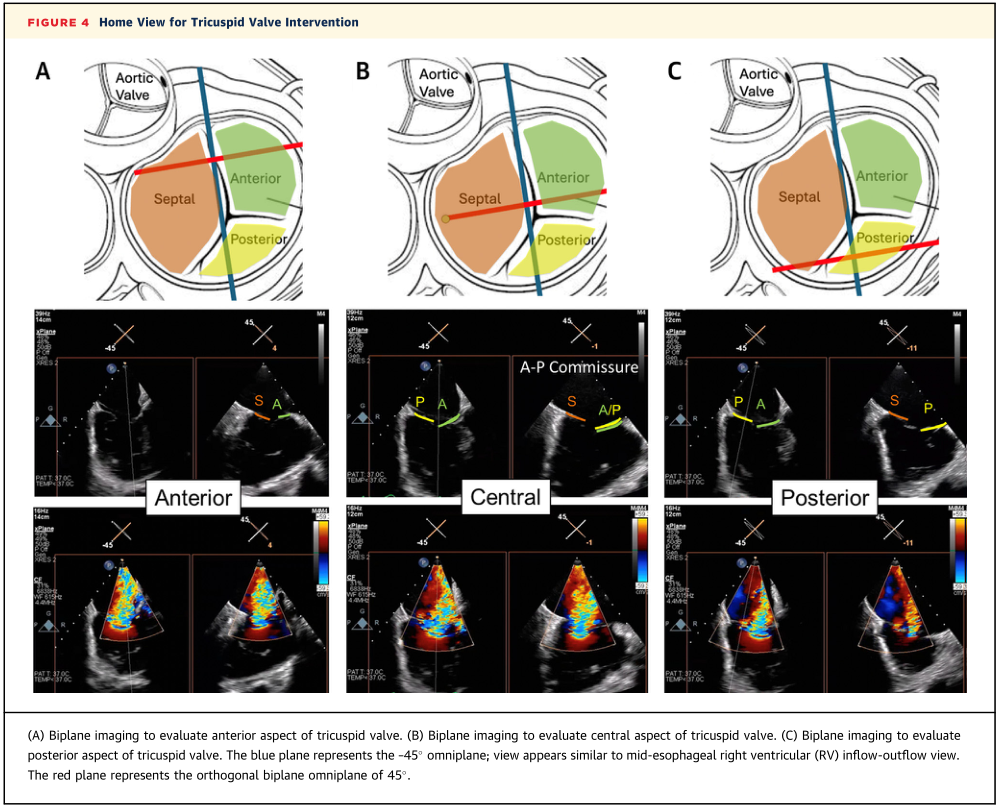
图4 三尖瓣介入治疗的主视图
三尖瓣TEER
三尖瓣TEER手术时TEE成像可能受到装置轴、右心室导线或邻近心脏结构(如左心人工瓣膜)对瓣叶的声学阴影的限制。此外,作为远场瓣膜,除了从食管深部和经胃的视图,时间和空间分辨率都受到影响。考虑到这些困难,即使在专家手中确认瓣叶的抓取也可能具有挑战性的,如果没有足够的瓣叶插入,可能会导致瓣叶装置附着不正常。3D-ICE是TEE的重要补充成像工具,在器械释放前评估和确认足够的瓣叶插入和三尖瓣反流(TR)减少,从而可能降低单个瓣叶装置附着和相关并发症的风险。
无论是使用TriClip还是PASCAL装置,工作流程都是相似的。患者在全身麻醉下,进行全面TEE检查;如果预测到成像存在挑战或在遇到成像困难后,可以决定使用3D-ICE。3D-ICE导管在置入导管鞘后经股静脉插入。ICE导管的尖端位于右心房,获得TV的右心室流入/流出视图(前叶和后叶)(图4)。可以使用双平面成像对打开的双臂进行成像。如果使用-45 °/þ45°视图时,可能需要稍微向左或向右弯曲以优化此图像。3D-ICE导管的位置可以通过透视确认,以确保该装置不直接位于输送导管的后方。最初的大部分手术都是通过使用TEE来完成的,它可以在需要的视野范围内(将输送系统推进到右心房,定位在TV上方,并确认适当的轨迹)。通过TEE或3D-ICE检查确认瓣叶抓握。根据图像质量,3D-ICE可用于确定装置方向(图5A);但是,通常需要经胃TEE影像学的证实。
在装置进入右心室后,TEE探头被推进到经胃水平,获得最佳的TV瓣叶短轴成像。如果3D-ICE容积足以对瓣叶可视化,则可以使用3D MPR;大多数情况下,使用双平面(或单平面)成像来进行瓣叶抓取。在瓣叶抓取过程中,3D-ICE成像应能显示瓣叶在器械中心的位置,小叶的尖端在器械中心的位置。相应的透视图像显示夹臂处于打开和关闭位置,无视差有助于确定夹臂的方向(图5G至5H)。闭合装置,在3D- ICE(图5I)上确认瓣叶桥和TR减少(图5I)。一旦所有成像模式和水平都确认了瓣叶插入,器械就会被释放。最后评估残余压差和瓣口面积(通过MPR和多个孔口面积的平面测量),以及肝静脉的血流逆转和残余TR(通过MPR和多个反流口面积的平面测量)。
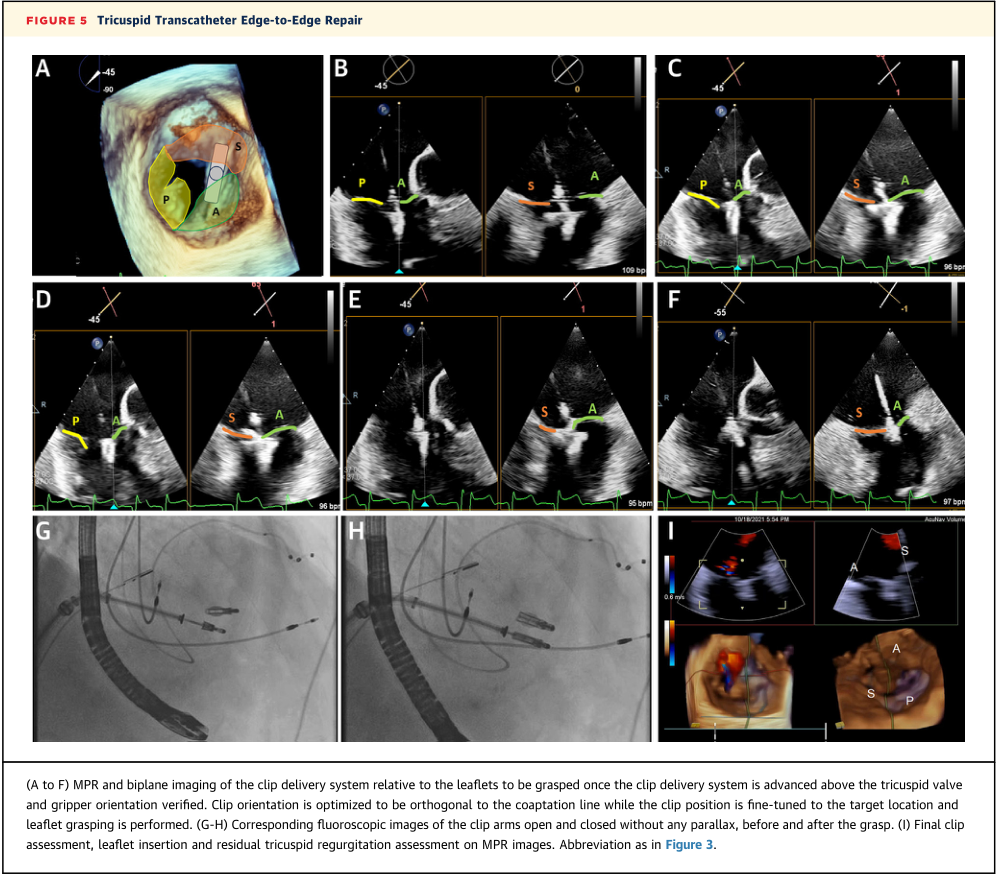
图5 三尖瓣经导管缘对缘修复
三尖瓣环成形术
使用Cardiband 系统的经导管直接瓣环成形术,在环的心房侧按顺时针方向从前到后逐步进行,并结合透视和TEE。最近,ICE已被整合用于术中指导(图6)。已经描述了指导TV瓣环成形术的各种方法,但尚未系统定义标准化的ICE方案和所需的成像平面。“瓣膜内探头”技术是目前最有前途的方法,因为使用可操纵的导管操作将ICE探头连续放置在后间隔、前间隔和前后连接处。

图6 ICE引导的三尖瓣可视化
3D-ICE有可能简化Cardioband手术,因为它克服了2D-ICE成像的视野限制(图7)。聚焦3D-ICE成像提供瓣环铰链点和装置锚定的高分辨率图像,提高了手术精度和安全性。在一组26例接受Cardioband植入的患者中,Davidson等报道了系统地使用3D-ICE作为术中TEE的辅助手段,改善了可视化效果,尤其是瓣环侧方。
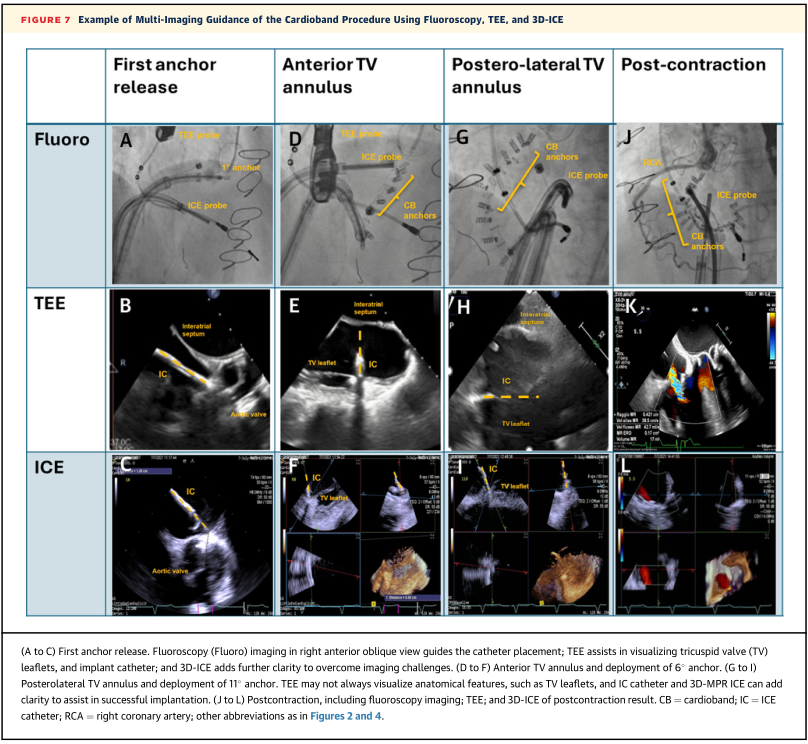
图7 使用透视、TEE和3D-ICE的多种成像引导心脏手术的例子
经导管三尖瓣置换术
与TEER或直接瓣环成形术相比,经导管TV置换术几乎消除了患者的TR,无论解剖结构如何,同时即使是晚期疾病也提供了更高的重复性。3D-ICE引导的经导管TV置换在已发表的报告中有报道,主要是因为有机会使用这种新设备的中心数量有限。图8展示了在3D-ICE和TEE引导下,EVOQUE从右侧经股通道植入的经导管三尖瓣不同步骤。ICE导管通过左股静脉插入右心房。考虑到瓣膜输送系统的高稳定性,导管在右心房中间放置的标准位置不需要任何额外的护套,可以稳定地观察瓣叶捕获和逐步植入瓣膜。

图8 经导管生物瓣膜EVOQUE在三尖瓣环的逐步植入
二尖瓣干预
考虑到食道位于左心房穹窿后方,因此可以使用TEE对MV进行最佳成像,3D-ICE很少用于左心手术。然而,3D-ICE在TEE可能不可行的情况下(如食道/胃疾病、脊柱疾病、大型食管裂孔疝、凝血功能障碍)指导MV干预方面具有价值。在3D-ICE引导下经房间隔穿刺后,将3D-ICE导管推进至左心房,可以进一步优化MV成像。一旦获得双平面视图,就可以使用双平面成像来评估MV。另外,MPR也可以同时在2D和3D上显示联合交界、左心室流出道和MV正面视图(图9)。干预后,这些相同的视图可以用来评估手术的成功效果。
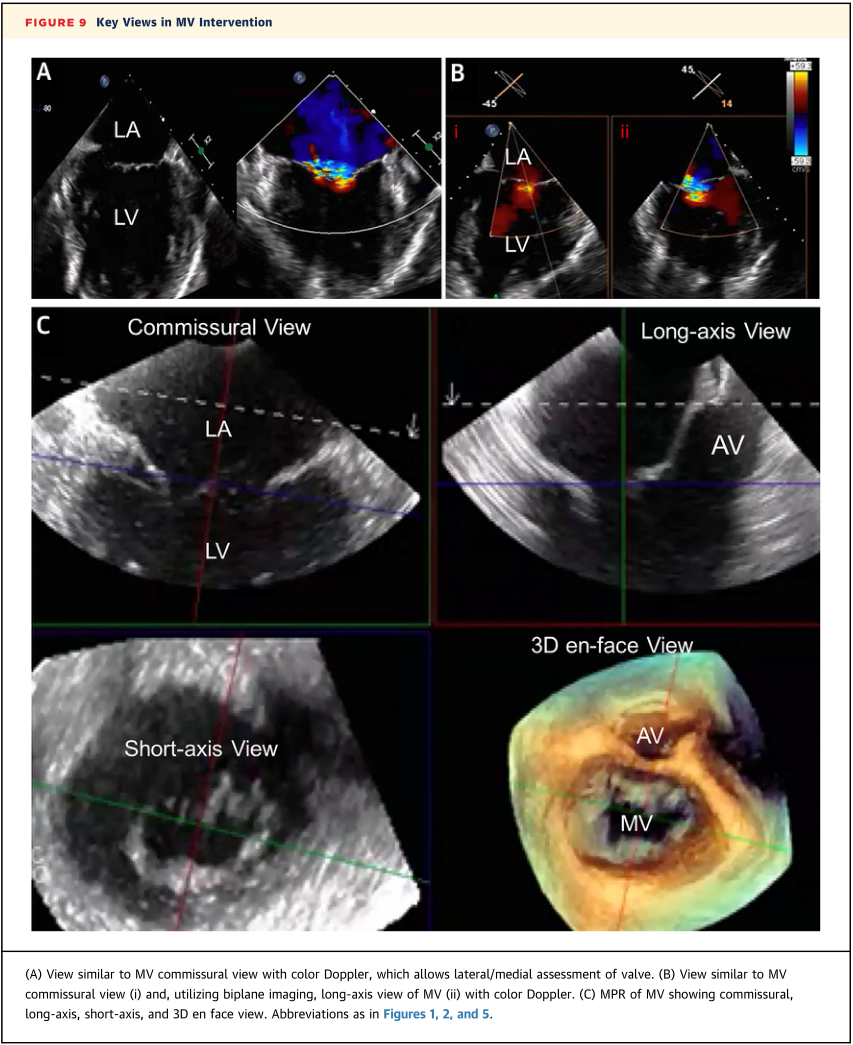
图9 二尖瓣干预的关键视图
二尖瓣TEER
最近的报告显示,3D-ICE在使用MitraClip系统进行二尖瓣TEER手术指导的可行性。3D-ICE主要通过数字引导为二尖瓣TEER提供广泛的高质量图像;由于各种解剖限制或从食道成像时装置输送导管的声影,TEE并不总是可行的。
在双平面视图进行房间隔穿刺后,将鞘管推进穿过房间隔,在透视和ICE引导下,将预成型的硬导丝小心地放置在左心房(图10A至10B)。房间隔造瘘术(图10C ~ 10E),在房间隔内放置三维ICE导管,通过导管顺行弯曲,跟踪预成型的导线,并将其放置在房间隔内。然后使用3D-ICE进行详细的TEER前评估(图10F至10I)。随后将可操纵导管通过预成型的导丝穿过房间隔,在透视和ICE引导下推进TEER装置(图11A)。3D-ICE导管放置在装置输送导管上方,指向下方,以便在引导时看到MV和设备输送导管。利用2D和3D正交视图的双平面或MPR将装置定位在二尖瓣环平面的所需位置,并将器械臂垂直于MV适合位置,随后将设备推进左心室(图11B至11C)。将TEER回撤到目标位置的MV瓣叶下方,通过MPR成像进行瓣叶抓取(图11D)。这些相同的视图可用于在器械释放之前评估手术成功效果(图11E)。鉴于目前的3D-ICE系统与TEE相比,在二尖瓣TEER中装置定位和抓握所需的空间和时间分辨率较差,因此3D-ICE系统最好保留给TEE禁忌症的患者。
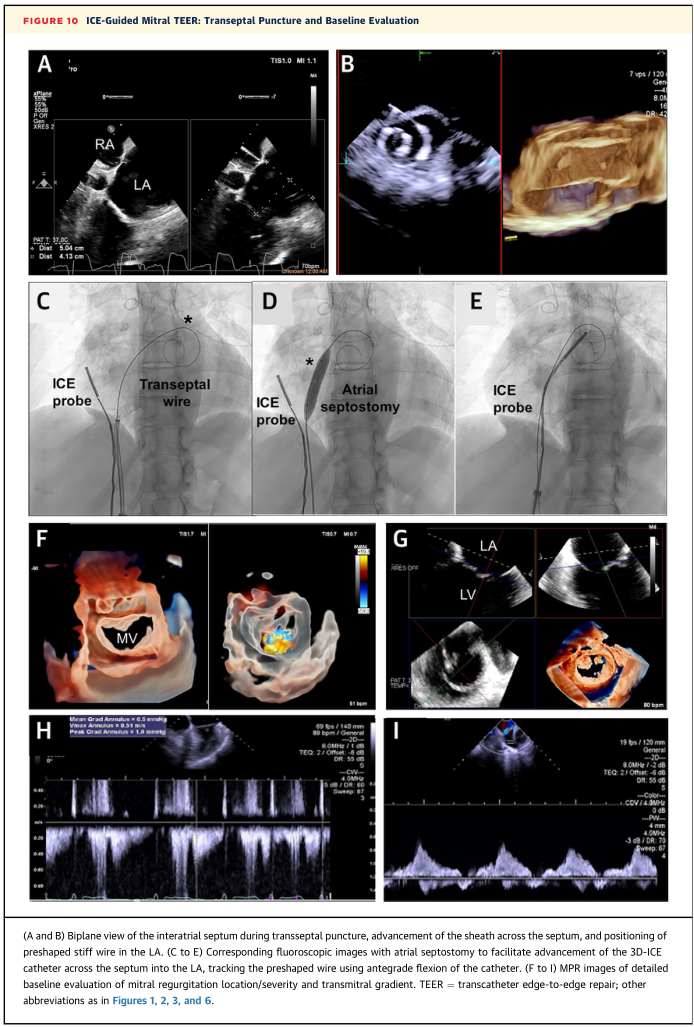
图10 ICE引导二尖瓣TEER:经房间隔穿刺和基线评价

图11 ICE引导二尖瓣TEER:夹子部署
经导管二尖瓣置换术
早期使用3D-ICE进行MV瓣中瓣和环中瓣的经导管MV置换术经验表明,3D-ICE的可行性和技术上的成功与TEE相当。ICE可以指导经房间隔穿刺、房间隔造口术、MV穿越、瓣膜定位/释放、高压球囊改造/开裂,以及置换后的功能评估,包括残留压差和人工瓣膜周围和瓣内反流的存在(图12A至12D)。房间隔造口术后的ICE可视化可以评估需要并在适当的时候指导经皮房间隔关闭(图12E)。左心室流出道梗阻可以通过彩色多普勒湍流的证据来评估;尽管如此,侵入性血流动力学与经胸超声心动图联合使用更可靠,应用于高危患者。经房间隔穿刺后导丝应保持在左心房,用于引导ICE探头穿过房间隔(图12F)。虽然ICE在二尖瓣介入治疗中具有优势,但目前不建议完全替代TEE进行经导管MV置换术。瓣中瓣和选择性环中瓣等应用促进了3D-ICE的使用,特别是在人工二尖瓣膜上有透视标记和左心室流出道阻塞风险最小的情况下。此外,瓣中瓣的单平面视图可以提供关键性的可视化(图12G)。

图12 ICE引导的经导管二尖瓣瓣中瓣置换术
瓣周漏封堵
3D-ICE探头放置的位置取决于瓣周漏(二尖瓣与主动脉)的位置及其在人工瓣膜周围的相对位置。大多数情况下,3D-ICE探头可放置在右心房或右心室。对于二尖瓣瓣周漏,可能直接放置在左心房内是必要的,对于主动脉前瓣周漏,则可能放置在右心室流出道内。3D-ICE单独或与CT-X光融合成像可以提供足够的图像信息来指导导线定位,通常是经皮瓣周漏封堵最具挑战性的方面。MPR可以创建人工瓣膜的3D正面视图,并用于确定瓣周漏的大小,用以选择封堵器设备。3D - ICE引导下瓣周漏封堵的手术成功率与TEE引导下的干预相似,且并发症很少。
3D-ICE在先天性心脏病中的应用
2D-ICE最初用于指导房间隔缺损封堵等简单先天性心脏缺陷的干预,但由于缺乏MPR、电子转向和实时3D成像,2D-ICE在更复杂的病例中的应用受到限制,需要进一步的研究来确定其对这些患者的疗效。先天性手术包括TPVR、房间隔缺损和室间隔缺损的封堵以及大动脉转位患者心房隔板的不规则形状的封堵。在这里,我们重点关注3D-ICE在房间隔缺损封堵和TPVR中的应用,TPVR是右心室流出道疾病缓解失败后患者经常进行的手术。
房间隔缺损封堵
TEE传统上被用作评估房间隔缺损和周围边缘的主要诊断成像方式,以帮助制定手术计划。虽然TEE对于非常大缺损的边缘精确评估仍然是必要的,但较小和中等大小的缺损可以使用ICE成像和封堵。3D-ICE可在术前和术中使用,提供实时图像引导,无需全身麻醉或TEE。
ICE导管可通过同侧股静脉或对侧股静脉置入,置入右心房内,在多视图和TV上观察边缘,并对缺损进行彩色多普勒评估(图13A)。ICE导管从“主视图”向后弯曲,向右倾斜,使换能器面向房间隔,可见整个房间隔、冠状静脉窦、左心房和肺静脉。将导管沿头侧方向朝上腔静脉方向推进,形成双腔静脉视图,可以测量房间隔缺损的上缘和下缘。然后,顺时针旋转和向左倾斜产生短轴间隔视图,可以看到主动脉和缺损的后缘。
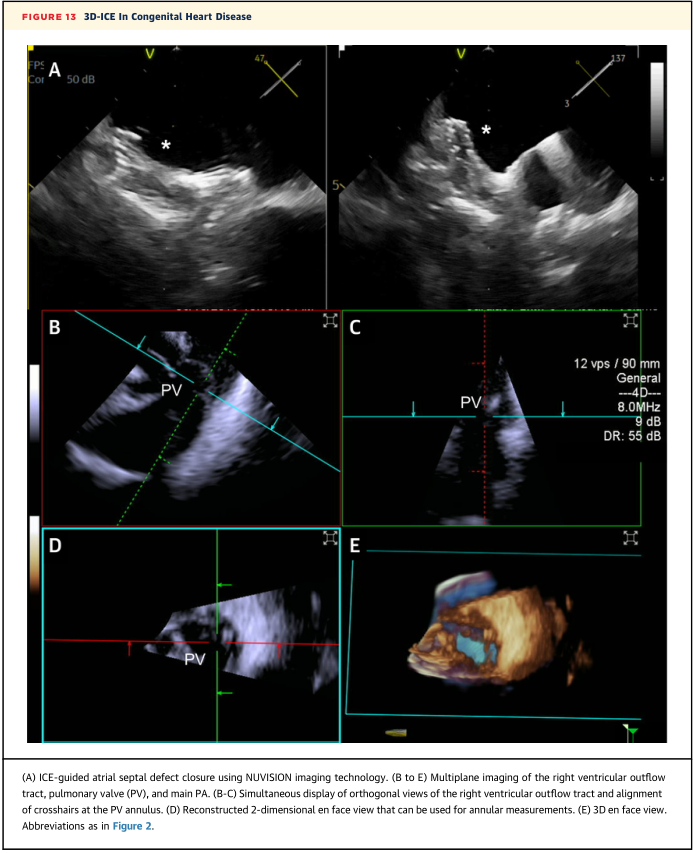
图13 3D-ICE在先天性心脏病中的应用
带有3D-ICE的MPR提供了缺损形态和大小的精确可视化。必要时,可使用彩色多普勒“止流”技术进行球囊尺寸测量或评估血流动力学,特别是在肺动脉高压的情况下。然后,使用标准技术推进和部署器械。3D-ICE成像提供了关于器械位置、稳定性的详细信息,并在主动脉/后部和上/下腔视图以及双房的MPR面视图上充分捕获了边缘。实时监测装置释放,包括评估释放后的稳定性和评估心包腔。
TPVR(经导管肺动脉瓣置换)
传统上,TPVR依靠血管造影术来指导操作。由于右心室流出道和肺动脉瓣位于前上方,TEE可视化这些结构可能具有挑战性。ICE可以通过将导管放置在这些结构附近来解决这些限制。将右心房内的ICE导管面向正对着TV(“主视图”),轻微顺时针旋转可看到右心室流出道和肺动脉瓣。在此基础上,通过电子引导将导管置入右心室流出道,或将导管置入右心室流出道下方,评估反流情况。实时MPR有助于在手术过程中评估瓣环和残余瓣叶的尺寸,这对球囊和瓣膜的尺寸至关重要。这与使用2D-ICE的孤立单平面测量形成对比,后者通常无法呈现真实的动态瓣环尺寸。使用3D-ICE,可以使用MPR生成右心室流出道的正面视图,从而实现直接和准确的测量(图13B至13E)。此外,每次球囊扩张后可评估着陆区,以确保充分缓解狭窄或识别并发症,从而可能避免重复血管造影和导管更换。最后,瓣植植入术后实时三维彩色多普勒可以检测中心性或瓣周反流的存在/严重程度。
当前的挑战和未来的方向
3D-ICE的广泛采用面临着许多挑战,包括一次性3D-ICE导管的成本和超声机器的软件升级,这可能成为资源有限的医疗保健系统的障碍。目前全球已上市的3D-ICE有飞利浦Verisight Pro、强生NUVISION NAV,西门子AcuNav Volume,以及研发成功即将投入临床使用的TINGSN实时3D-ICE,这些产品后续的研发迭代更新,将陆续降低临床使用的难度,全面的健康经济分析对于评估使用3D-ICE技术的财务影响和效益至关重要。尽管3D-ICE可以作为TEE引导的可行替代方案,但其固有的局限性,如与TEE相比较少的成像阵列,通常会导致成像质量较差。虽然在经验丰富的中心进行的研究表明,在精心挑选的患者中,使用3D-ICE可以有效地完成复杂的心脏结构手术;但当这些导管被引入经验不足的中心和所有病人群体时,这些良好的结果是否会保持还有待观察。表3描述了3D-ICE的现状,突出了存在的挑战并概述了未来的方向。

表3 3D-ICE的当前挑战和未来方向
结论
3D-ICE可生成高质量的心脏结构近场图像,并有可能成为TEE的补充或替代方法,用于结构性心脏病干预的术中指导。
参考文献:
Gilbert H L Tang, Syed Zaid, Rebecca T Hahnet,al. Structural Heart Imaging using 3-Dimensional Intracardiac Echocardiography: JACC Imaging Position Statement[J]. JACC Cardiovasc Imaging,2024 Jun 6:S1936-878X(24)00202-X.doi: 10.1016/j.jcmg.2024.05.012.