
潘文志 裴志强 沈雳
复旦大学附属中山医院
心肌梗死合并心源性休克是临床上极为凶险的疾病,患者死亡率极高。患者发病后出现血压低、循环不稳等病危状态,使用外来的机械循环支持(MCS)使得患者心脏得到休息同时纠正紊乱的血流动力学及内环境,自然成为人们可以想到急救方法。然后,既往的该类患者MCS的RCT研究,如使用IABP的SHOCK研究,使用ECMO的ECLS-SHOCK研究,均是阴性结果,使得行业人士备受打击甚至自我怀疑,本次ACC大会公布的DanGer Shock采用更高级的MCS设备微轴流泵(Impella CP),其结果受到人们极大专注。本研究取得阳性结果,结果即将发表在《新英格兰医学杂志》。
1
研究简介
研究背景
研究方法
研究结果
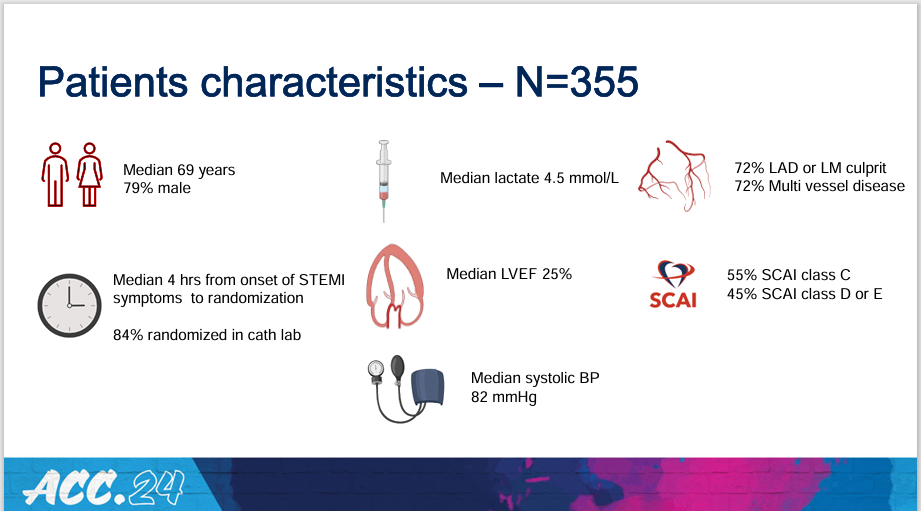

患者基线特征

180天主要终点(全因死亡)比较

次要终点:180天复合心脏事件
研究结论
微轴流泵治疗STEMI相关心源性休克患者的180天时的任何原因死亡风险较标准护理低。但微轴流泵组复合物安全不良事件的发生率更高。
2
结果解读
这次试验区别于先前其他机械循环支持的随机试验的最大之处与入选的病人同质性更高。先前临床试验中,虽然也将动脉乳酸作为判断休克的入选标准,但这一指标并不能区分患者是因为心脏骤停后复苏导致的指标异常,还是由于心功能持续低迷导致的指标异常。这两类病人预后差别很大,既往的临床研究显示,心脏骤停复苏后的患者,晚期的死亡率很高,这些患者可能大脑受过严重损伤(甚至植物人状态),即使心脏完全得到恢复,后期死亡率仍然会持续升高,从30天时为32%,1年时为47%。本研究中,将心脏骤停被复苏但格拉斯哥昏迷评分低于8(范围为3到15,分数越高表示更好的状态)患者排除在外,可避免出现由于脑神经损害导致死亡的病例。这是本研究区别于其他研究,能得出更积极结论的主要原因。
总之,本研究是MCS治疗心肌梗死合并心源性休克这一科学问题探索首个取得阳性积极结果的研究。本研究为心肌梗死合并心源性休克循环支持提供令人兴奋的证据,相信这一方向未来会有更多研究支持,以进一步改善这类患者的结局。