






本文特邀作者
张海涛 同济大学附属东方医院
李白翎 海军军医大学第一附属医院
罗 哲 复旦大学附属中山医院
谢 波 上海交通大学附属仁济医院
周宏艳 中国医学科学院阜外医院
郝光伟 复旦大学附属中山医院
近年来伴随着心血管外科技术的发展,以血流动力学治疗为核心的心血管危重病医学也日趋发展成熟,并在重症医学领域占有重要地位。正如综合ICU的成长是伴随着呼吸功能支持技术的进步,心血管ICU的发展则得益于有效的循环支持技术的创新。心血管危重病医学不仅在患者管理中始终贯穿传统危重病医学的基本原则和规范,同时具有专科特色,在血流动力学治疗等方面理解的更为深刻。
一、心脏外科术后血流动力学进展

图1:生物电阻抗技术测量心输出量。图片来源:Ann Card Anaesth 2023;26(4)。
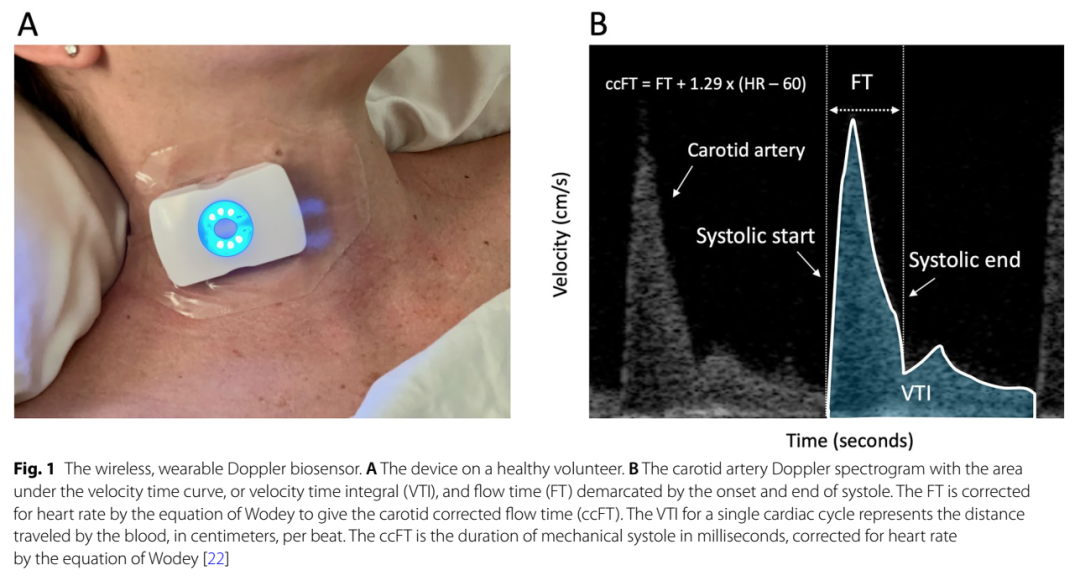
图2:持续颈动脉血流技术测量心输出量。图片来源:The Ultrasound Journal 2023 Jul 28;15(1)。

图3:脉冲分解分析技术测量心输出量图3:脉冲分解分析技术测量心输出量。图片来源:BMC Anesthesiology (2023) 23:180; Caretaker Medical官网。
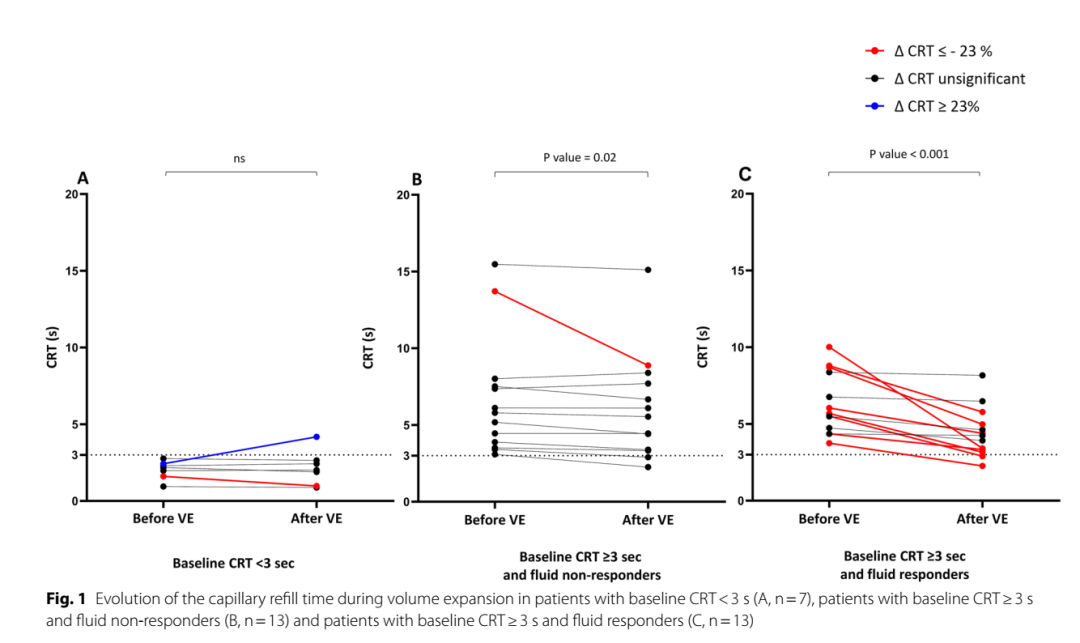
图4:扩容以后CRT的变化。图片来源:Critical Care (2023) 27:429。

图5:加大去甲肾上腺素剂量以后CRT的变化。图片来源:Critical Care (2023) 27:429。
换句话说,对于CRT延长的患者,如扩容以后心输出量增加小于15%或加大去甲肾上腺素剂量后平均动脉压升高小于15%,CRT基本保持不变;如扩容或加大去甲肾上腺素剂量后患者大循环明显改善,CRT的反应也不是完全一致的,部分患者CRT下降,部分患者CRT保持不变。这种CRT与大循环分离的现象,再次证实了CRT是微循环灌注的重要标志。

图6:ROC曲线法不同气道闭合压状态下PPV预测容量反应性。图片来源:Annals of Intensive Care (2023) 13:72。

图7:灰色区间法不同气道闭合压状态下PPV预测容量反应性。图片来源:Annals of Intensive Care (2023) 13:72。

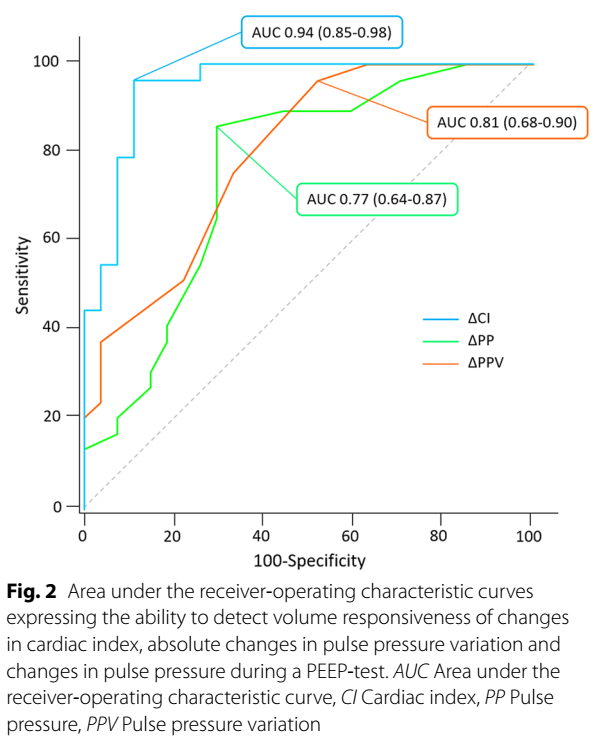
图9:ROC曲线法PEEP试验预测患者的容量反应性。图片来源:Critical Care (2023) 27:136。


图10:ROC曲线法EEO、EIO及联合EEO与EIO预测心外科术后患者容量反应性。图片来源:J Clin Med 2023 Mar 29;12(7)。
二、心脏移植围术期管理

图11:心脏移植受者抗CMV治疗。图片来源:J Heart Lung Transplant 2023 May;42(5)。
三、心脏手术相关急性肾损伤
2、预防
由于CSA-AKI对临床结局影响大、且治疗手段有限,因此对其预防尤为重要,特别是对于具有肾损伤高危风险的患者。2022年底,美国胸外科医师协会、美国心血管麻醉医师协会和美国体外技术协会(ATS/SCA/AmSECT)共同发布了“预防成人心脏手术相关急性肾损伤的临床实践指南”。该指南共给出7条意见:体外循环手术避免高温(>37℃)灌注(I类推荐,B-R级证据);体外循环中采用目标导向的氧输送策略(I类推荐,B-R级证据);体外循环手术,对AKI高危患者应用改善全球肾脏疾病预后组织(KDIGO)实践指南(IIA类推荐,B-R级证据);体外循环手术,只要避免低血压,使用非诺多泮可能是降低CSA-AKI风险的合理方法(IIB类推荐,B-R级证据);使用微创体外循环技术(MiECC)来降低CSA-AKI的风险可能是合理的(IIB类推荐,B-R级证据);不建议在体外循环和围手术期单独输注多巴胺来降低CSA-AKI的风险(III类推荐,A级证据);体外循环中不建议使用甘露醇来降低CSA-AKI的风险(III类推荐,B-R级证据)。
3、治疗
最终需要肾脏替代治疗(RRT)的患者占全部成人心脏手术的1%~5%。RRT的启动时机存在争议,并且缺乏在CSA-AKI背景下的高质量研究。虽然STARRT-AKI研究和IDEAL-ICU研究并未显示“早期”(或“加速”)启动RRT的优势,甚至在一些次要终点上劣于“延迟”(或“标准”)启动,但是上述研究人群主要为脓毒症患者。而以外科手术患者为主(其中心脏手术患者占46.8%)的Elain研究则显示“早期”启动RRT可以显著降低90d死亡率,以及降低RRT持续时间、机械通气时间及住院时间。因此,整体评估CSA-AKI患者的容量负荷、血流动力学及内环境状况,以评估RRT的需要、及时启动,这一点至关重要。近期还有研究者运用成本-结果模型,分析了Elain研究的数据和HiDenIC数据库,发现对于CSA-AKI患者“早期”启动RRT比“延迟”启动可以节省可观的医疗费用,并且缩短住院时间,从医疗卫生资源角度亦支持在合适时机启动RRT。
4、预后
术后短期发生CSA-AKI、即使出院时肾功能指标肌酐已恢复正常,也会导致患者中远期的慢性肾脏病、心脑血管事件发生率增加和生存率降低,在既往研究中已有报道。最近,有研究者分析了接受RRT的CSA-AKI患者的预后。在这个312名患者的队列中,住院死亡率为33%,术后1年死亡率为45%。69%的存活1年的患者仍能恢复肾功能,中位肾脏恢复时间为56(37-74)天。考虑到死亡率是一种竞争性风险,51%接受RRT的CSA-AKI患者预计会实现肾功能恢复。在部分风险分布的Fine-Gray模型中,发现接受治疗的年龄增加(HR=0.98,P<0.026)和总输注红细胞增加(HR=0.0958,P<0.001)是肾功能恢复的负面因素。
四、主动脉手术围术期管理
1、术前管理
(1)围术期不良结局的风险预测
2、灌注策略及温度
目前,临床实践指南并没有提供针对主动脉半弓置换的体外循环最佳目标温度的推荐。该研究通过胸外科医师协会(Society of Thoracic Surgeons)的成人心脏手术数据库,查询采用顺行脑灌注进行半弓替换手术(2014-2019年)的患者。使用广义估计方程和限制立方体曲线来确定温度作为连续变量与结果之间的风险调整关系,确定选择性主动脉半弓替换术中采用顺行脑灌注的最佳温度。在374个中心进行的3898例择期半弓替换手术患者中,中位数最低温度为24.9°C(四分位数范围:22.0°C-27.5°C),停循环时间中位数为19分钟(四分位数范围:14.0min-27.0min)。在调整了合并症、停循环时间和个体外科医生后,与24°C相比,降温至25-28°C的患者早期生存率优于降温至24°C的患者;而降温至21-23°C的患者死亡率风险高于降温至24°C的患者。最低温度为27°C的患者死亡率风险调整后概率最低(RR=0.62;95% CI:0.42-0.91)。降温至21°C的患者死亡率风险最高(RR=1.4;95% CI:1.13-1.73)。降温至21-23°C的患者主要并发症风险增加,其中降温至21°C的患者风险最高(RR=1.12;95% CI:1.01-1.24)。对于主动脉半弓置换手术顺行性脑灌注,最佳温度为27°C,可获得最佳的早期生存益处和最小的术后并发症风险。
3、围术期神经系统并发症
(1)脊髓损伤
脊髓损伤(SCD)是主动脉外科术后灾难性的并发症,术后出现截瘫、膀胱及肠道功能受损的情况会增加患者死亡风险,围手术期应严密监测以降低SCD的发生风险。Coselli的团队总结了他们在胸腹主动脉瘤手术围术期脊髓保护的管理流程。预防SCD的措施包括术前优化和识别高危患者,术中辅助措施包括脑脊液引流、左心辅助循环、亚低温、肋间动脉和髂动脉重建、肾和内脏血管灌注等,术后应避免发生低血压和贫血,若早期发现SCD,可及时实施治疗干预以减轻损伤。
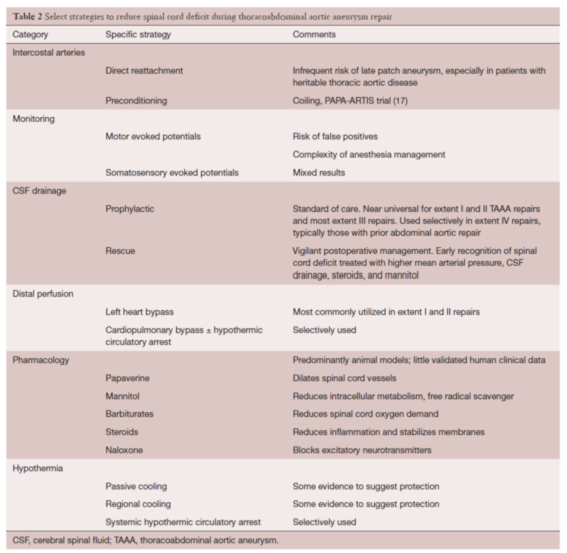
迟发性截瘫在在TAAA修复后术后延迟出现,通常与低血压低灌注相关,低血压可能是心律失常、低血容量或出血所引发,在患者整个术后恢复期间应密切监测血压。对于迟发性截瘫患者,理想的平均动脉压为>100 mmHg,脑脊液压力接近10 mmHg,维持满意血容量和血红蛋白水平。流程如下图。

(摘自Ann Cardiothorac Surg 2023. 28;12(5):429-437)
(2)脑卒中
4、主动脉手术围术期大输血对预后的影响
在心脏手术中输血很常见,输血增加近远期死亡率。在急性A型主动脉夹层患者中,输血几乎是围手术期管理中的不可避免的一部分。主动脉夹层本身导致的凝血功能异常以及术中使用深低温体外循环是高输血需求的两个关键原因。输血相关的急性肺损伤、输血反应、感染并发症和免疫调节异常是常见的输血不良反应。Julia Benk等研究探讨大量输血对急性A型主动脉夹层患者急诊手术的住院期间预后和随访生存率的影响。研究入选在2002年至2020年期间, 505名急性A型主动脉夹层接受手术患者。大量输血定义为围术期输注红细胞大于10单位。结果发现大量输血发生在105名患者(20%)。有大量输血的患者中,症状性冠状动脉灌注不良(p=0.017)和心包填塞(p=0.043)的发生率更高。大量输血的患者中,使用人工瓣膜的比例显著更高(p=0.007)、体外循环时间(p<0.001)、阻断时间(p<0.001)和住院期间死亡率明显更高(p<0.001),但出院后的生存分析显示两组患者之间生存率无统计学差异。大量输血是院内死亡的预测因素(OR:3.308,p<0.001),但对出院后的生存无影响(OR:1.205,p=0.661)。在急性A型主动脉夹层患者中,大量输血对于很多患者是必要的。这些患者病情更严重,手术时间更长。然而,大量输血不影响出院后的生存。
5、肾保护
急性肾损伤(AKI)是胸腹主动脉置换术后常见的并发症,AKI增加心血管事件及全因死亡的风险,术后的肾功能情况与长期生存率密切相关。胸腹主动脉置换手术肾保护的方法不同、AKI定义不同这导致了各大中心报道的AKI发生率数据之间的巨大差异。既往的研究建议使用冷晶体溶液(4℃)选择性灌注肾脏,可以显著降低 AKI的发生率。组胺-色氨酸-酮戊二酸溶液或Custodiol HTK溶液(Custodiol;Dr Franz-Kohler Chemie GmbH)是一种低钾保存液,用于器官移植和心脏停跳液。一项双盲、对照、随机试验比较了在接受开放胸腹主动脉瘤(TAAA)修复手术的患者中,使用Custodiol溶液与林格氏液进行肾灌注的肾脏的保护效果。研究入选了90例择期行开放TAAA修复手术患者随机分为两组,主要终点为术后急性肾损伤(AKI)的发生率。90名患者完成了研究(每组45人)。Custodiol液组术后AKI的发生率明显较低(48.9%vs 75.6%;P=0.02)。在多变量模型中,只有使用Custodiol溶液被证明可以预防任何AKI的发生(优势比,0.230;95%置信区间,0.086-0.614;P=0.003),而II型TAAA的范围与严重AKI的发生有关(优势比,4.277;95%置信区间,1.239-14.762;P=0.02)。在1年的随访中,两组患者的血清肌酐水平与术前值相比没有显著差异。在开放TAAA修复手术中使用Custodiol安全性良好,与Ringer’s溶液相比,其术后AKI的发生率明显较低。
6、抗栓药物是否影响远期主动脉重构
目前为止,尚无随机对照试验研究抗栓治疗对于急性主动脉综合征患者临床结果的影响。在急性主动脉综合征患者住院前已经接受抗血栓治疗的患者是否停止抗血栓治疗,或者对于在急性主动脉综合征住院期间新诊断为有抗血栓治疗指征(如房颤、静脉血栓栓塞或CAD)的患者是否开始抗血栓治疗,尚无共识。既往Kodolitsch等人报道了243例A型急性主动脉夹层手术修复后存活的患者,接受华法林抗凝与平均随访44±26个月时的晚期死亡率或主动脉事件无关。对于B型急性主动脉综合征,抗栓治疗对于预后影响只有少数病例的观察,结果尚无定论。Masumoto等人回顾性分析406例B型急性主动脉综合征患者,其中分为接受抗栓治疗和未接受抗栓治疗者探讨抗栓治疗与B型急性主动脉综合征患者预后之间的关系。主要终点为主动脉相关不良事件的复合终点包括主动脉相关死亡、主动脉破裂、主动脉手术和主动脉进行性扩张。在406例患者中,64例(16%)接受抗栓治疗出院,342例(84%)未接受抗栓治疗出院。共有249例患者(61%)为假腔完全血栓化,157例患者(39%)表现为持续存在主动脉夹层。在平均随访4.6年后,抗栓药物组有32例患者(50%)和未抗凝组有93例患者(27%)发生主动脉相关不良事件。在抗血栓组在1年和3年时主动脉相关事件的累积发生率高于非抗血栓组。在B型急性主动脉综合征患者中,抗凝治疗增加主动脉相关不良事件的发生风险。因此,在有抗栓治疗需求的患者中,需要定期CT检查进行严密随访。