海军军医大学第一附属医院
刘建民教授

“刀尖上跳舞,悬崖上散步”,有人这样描述开颅手术的风险。
在过去三十年里,一代先驱——Guglielmi教授花费近三年时间发明出电解可脱式弹簧圈(GDC),并在1991年首次报告GDC栓塞治疗颅内动脉瘤,改写了学界对脑血管病治疗理念认识,使得神经介入得到了里程碑式发展。
如果说神经介入是脑血管病诊疗最颠覆性的突破,那么创新则是人类探索脑血管病诊疗边界的驱动器。
从伦琴发现X射线到CT、MR技术的问世,从Seldinger 首创经皮穿刺动脉置管技术到Guglielmi教授发明GDC,每一种大胆的想象、每一次“摸石头过河”的尝试,都在无形中雕刻着神经介入今天的模样。
知从何来,方明所去。
那么,究竟是哪些创新造就了今天的神经介入?未来神经介入应如何创新转化?
刘建民教授通过梳理神经介入技术的起源、发展过程,阐述了医学创新的重要性,并分享了自己的创新故事
神经介入创新往事
影像、球囊、弹簧圈
大脑,方寸之地,生死攸关。
有关脑血管病的颅内治疗一直是医学领域最为尖端的年轻学科,是人类试图用人脑医治人脑的极限挑战。这其中,阻碍人类探索的很大一部分原因是医生无法透视大脑,获知病灶。
打破这一桎梏的创新当属伦琴发现X射线。
1895年11月8日晚,德国物理学家威廉·伦琴发现了一种新型射线:X射线,并拍下了那张著名的照片。当他用感光板为妻子的手掌造影后,很快就意识到X射线可用在医学领域。事实也的确如此,就在伦琴发现X射线后的第一年,1896年,X线便应用于临床医学。来自伦敦一位医生在X射线的辅助下成功从一名妇女手部的软组织中取出了一根缝针。时至今日,X线成为了临床最常用的诊断设备,普遍用于在胸部、腹部、头颅、四肢等领域。
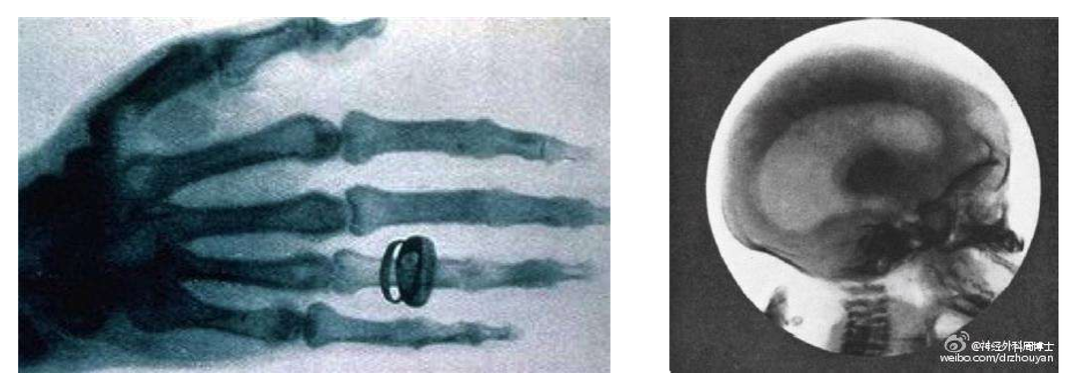
虽然X射线的发现为医学诊断打开了新世界的大门,但其基于二维的成像原理对于颅内组织和血管检查来说,仍然毫无优势。为了使医生可以更清晰对颅内的病灶和症状进行观察、对症施治,世界各国科学家孜孜不倦的基于X射线对医疗影像技术进行着研究和改进。
这其中,为神经介入技术发展奠定重要基础的影像学技术创新莫过于:
1918 年,美国神经外科医生 Dandy 教授发明“气脑造影术”,成功将 X 射线应用于神经疾病的诊断;1927 年,葡萄牙人Moniz发明脑血管造影术,实现了直接活体观察脑血管的影像学检验;20世纪70年代,塔夫斯大学Allan M.Cormack教授和英国EMI的工程师Godfrey Newbold Hounsfield,分别独立研发出CT原型机,奠定了现代脑血管影像检查的基础。
“再之后出现了CTA、MR、MRA、FMR、2D-3D-4D-DSA,以至最前沿的6D-DSA,影像和解剖学的发展让我们能更清楚的观察和了解大脑,为之后神经介入的问世和发展铺设了坚实基础。”刘建民教授在讲课中说道。。
造影技术不断完善,X射线更高级的运用,为医生观察颅内血管病变打开了第三只眼;经导管介入技术也随着影像学技术的发展走向革新。
就在脑血管造影术发明后的第26年,1953年,瑞典放射科医生 Sven Ivar Seldinger 首创经皮穿刺动脉置管技术,即Seldinger 技术,真正意义上拉开了介入技术发展的序幕。紧接着1964年,Alfred Lussenhop证明了颅内动脉置入导管的可能性。在此之后,材料学与技术的进步不断推动着介入技术快速迭代,神经介入随之而来。
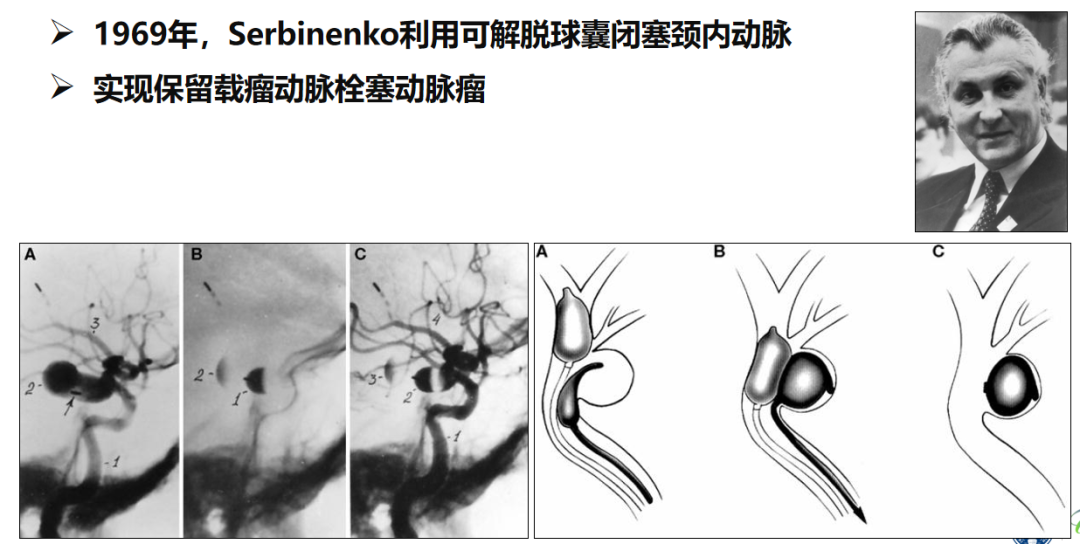
其中,球囊出现并尝试应用于颅内动脉瘤的治疗,被认作为现代颅内动脉瘤血管内治疗的开始。
1969 年,Serbinenko开创性地利用可解脱球囊闭塞颈内动脉,实现了保留载瘤动脉栓塞动脉瘤,为颅内动脉瘤地血管内治疗打开了新的局面。然而,单纯球囊栓塞虽然实现了介入治疗颅内动脉瘤的可行性,但其缺点亦显而易见:血管走行迂曲的颅内动脉瘤使球囊导入困难,如分叶状动脉瘤,球囊无法完全充盈动脉瘤腔,导致动脉瘤易复发;球囊栓塞还可以出现“球阀效应”,导致颅内动脉瘤延迟破裂出血。
直到1980 年代, Guglielmi 在研究动脉瘤电凝时偶然发现脉瘤闭塞效果较单纯电凝更佳,并因此获得灵感,发明电解可脱式弹簧圈,由此开创了颅内动脉瘤治疗的全新时代,也正式宣告颅内动脉瘤进入血管内介入治疗时代。
上世纪80年代,血管支架的创新取得了极大进展,1981年,Klaus Mathias完成首例经皮颈动脉球囊成型;1985 年,Julio Palmaz 发明了首个球囊扩张支架并完成动物实验,此后“支架”逐渐被广泛应用于主动脉、冠状动脉、下肢血管等血管腔内治疗领域。
栓塞三万里
血流导向装置带来动脉瘤治疗新突破
造影、CT、弹簧圈、支架……技术的创新带来诊疗方式的革命性变革,加之世纪之交,各行各业爆发出前所未有的生命力,材料学的飞速发展让越来越多高质量介入手术器械开始使用,关于潜在并发症的知识开始累积,最佳实践案例得到广泛的共享,介入手术在这一阶段得到了快速发展。
然而,尽管医生和科学家们在不断创新和完善安全的介入手术方法,但其疗效安全性和有效性却尚未得到充分验证,由此也注定了神经介入在问世之后很长一段时间内一直被视作为开颅手术补充的结果。
直到2002年,由英国医学研究委员会资助的一项多中心、随机对照研究——国际蛛网膜下腔动脉瘤研究(ISAT)结果一锤定音,以介入治疗组 23.5%< 开颅手术组 30.9%,绝对风险降低 7.4%(95%CI, 3.6-11.2, P=0.001)的研究结果,证实了血管内栓塞治疗的有效性和安全性。
研究发布后的第二年,全美神经介入手术量迅速超过了开颅手术。自此之后,弹簧圈栓塞术迅速成为动脉瘤治疗的主流治疗手段之一。
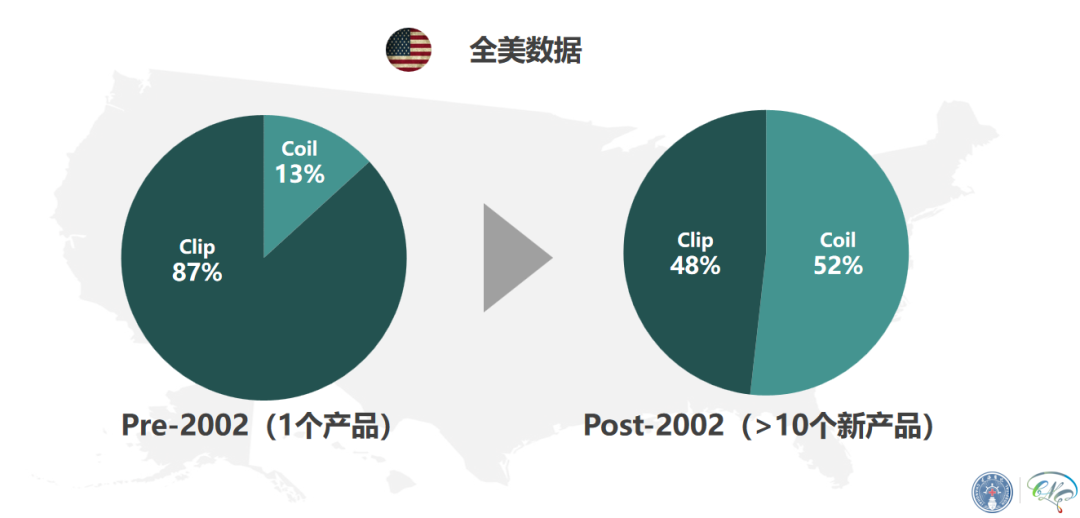
只不过,随着GDC在动脉瘤治疗中的广泛应用,新的问题接踵而来——对于宽颈小型动脉、梭形、大型或巨大型动脉瘤,通过单纯弹簧圈栓塞时,部分患者的填塞率不高,且动脉瘤复发率高。为此,国内外临床医生想出多种办法来改善,如栓塞后利用微导丝检查、球囊辅助,但皆因技术难度过大、流颈速度过快或循证研究获益不明显等原因而无法普及。
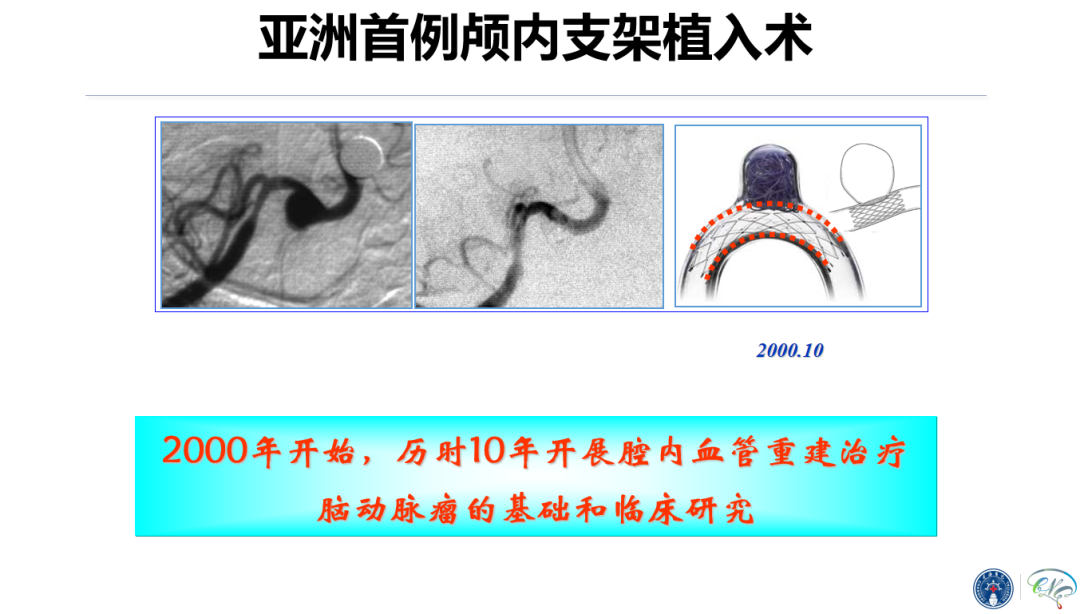
2000年,刘建民教授团队在前人的基础上,创新性的完成了亚洲首例应用冠脉球扩支架治疗颅内梭形动脉瘤手术,为此类患者提供了诊疗术式新选择。来自团队的后续研究也证实使用颅内支架+弹簧圈技术不仅使颅内复杂动脉瘤的微创介入治疗成为可能,而且疗效大幅提升。
在此之后,支架在弹簧圈的栓塞治疗中得到了广泛应用。同时,为了解决更复杂的动脉瘤,支架重叠技术、Y型支架技术、支架串联技术等多种支架策略相继被提出和应用,解决了部分临床难题。但这些技术往往操作复杂、复发率高且费用高昂。
“这时候就回到了我们创新的原点——创新一定是要去解决某个时间点、一个具体的、特别重要的问题。”
此时,临床研究发现支架与血流动力学之间存在关联,即支架放得越多,金属覆盖率就越高,对血流动力学影响就越大。与此同时,刘建民教授在有关前交通动脉瘤愈合病例的研究中同样发现支架能改变血管形态,最终改变动脉瘤的正常构式。
在一例复杂动脉瘤介入治疗方案的思考中,刘建民教授提出问题:
针对这样一个病例,怎样的金属覆盖率才能实现既能使动脉瘤愈合,又不影响被覆盖的分支血管的血流?
带着这样的问题,刘建民教授团队奔赴浙江大学开展血流动力学研究,并最终确定30%-35%的金属覆盖率是动脉瘤愈合的最佳支架孔率。
由此,刘建民教授带领团队开启了血流导向装置的自主研发。历经15年,无数的挫折失败,成功研发出国内首个国产血流导向装置,Tubridge血管重建装置成功问世。在此期间,为进一步验证Tubridge在大型/巨大型动脉瘤治疗领域中的疗效和安全性,刘建民教授同步联合了国内一众神经介入专家开展了全球首个颅内血流导向装置治疗颅内大型动脉瘤RCT研究——PARAT研究,证明Tubridge血管重建装置的疗效显著优于常规支架+弹簧圈(75%/25%),为全球提供了1级循证医学证据,使得血流导向装置的疗效终获确认。
此后,国内外血流导向装置的研发进入“井喷式”发展,种类愈加齐全。
“所以说创新不是突然从脑子里蹦出来的,一定是在临床实践过程中出现无法解决的问题时自然产生的。想创新的医生或工程师们一定要看到目前面临的问题。”刘建民教授总结道。
临床创新有时候“需要失败”
随着血流导向装置的研发进入深水区,具有不同结构和功能的血流重建器械相继出现。其中,WEB为代表的瘤内扰瘤装置的创新使得动脉瘤栓塞变得更便捷,有无限长期服用抗血小板药物,提高分叉部宽径颅内动脉瘤的安全性和有效性,改善患者的远期预后的效果而备受领域内专家认可。
在此期间,还有许多创新昙花一现。
如以三维网状结构为特点的Medina装置、以中段梭形膨大呈酒桶状为特点的Barrel血管重建装置、针对宽颈分叉动脉瘤结构设计的pCONus装置、以pCONus为基础改进而来的pCANvas瘤内血管阻断装置等,但这些装置大多因临床获益不够明显、并发症高、临床应用结果尚未明确等原因暗淡退场。
不仅如此,在此期间还有被行业内医生和工程师寄予厚望的生物修饰弹簧圈,同样也未被临床研究证实可以提高患者获益,使得全球范围内弹簧圈研发的方向重回铂金裸圈。
正在研发和开展生物修饰弹簧圈。
“但我说这些一方面是想让大家警醒,另一方面是想告诉大家创新中有失败是常事。有些问题不是你看到了答案才去创新,而是去创新了才有答案。有时候临床创新就是需要这样的‘失败’,只有这样才能让我们能清醒地看到不足,让我们知道哪些创新想法是不可行的,推动我们完善自我,不断进步。”
各领风骚、优胜劣汰,恰恰是医学创新生生不息的自然规律。而这一过程中,关键在于个人能否从失败中吸取教训,找到原因,得到启示,这样的失败才会成为到达下次成功的“助推剂”。
在这一方面,血管内介入治疗急性大血管闭塞性缺血性卒中(LVO-AIS)的临床研究领域的变化最具说服力。
动脉瘤血管内介入治疗器械在创新的同时,LVO-AIS介入治疗则在临床研究的推动下不断向前发展。自2014年来自全球的5项RCT研究证实了血管内治疗的有效性之后;便彻底改变了人们的治疗理念;引领 AIS 治疗进入支架治疗新时代。以提高再通率为目标,取栓支架、抽吸导管、球囊导引导管等各种取栓装置与评估软件在临床研究的推动下相继出现。我国临床医生在其中同样发挥了极大推动作用,来自中国的临床研究结果不断被采纳、创新得到广泛应用。

直到时间来到2015年,震惊中外的722事件爆发。
2015年7月22日,国家药监局发出临床试验数据核查公告,组织对已申报生产或进口的待审药品开展临床试验数据核查工作。当年8月,药监局主要领导发言说道,药物临床试验中的问题比较严重,不规范、不完整的问题非常普遍,不可靠、不真实、弄虚作假的问题确实存在,已经严重影响了药品审批的正常进行。
神经介入领域同样受到波及。
好在领域内专家积极自省,开始寻找中国临床研究与国外重大临床研究的差距,虚心学习,并愿意从头做起。就这样,以国外重大临床研究为标尺,国内神经介入专家建立起了一套统一标准、客观公正、独立判定和全程溯源的临床试验体系。2020年到2023年期间,由刘建民教授团队牵头开展的DIRECT-MT研究、Enchanted-MT研究及IRIS研究结果相继在NEJM,LANCENT上发表,以最严谨的研究过程得出最科学结论,回答了神经介入领域系列重大问题,极大地提高了中国神经介入临床研究在国际上的影响力。
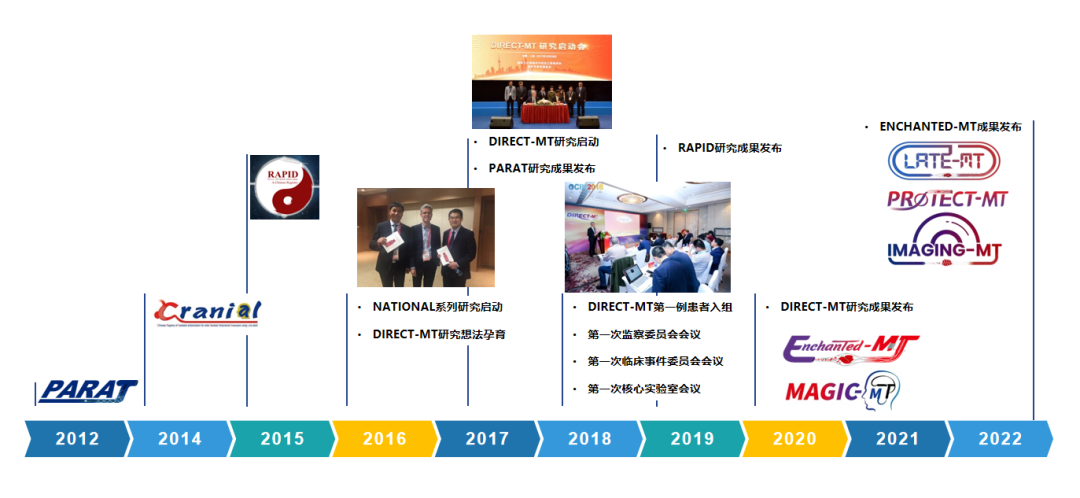
此后陆续发布及正在开展的MAGIC-MT研究、IMAGING-MT研究、PROTECT-MT研究、LATE-MT研究、IRIS研究结果,同样获得了国际认可,不断提振着中国神经介入临床研究的能力与信心……
一切才刚刚开始
到了今天,中国的治疗经验已经逐渐开始被国际同行认可、国内医生和厂家发明的器械也在不断得到同行的广泛应用。中国神经介入整体水平不断提高,规模从小到大,越来越多的人意识到临床研是医学科技创新的根本。
“技术创新与临床研究如同相互交织的DNA双螺旋结构,共同构成了医疗器械创新的基因。”
展望未来,刘建民教授指出,当技术水平发展趋同时,中国临床医生要看到全球神经介入同行面对的共性问题,此时唯有创新才能找到回答。而中国神经介入未来 10 年任务就是要由大到强、量质齐升;通过高质量循证研究,让来自中国的丰富的临床经验,转变为推动治疗革新的循证证据;进而创造出能被国际广泛应用的创新型器械。
“当然,风起云涌的介入时代才刚刚开始,可吸收材料、表面修饰、脑机接口、脑脊液引流、创伤性血管病、肿瘤介入治疗……随着人类对于介入技术的认识更加深入,微导管也将向着前所未有的诊疗领域挺进。以问题为导向,敢于创新,勇于迎接创新,在技术与临床研究的双螺旋中前行,这或许就是临床医学发展之路。”
——刘建民
