石蓓团队在Nature旗下《Signal Transduction and Targeted Therapy》发表最新研究进展
2023-11-23 20:04
2023年11月20日,遵义医科大学附属医院心血管内科石蓓教授团队在Nature旗下的《Signal Transduction and Targeted Therapy》(中科院1区,IF=39.3分)杂志在线发表了题为“Hypoxia-induced signaling in the cardiovascular system: pathogenesis and therapeutic targets”的论文。该文系统性的总结了心血管疾病中缺氧的研究历史和重要里程碑事件,并详尽且辩证地探讨了心血管疾病中缺氧信号的多维度的调控通路及其机制,以及有关心血管疾病中缺氧信号的治疗靶点和临床研究进展。


图1 广义上的“HIFs转换”
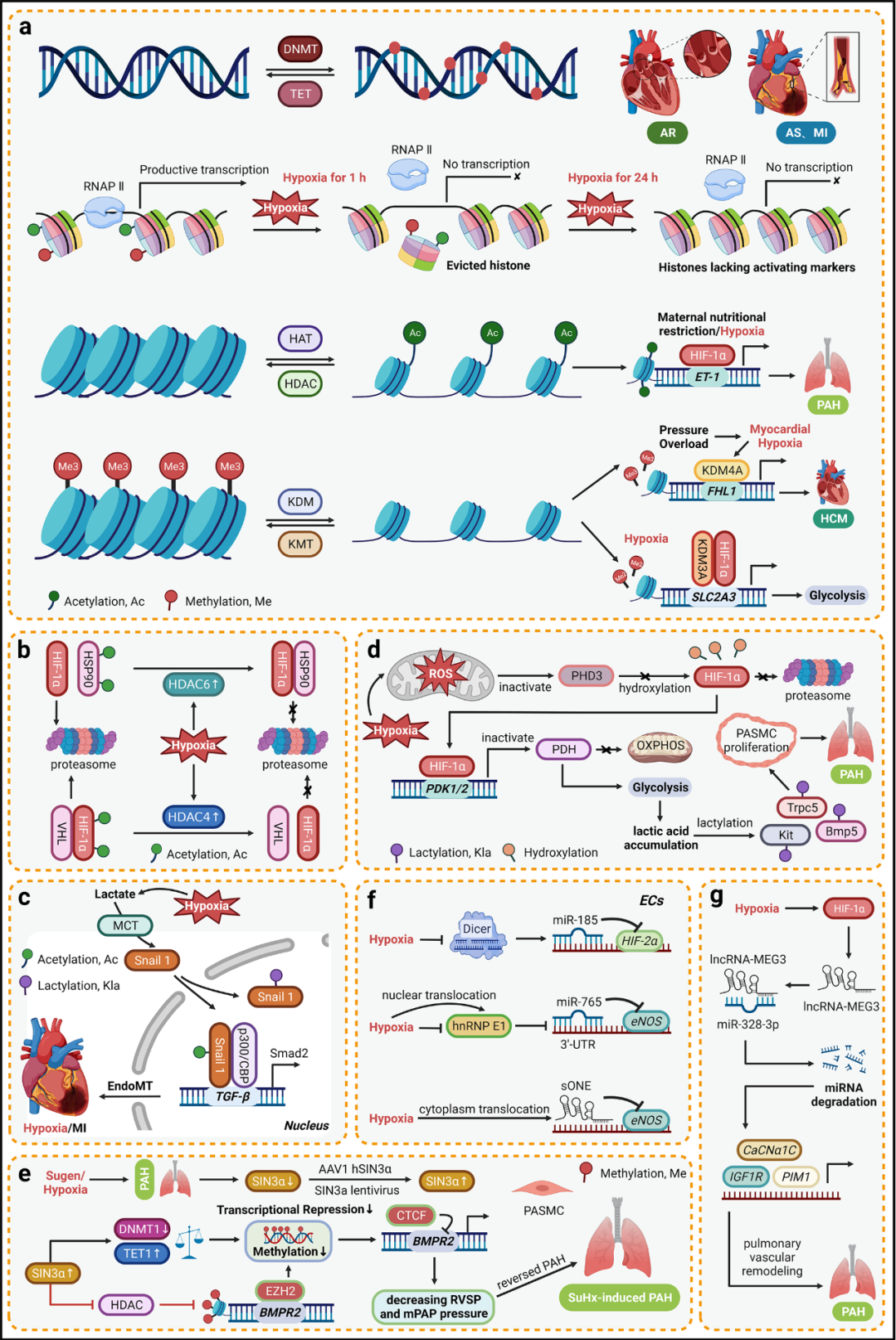
图2 心血管疾病缺氧信号的表观遗传调控

图3 心血管疾病中与HIFs相关的自然节律
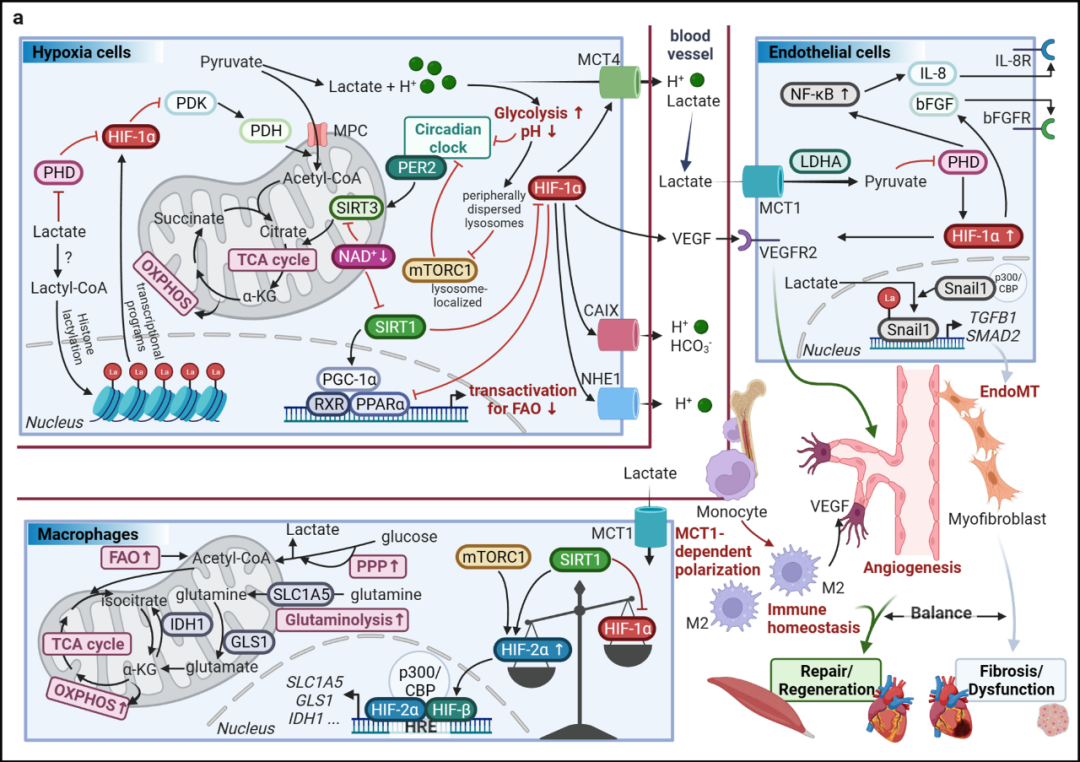
图4 HIF与乳酸穿梭
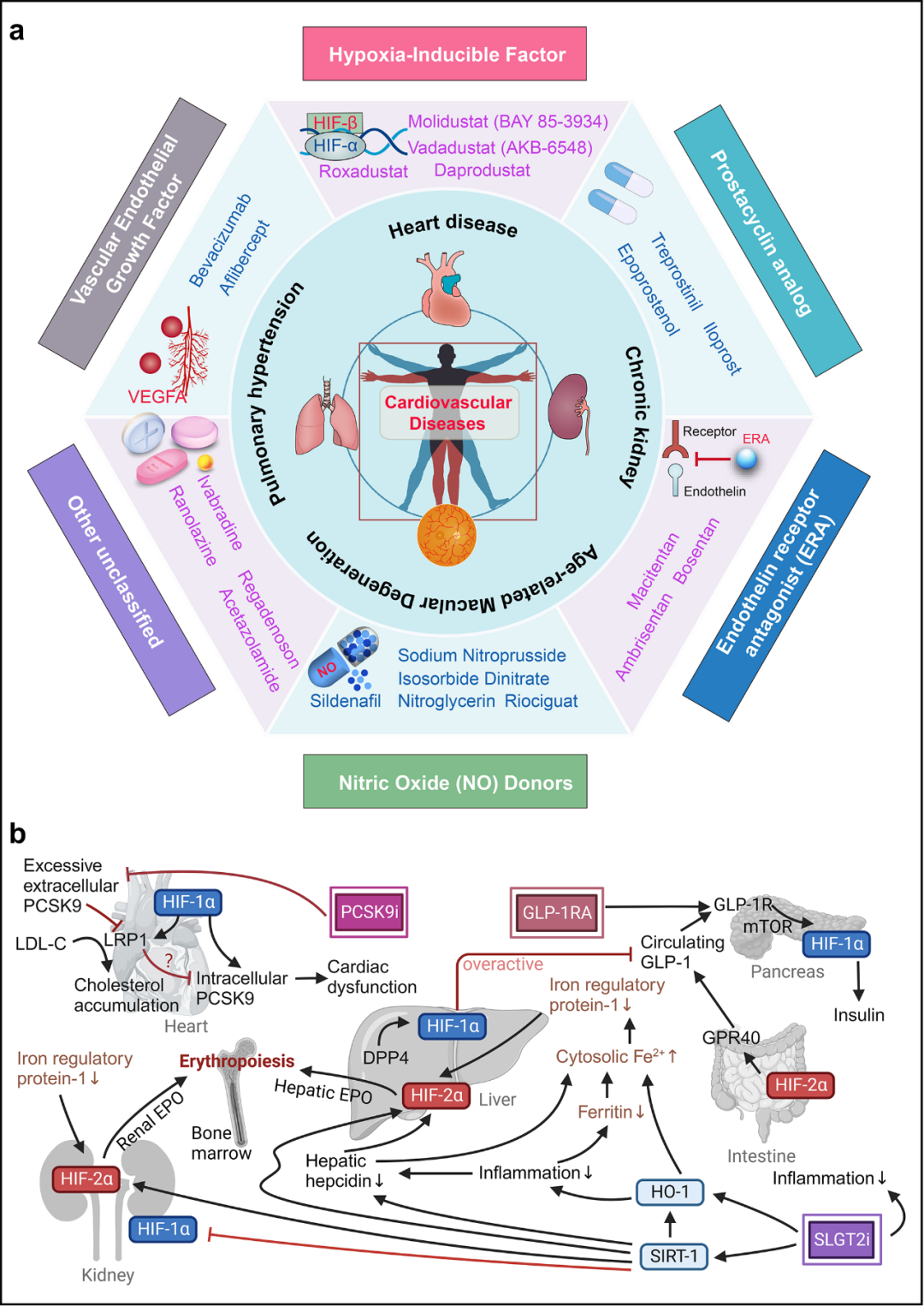
图5 心血管疾病中靶向缺氧信号通路的药物
论文链接:
https://www.nature.com/articles/s41392-023-01652-9
转自|365医学网