潘文志 周达新 李 伟
复旦大学附属中山医院
经导管缘对缘修复技术(TEER)目前正在我国普及开来。相对于经导管主动脉瓣置换术(TAVR),TEER操作要求更精细,夹子植入需要精准才能保证手术效果。既往,我们发表了《经导管缘对缘修复TEER:操作原理及基本原则》,对TEER操作的一些基本原理和步骤进行介绍[1]。
注:
SGC,可调弯导引导管(大鞘,包含手柄);
CDS,夹子输送系统(包含中鞘,包含手柄);
DC,输送导管(三鞘,包含手柄);
SS,可调弯鞘(中鞘的调弯导管,不包含手柄)。
一、房间隔穿刺点过前(主动脉侧躺平方)的处理方法
在操作MitraClip系统过程中的理想穿刺点应位于房间隔后部且位于二尖瓣的内侧联合水平(3D左房观在3点钟方向),但临床操作过程中或遇到穿刺点过前的问题(此时会出现“主动脉拥抱现象”,图1)。通过经食道心脏超声作为其侧视图,术者不难在其主动脉及二尖瓣二维长轴面上观察到这一现象,同样也可以利用正前三维成像观测(3D左房观太靠主动脉,2点钟方向)。此时因为CDS的操作轨迹是从前至后且其不垂直于二尖瓣瓣环平面(即主动脉拥抱现象,aorta hugger,图1),使得同时抓取双瓣叶存在困难。此时,术者往往需要在相对靠后的位置重新穿刺,或者采用难度较高的操作继续尝试治疗,如下:
①SGC旋转“+”;
②方通过“M” 使系统向前向3区移动;
③整体推动SGC可以使系统向1区移动。
但是,如果通过“M”旋钮已经到达极限,单SS调弯角度仍小于90°,该操作不宜使用,这或会导致调弯丝绷断。

A.房间隔穿刺点过前导致SS轨迹平行贴靠于主动脉(箭头所示)。
B.房间隔穿刺点过前最终导致二尖瓣瓣叶抓取困难,箭头所示为不完全瓣叶捕获现象。
C. 模型图示房间隔穿刺过前轨迹(在心尖方向上由后向前)。
D.为了纠正房间隔穿刺过前,在SGC旋转“+”方向(箭头所示)导致SS向后移动(无尾箭头所示)。
E.按下“A”,调整系统操作轨迹角度向前外侧(无尾箭头所示)。
F.按下“M”矫正套管偏移,使其保持在二尖瓣中心位置。
G.心超三维示由后向前方向轨迹的“主动脉拥抱现象”(无尾箭头所示)。
H.心超三维示经上述操作后矫正后理想的轨迹(无尾箭头所示)。
在使用MitraClip进行经导管二尖瓣修复术时,间隔穿刺的理想位置是很重要的。对于1区病变,穿刺位置可较低(距瓣环约3.5 cm);而3区的病变穿刺位置较高(距瓣环约4.5 cm以上)。故术者需要调整的穿刺点高度以配合实际临床操作时SS的工作长度。
当术者面对穿刺点过高位置不甚理想的临床场景时,由于SS工作长度及其进入左室能力受限,术者很难顺利地在一个或双瓣叶下定位夹子的两臂。当房间隔穿刺过高时,此时为了降低操作系统高度,术者需逆时针(向前)旋转SGC,然后通过在“A/P”旋钮上按下“P”来控制CDS位于二尖瓣后位置。由于按下“P”后会产生一个内侧方向的位移,术者可能需要释放“M”旋钮或推进SGC使操作系统向病变靶点外侧移动(图2)。
与之相反的是,在面对穿刺高度过低的临床场景时,术者操作夹子回退至左心房会非常困难。这种情况会导致左心房内臂定位困难,以及增加夹持器在二尖瓣瓣叶心房侧定位的难度。为了克服高度过低造成的困难,术者需顺时针旋转SGC(向后),在“A/P”旋钮上按“A”前向调整SS轨迹。由于按下“A”后也会产生一个横向的位移,术者需按下“M”或撤回SGC移动抵消这一效应。

A&B,虽然SS的方向正确,但是由于穿刺点过高,导致系统具体二尖瓣过远(箭头所示)。
C&D,逆时针旋转SGC导致前向移动(C图箭头所示)且降低高度(D图箭头所示)。
E&F,按下“P”来抵消CDS前向偏移,导致其后内侧移动(箭头所示)并完成跨瓣。
三、瓣叶间隙较大情况的操作技巧(拉链夹技术与快速起搏)
正如前文所提到的,在120度夹角时,MitraClip系统的夹持器下降至夹臂水平,从而更好地捕获瓣叶并获得更安全的夹持角度。对于瓣叶间隙较大的二尖瓣病变,推荐的方法是采用快速心室起搏(160-180 bpm)。术者在使用这种方法时,完全或接近完全心室停顿可以减少收缩偏移程度,从而更好地将夹持器定位于瓣叶上方(图3)。虽然部分术者出于类似的目的使用腺苷,但由于快速心室起搏在触发起搏和控制偏移的可靠性,临床上建议首选的方法是快速心室起搏。这种程度的控制不仅使术者能够准确和精确地捕获瓣叶,而且还有助于在超声心动图上采集瓣叶图像。
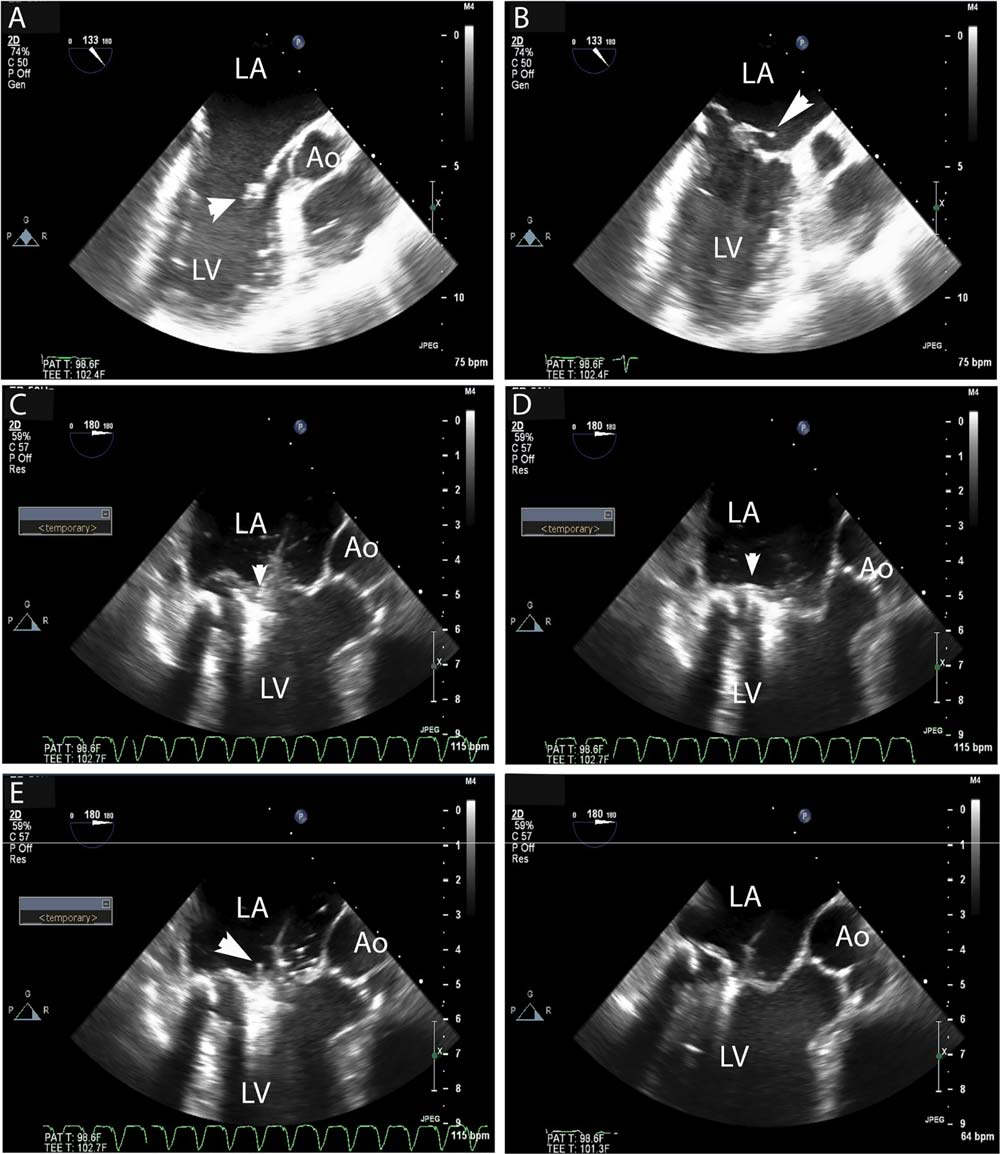
A.食道心超示二尖瓣粘液退行性变(箭头所示)。
B.收缩期可见巨大瓣叶间隙(箭头所示)。
C.快速起搏(心室率180bpm)导致心室停顿减少瓣叶间隙(箭头所示)。
D.持续起搏减少瓣叶间隙(箭头所示)。
E.该操作帮助夹持器位于瓣叶上方(箭头所示)。
基于此法放置的夹子的使目标病变相邻瓣叶距离更接近,从而通过操作二尖瓣夹进行瓣叶夹持。采取拉链夹技术时一般情况,从靠交界区开始放置第一个夹子(从边到中),因为交界处的瓣叶距离较近容易捕获瓣叶,但术者也可以A2-P2节段的中部开始在向瓣叶联合处移动(从中到边),主要是看哪个区域瓣叶距离更近。需要注意的是,采用此策略后,起始放置第一个夹子操作变得更容易,但通常不会显著减少二尖瓣反流。
该操作对于术者放置多个夹子的能力及熟练度有较高的要求。另外,二尖瓣口面积相对较小的患者可能不适合采用这种方法。
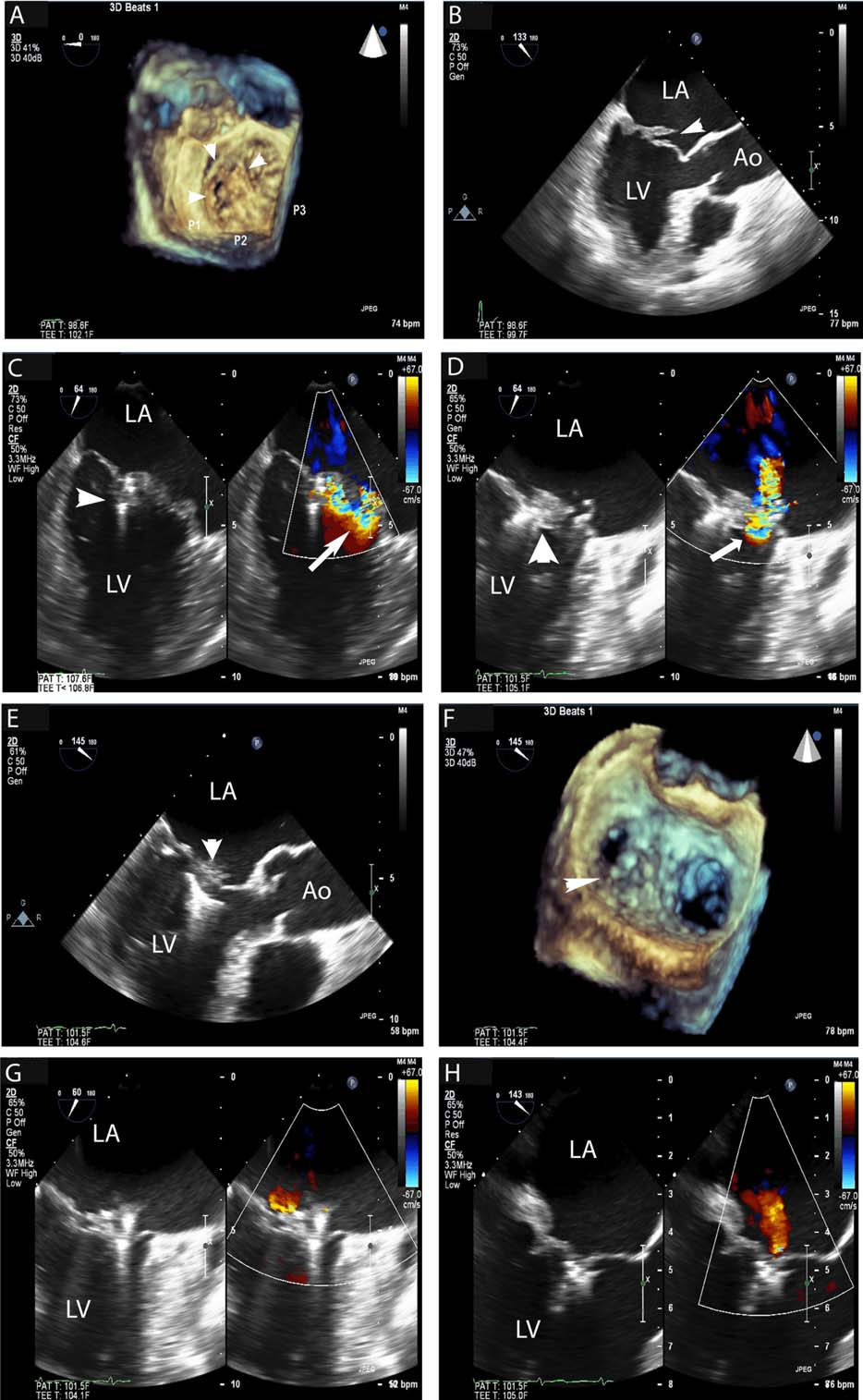
A.三维超声显示后叶存在连枷状瓣叶病变(箭头所示)。
B.该连枷状瓣叶病变与巨大瓣膜间隙相关(箭头所示)。
C.一枚夹子先放置于远离主要病变的位置(无尾箭头所示)但无法显著控制反流(箭头所示)。
D.第二枚夹子放置于第一枚的外侧(无尾箭头所示)且显著控制反流(箭头所示)。
E.放置两枚夹子后,在瓣膜反流间隙位置出现了更长的瓣叶组织(箭头所示),需要放置第三枚夹子。
F.三维超声示第三枚夹子置入后的组织桥结构(箭头所示)。
四、放置多个夹子的策略选择及技巧
TVT注册研究数据显示,45%的病例需要放置多个MitraClips夹子 (其中2个MitraClips夹子占38%,≥3个 MitraClips夹子占7%)才能显著改善二尖瓣反流。
如果放置一个MitraClip夹子不能有效治疗二尖瓣反流,建议采取以下策略:
1. 术者必须确定第一个MitraClip夹子是否可以显著减少二尖瓣反流。如果不是,在不增加经二尖瓣跨瓣压差的前提下(建议>5 mm Hg)放置第二个夹子是可行的。夹子应该尽量平行、贴近放置,避免力学干扰。
2. 如果第一次MitraClip无法显著减少二尖瓣反流,上文提及的“拉链夹”技术可以应用于此情景。
3.一般来说,将第二个MitraClip夹子放置到A2-P2段比瓣叶联合处更容易,所以一般从边到中放置。
在TVT登记的病例中,只有7%的病例需要放置两个以上的MitraClip夹子。放置第三个MitraClipVR可能会带来更大的挑战,但策略选择及技巧同上。为了避免第一个MitraClip夹子和后续夹子之间的相互作用,应在较近的位置在夹臂不大于60度的情况下将CDS推进左心室。
五、移除未使用的CDS系统
在某些情况下,术者可能需要这样做通过SGC移除CDS。导致此类的临床场景可能原因包括:CDS出现技术问题或夹子出现问题;无法有效的显著减少二尖瓣反流。术者在操作时需要先把CDS拉入SGC,这是因为如果从房间隔单独拉回CDS或可导致心房撕裂或器械脱落。
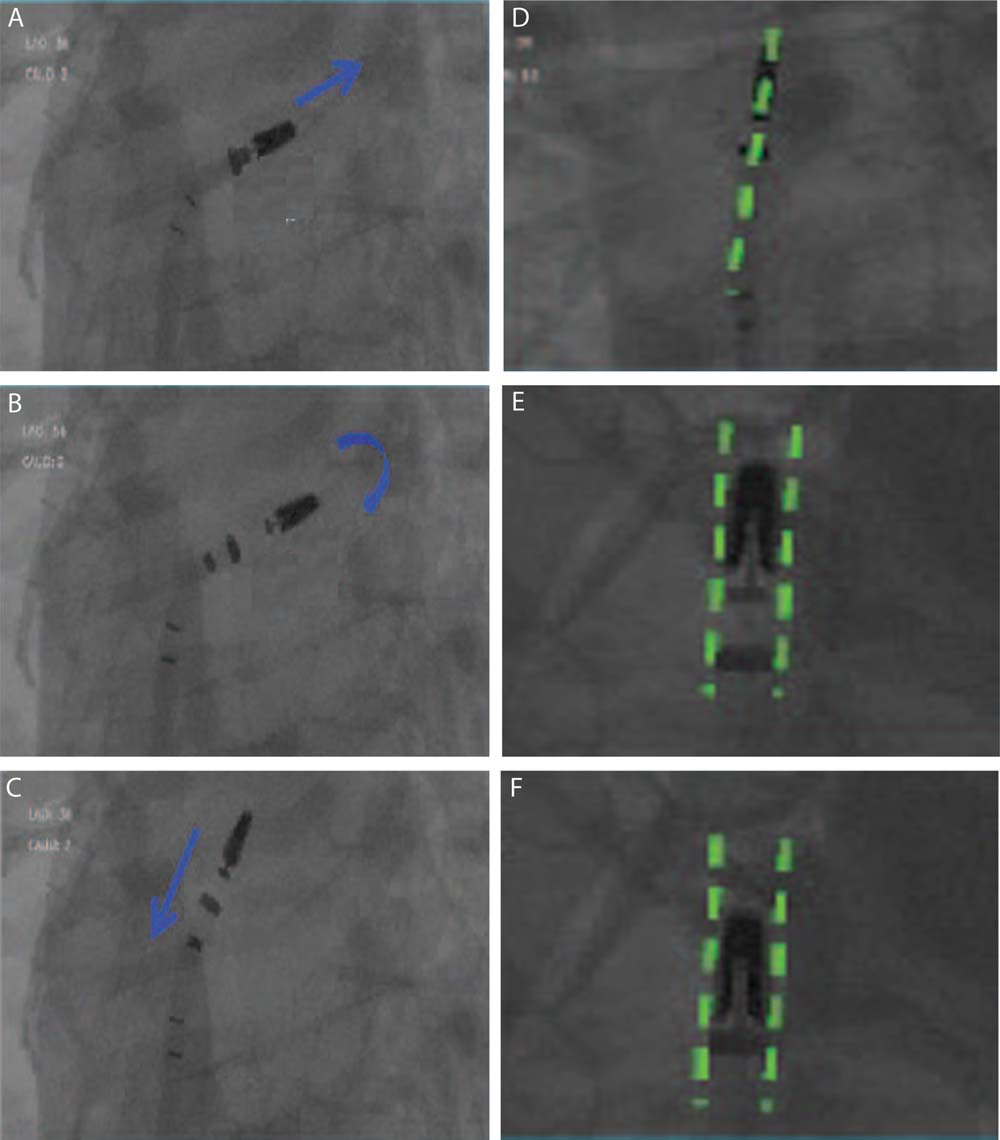
A.升高夹持器并完全关闭夹臂。
B.向前推动导管手柄旋转夹臂校正位置,注意放射线标志环示夹臂与SS分离状况良好。
C.小幅度调整“—”回直SGC完成同轴回退(箭头所示)。
D&E.旋转夹臂使其平行于SGC所在平面(虚线)。
六、防治MitraClip系统腱索缠绕的相关技巧
二尖瓣腱索缠绕是MitraClip操作过程中主要的并发症,因此需尽可能避免。MitraClip腱索缠绕会导致心脏损伤、二尖瓣反流加重、MitraClip系统移动困难及外科手术干预。
首先术者需尽可能的预防腱索缠绕,包括房间隔穿刺时定位适宜的高度,避免鞘管弯曲超过90度(即谨慎调控“M”旋钮),在捕获瓣叶前保持MitraClip系统在心房内及瓣叶上方,特别是在调转钟向时。当术者将MitraClip系统推进至过瓣水平并进入左心室后,所有操作应尽可能在小幅度内完成以避免腱索缠绕。
如果上述操作未成功,提高gripper,并逆着反步骤操作导致腱索缠绕的操作,可能有效。 如果上述操作均未奏效,需考虑外科手术干预。 如果患者存在外科手术禁忌, 只能将夹子原位释放在人工腱索处(此或为处理腱索缠绕的最后手段)。
参考文献:
1.潘文志,周达新,葛均波。经导管缘对缘修复TEER:操作原理及基本原则https://www.163.com/dy/article/H82U7K3B0514S7S5.html.
Sorajja P, Kanda B, Bae R, Pedersen WA, Gössl M. Maneuvers for technical success with transcatheter mitral valve repair. Catheter Cardiovasc Interv. 2018;92(3):617-626.