金楚心声|武汉大学中南医院王斌教授团队解读《心力衰竭的三尖瓣反流管理》
2023-09-14 19:00

导语
越来越多的证据表明,严重的三尖瓣反流(TR)会影响多种心血管疾病的临床结局。晚期TR患者的表现突出反映了我们对该疾病的低估以及当前医疗管理的缺陷。考虑到孤立性三尖瓣手术相关的高住院死亡率以及经导管治疗器械的选择和探索,JACC杂志于2023年8月发布的这篇最新综述展开了关于TR的病因分类、生理学等的论述,并探讨了经导管治疗的选择以及哪些人可能从器械治疗中受益,以期提高生存率和减少心力衰竭的住院率。
亮点
●严重TR与心血管疾病的不良预后相关。
●晚期发现严重的TR会导致高死亡率,特别是手术治疗。
●经导管装置治疗会影响患者的功能和生活质量。
●药物或介入治疗是否能提高生存率或心力衰竭住院治疗尚不清楚。
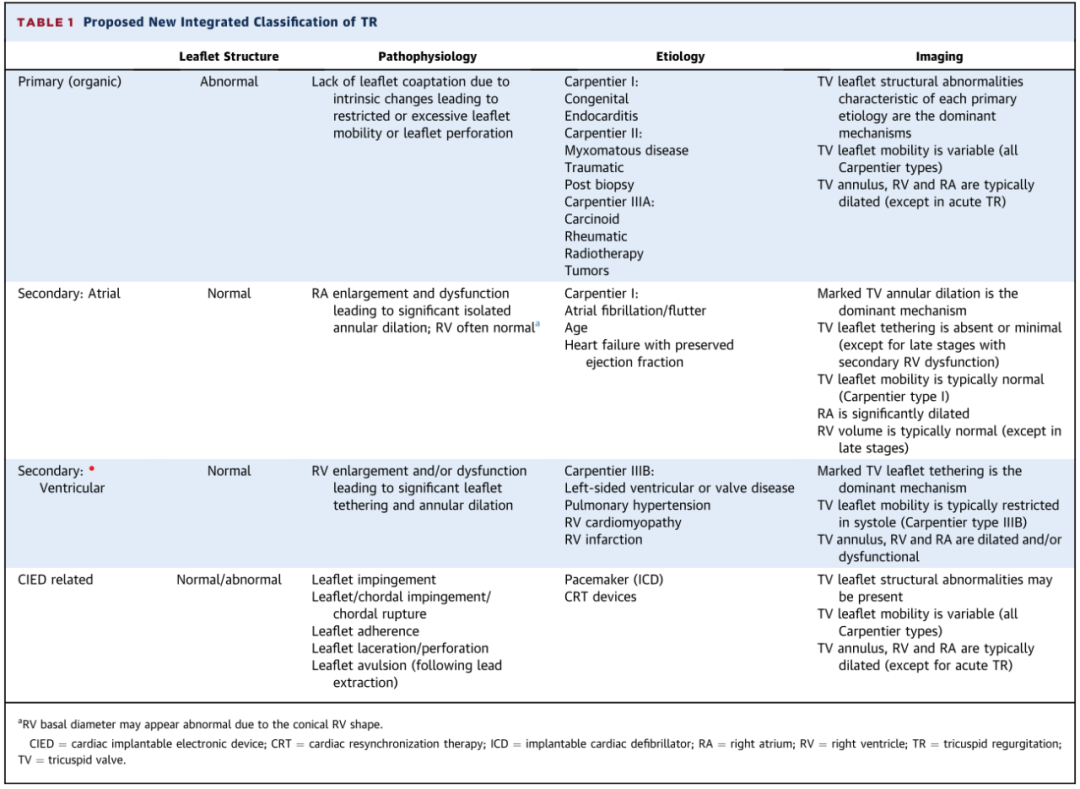
TR病因分类
TR的生理学

TR患者的临床表现
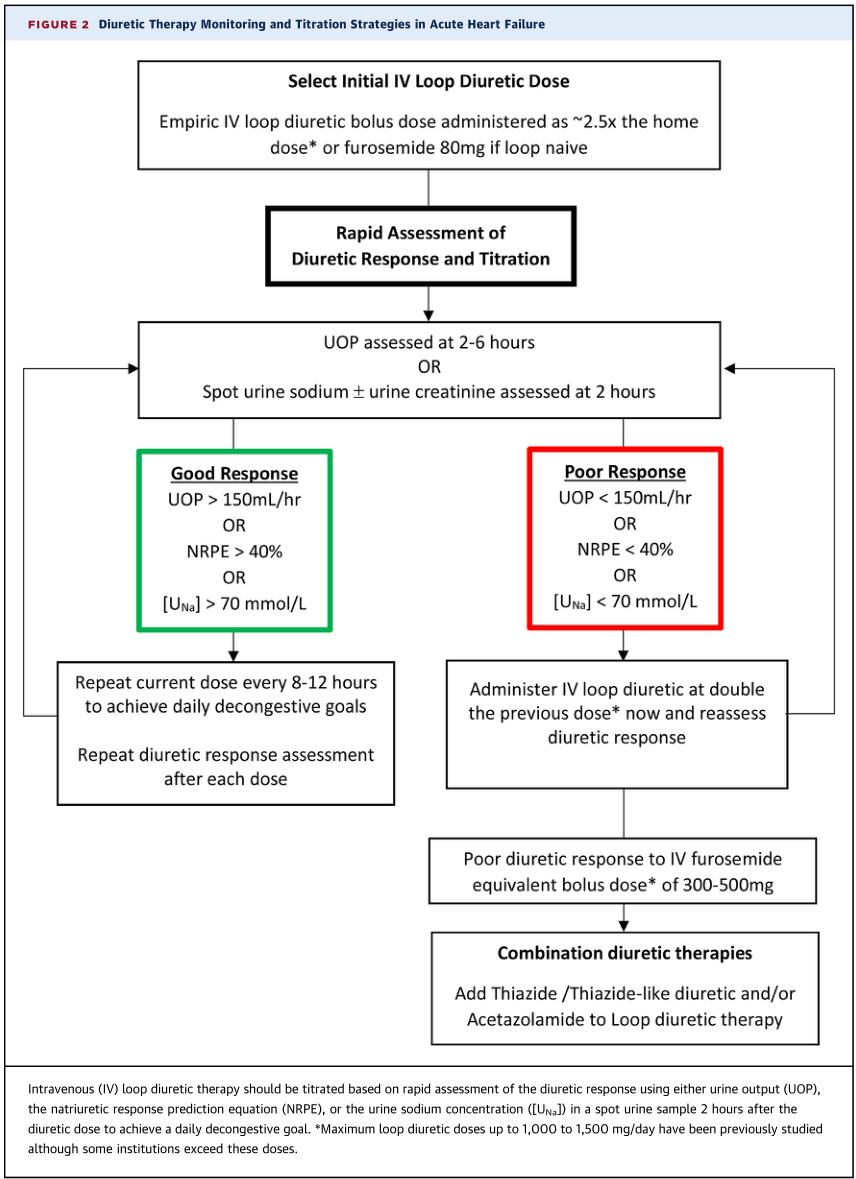
以指南为指导的TR医疗管理
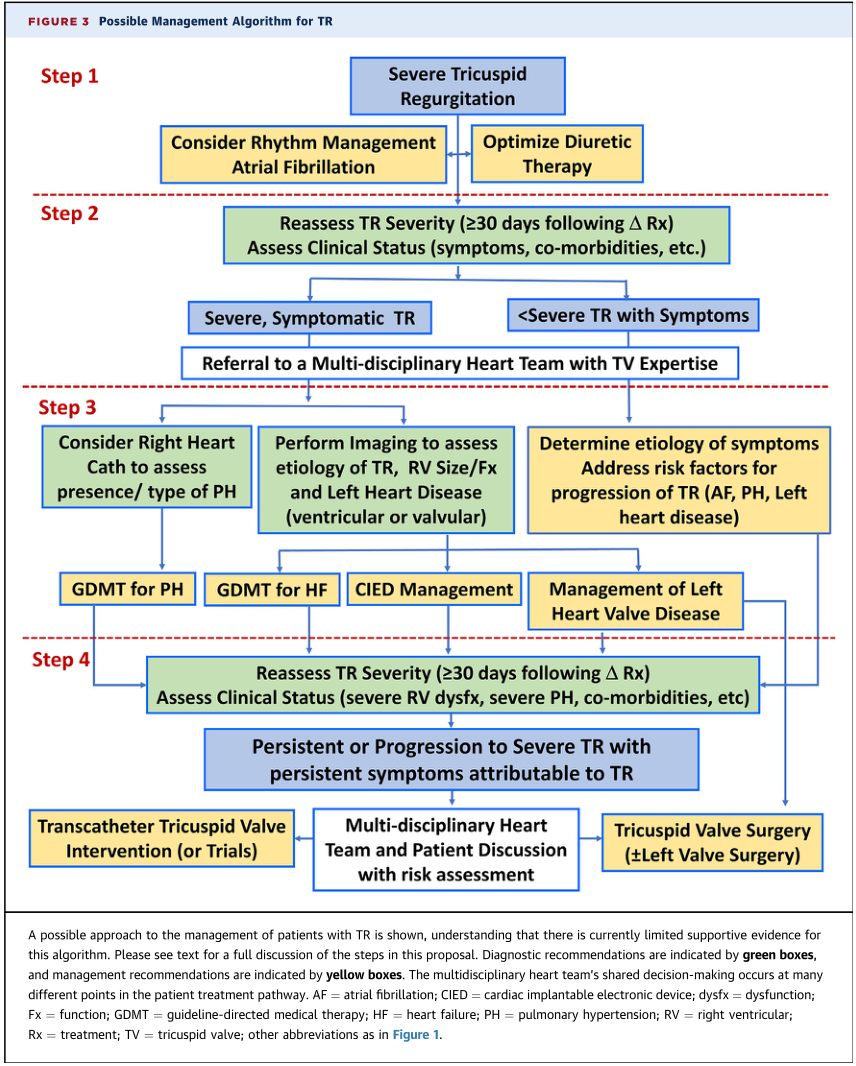
经导管装置治疗患者的选择

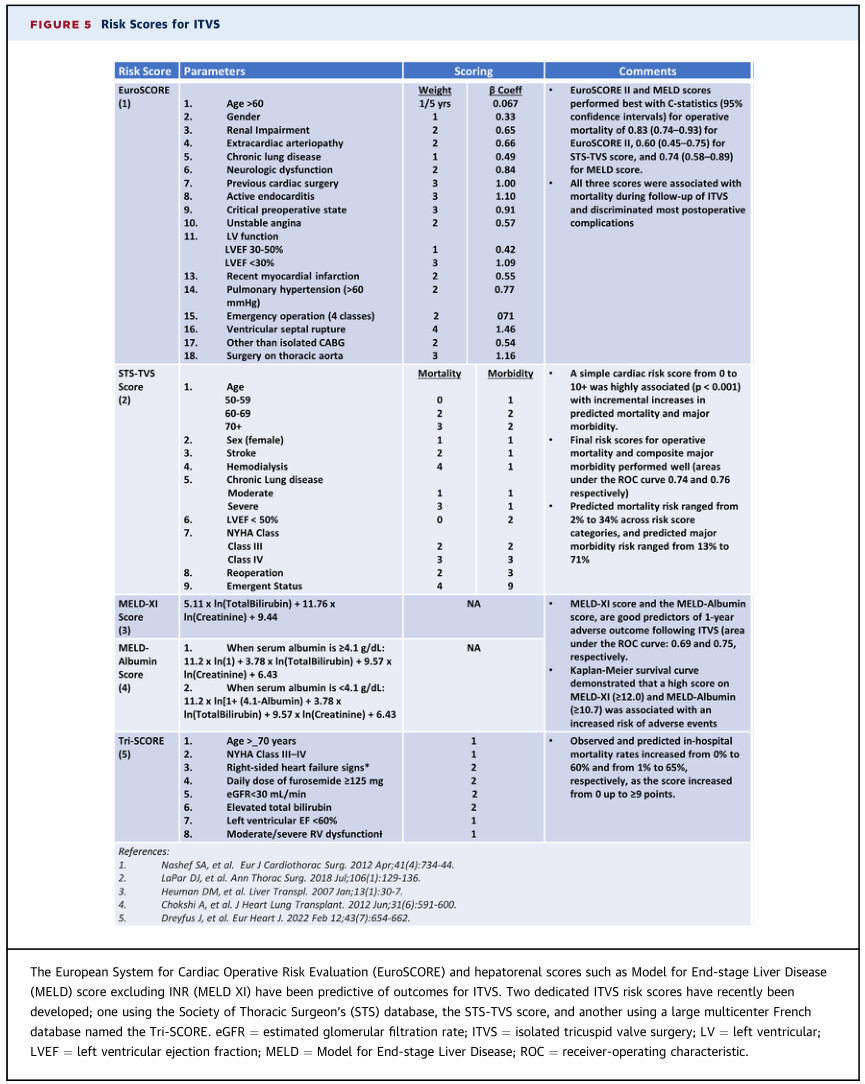
经导管装置治疗TR
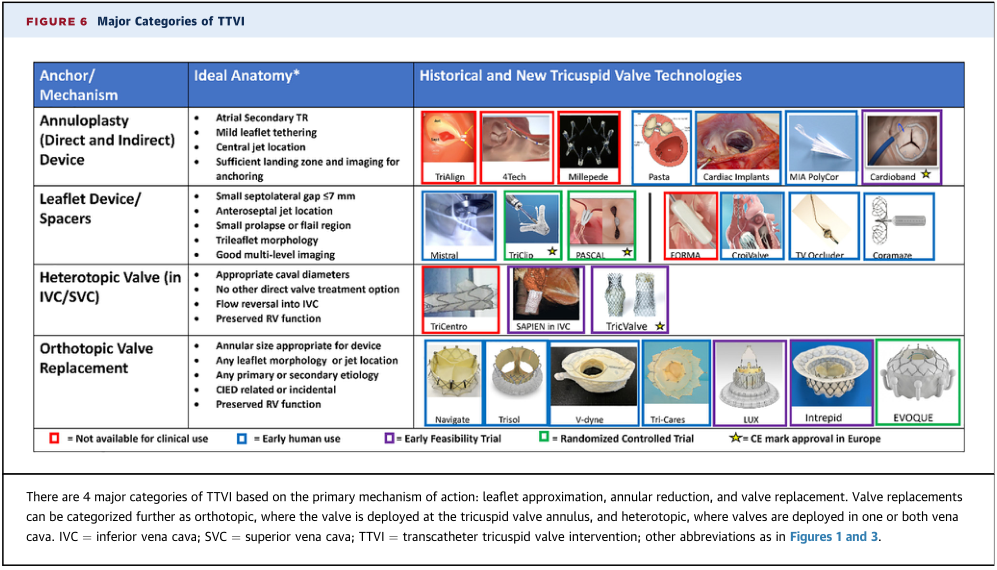

结论

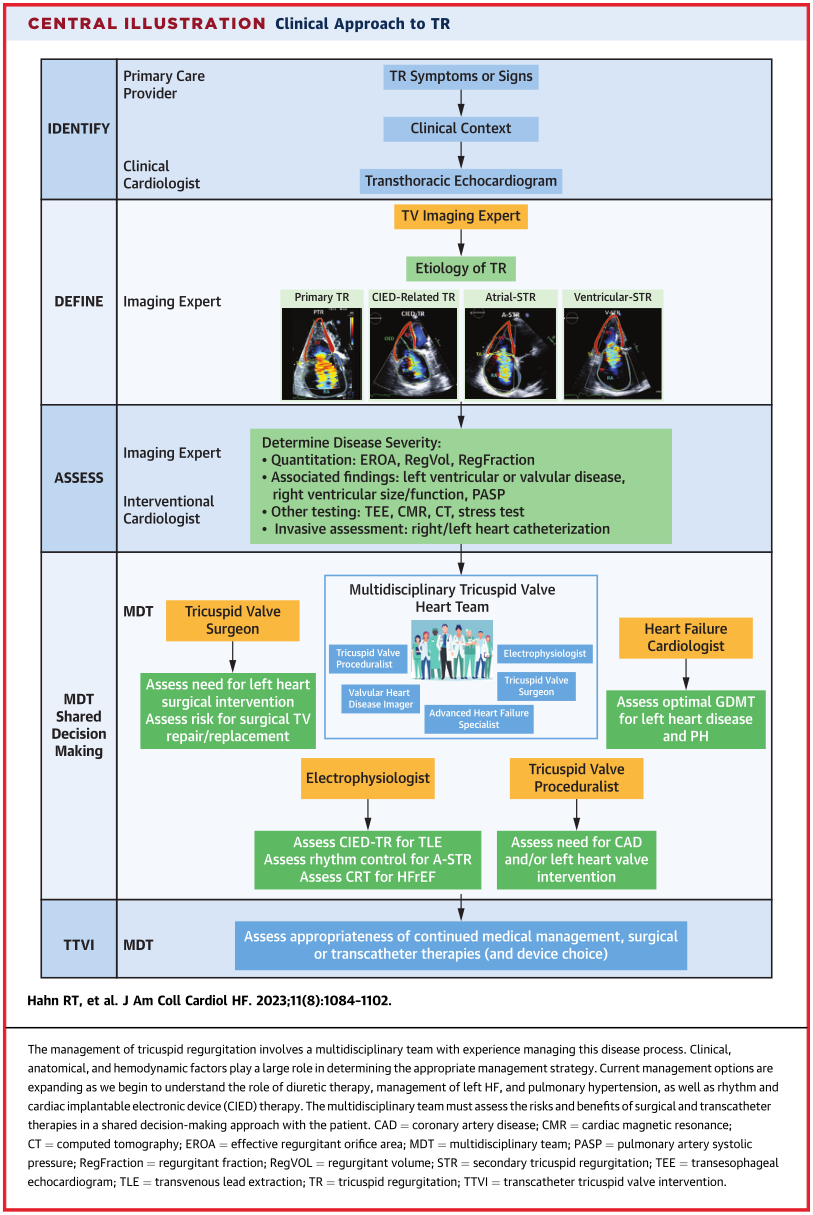
专家点评
参考文献:
Rebecca T Hahn, Michael I Brener, Zachary L Cox et al. Tricuspid Regurgitation Management for Heart Failure. JACC Heart Fail, 2023 ,11(8 Pt 2):1084-1102. doi: 10.1016/j.jchf.2023.07.020.