潘文志 周达新 葛均波
复旦大学附属中山医院
经导管缘对缘修复技术(TEER)是继经导管主动脉瓣置换(TAVR)之后结构性心脏病最热门的技术,目前已经在全世界逐渐推广开来。随着器械改进、研究进展及经验积累,业界对TEER的认识也逐渐加深,笔者曾经写过多篇对TEER的深层剖析的文章(见附录1-5),本文谈谈笔者对经导管二尖瓣缘对缘修复(M-TEER)最新的认识。
一、 TEER的技术优劣性
笔者在国内首先对M-TEER进行定义:M-TEER是一项基于外科二尖瓣缘对缘修复术(SEER)的经导管介入技术,其采用二尖瓣夹合装置,经股静脉或心尖途径植入,在超声及X线引导下夹住二尖瓣反流区的前、后瓣叶并使之接合,使心脏收缩期时瓣叶之间间歇减少或消失,而舒张期时瓣口变成双孔或多孔,从而达到减少或消除二尖瓣反流的效果[5]。TEER按照手术路径可以分为经股静脉TEER和经心尖TEER,其锁定装置分为自锁的、机械锁定和闭合环锁定三种。
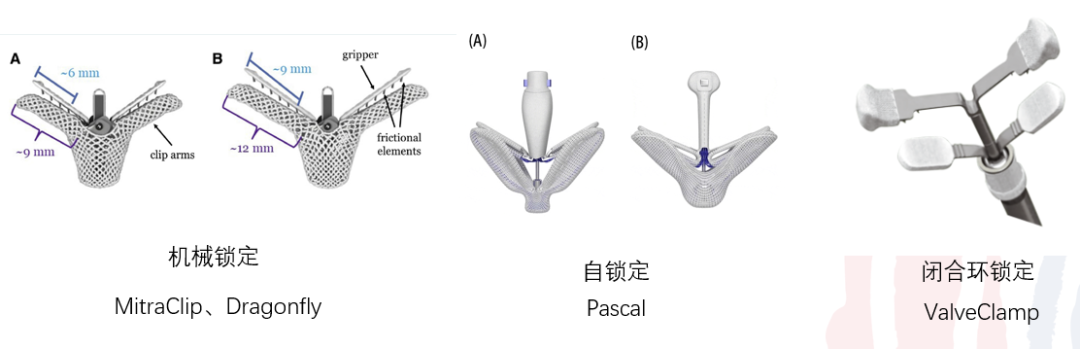
图1. TEER 器械的分类
20多年来,十余种二尖瓣介入技术路线相继进入研发及临床试验,但目前只有TEER真正成熟应用于临床,受到指南推荐,这说明TEER技术是最具有优势,是外科技术中最适合导管化的技术路线。早在1993年,Ottavio Alfieri教授就在其论文中提出SEER是非常适合导管化的外科二尖瓣治疗技术。TEER技术的优点在于:①靶点精确、植入物少:二尖瓣夹子几乎只作用于病变部位,没有太多附属结构,不会对心脏其他组织结构及功能形成干扰,这相对其他二尖瓣介入器械有明显优势。宋光远教授曾经说,TEER是最生理的二尖瓣反流介入技术,从这个角度讲是有道理的。笔者曾通俗的表达一个观点,“TEER技术就是把病变的二尖瓣瓣叶消除,把一个二尖瓣变成了两个二尖瓣,这两个二尖瓣工作方式和术前比没有被改变,没受到干扰,非常生理,不会担心远期会出现新的问题。” ②原理简单,容易导管化。外科缘对缘仅需把病变瓣叶和对侧瓣叶缝合,使用几个垫片缝合几针就可以完成。这种简单方式使得即使容易导管化。同时,瓣叶附近操作空间充分,干扰结果少,在操作上容易实现。③医学原理可靠,以不变应万变。SEER一开始是在其他外科修复技术无效情况下,作为后补技术出现的。因此,无论是是简单病变还是复杂病变,均可使用SEER(或TEER),可以说是“以不变应万变,一招鲜吃遍天”。
那为何现在SEER在目前实际临床上较少应用?这是因为SEER或多或少会引起瓣口狭窄,外科发明了一些更好的修复技术如腱索植入、瓣叶切除、瓣叶延长技术等,这些技术在有效治疗反流同时不会引起瓣口狭窄,因此替代了外科缘对缘修复技术。但这并不意味着SEER效果不好,或者是SEER对复杂的病变没效果,只能说是一个“优中选优”的结果。然而,TEER又不完全等同于SEER,甚至有超越SEER的可能,所谓“青出于蓝而胜于蓝”。外科的手术是在心脏停跳情况下进行,手术效果无法实时的真实的验证,即使是使用术中注水试验作为验证手段,但是还是无法真正模拟的复跳后的心脏的血流动力学情况。而TEER技术是在心脏跳动、实时超声引导下进行,可以通过精细的反复调节夹合位置及深度,验证并提高手术效果,这一点时SEER无法比拟的。SEER技术的优势在于可以联合瓣环成形,保证其远期效果。然而,这是个双刃剑,联合瓣环成形势必明显降低瓣口面积(导致瓣口面积小于15 cm²),这是外科讨厌SEER的重大原因;而不联合瓣环成形,可以保留更多瓣口面积,因此实践中,TEER术后严重瓣膜狭窄情况是非常罕见的。另外,瓣环成形效果保证主要是在于预防房性功能性二尖瓣反流发生,以及出现新的脱垂之后有个缓冲保护作用,但这两种情况可以通过对房颤管理、以及对新的脱垂干预来补救。关于夹子周围是否有瓣叶僵硬、微损伤而导致新的反流产生的担心,已经被多项病理学研究否定。
二、 外科缘对缘修复研究及其启示
在一项单纯SEER的研究 (没有放成型环)中[6],大部分患者为退行性二尖瓣反流(DMR)行,共纳入81例患者,经过4年随访,总体上,89% +/- 3.9%患者无需再手术;术后残余0-1级患者,94% ± 5.8%无需再手术,保持良好状态;而术后残余2+以上的,无需再手术率为67% ± 32.7%。研究还显示瓣环有钙化者(N=32)无需再手术概率低于瓣环无钙化(N=49),这说明瓣环钙化起不到限制瓣环扩张而保护反流复发作用,也说明了单纯SEER不联合瓣环成形效果可靠性。12例交界区附近病变的患者无一例复发,这提示交界区TEER长期疗效可能更好,并且对瓣口影响更小。
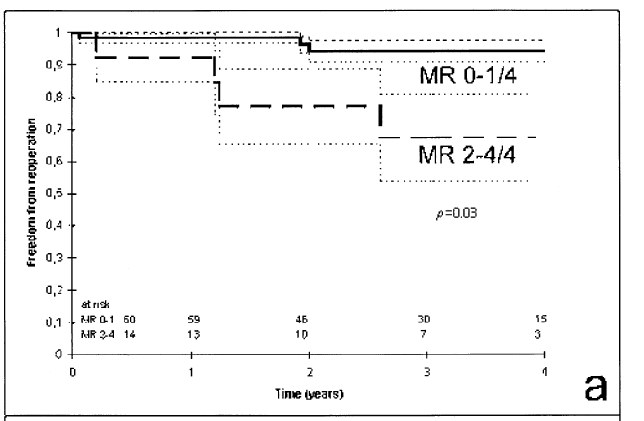
图2.外科缘对缘术后不同级别(0-1 VS 2-4)残余MR 中期再次手术的差异
另外一项对139例DMR患者行SEER(均联合放置成型环)的长期随访研究显示[7],第17年,患者免于复发(MR≤3+)的比率为80.2% ± 5.86%,免于再手术的概率为89.6% ± 2.74%,结果还是相当不错,看起来不差于其他外科修复技术。多元回归分析显示,术后MR>1+是MR复发的最强预测因素(HR 7.4)。
一项对305例DMR行外科二尖瓣修复长期年随访研究显示,10年时术后MR 0+和1+患者免于再手术的概率相近(94% vs 90%),明显高于MR 2+患者(56%)。有无成型环患者,术后进展至中度以上的MR,存在着明显差异。这个研究是针对所有外科修复技术的患者,其结论和另外一篇对SEER长期随访研究一致,也是显示术后即刻0-1+,应用成形环,是长期良好效果预测因素;研究同时也显示,交界区病例SEER效果更好,中期随访几乎无复发[8]。
以上这些外科研究对于TEER策略的启示:对于DMR患者,应该追求更完美手术效果,使得术后即刻MR 0-1+;其次,应该选择瓣环扩大不明显患者,由于TEER不联合般瓣环成形术,可以预料到瓣环扩大明显患者长期预后较差;非中央区的患者,特别是交界区患者,受到远期瓣环扩大导致复发影响小,效果更好,并且对瓣口面积影响小,从长期预后看,反而是TEER合适人群,当然这些患者TEER手术难度是增加的。
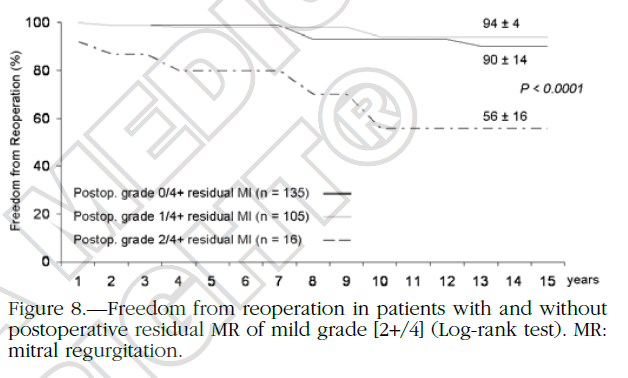
图3. 术后残余MR和再手术的关系
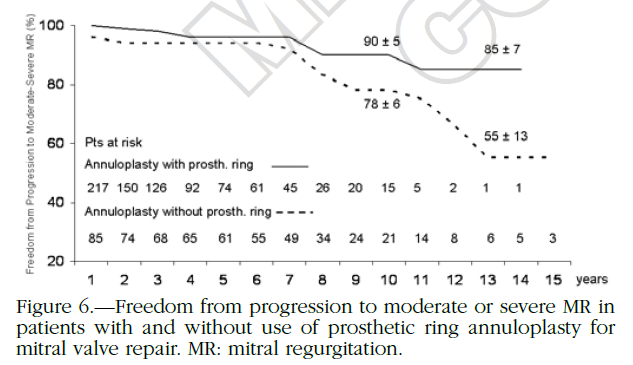
图4. 外科修复术后有无成型环患者进展至中重度MR的差异
三、 DMR患者的手术策略
Atsushi Sugiura将TEER术后反流复发归纳为4个机制,包括单边脱落(SLDA)、瓣叶部分滑脱、瓣叶撕裂以及心脏功能性改变(瓣环扩大、心室扩大导致腱索拴系等)[10]。笔者认为,长期来讲,还可能包括新发瓣叶病变,如新发脱垂、腱索断裂等,但这相对少见。他们研究还显示,术后即刻MR≥2+是反流复发预测因素。这一点和前文所述外科结果一致。残余分流≥2+对DMR患者TEER术后远期预后有明显影响,这点也被其他一些研究证实。因此,对于DMR患者行TEER,应该追求更完美即刻效果,使得术后即刻MR≤1+。
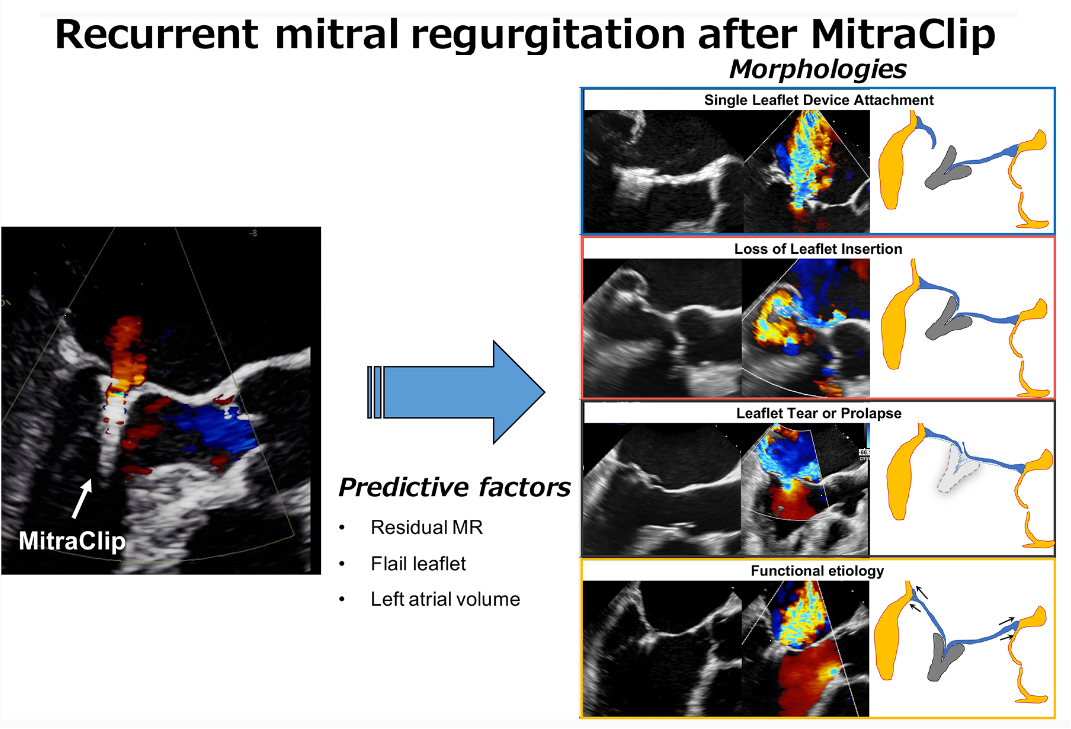
图5. TEER术后MR复发的机制
Hirotomo Sato提出了对合缘增强指数的概念,如图5. 对合增强指数(augmentation in coaptation )= (a+b)-(g+f),实际上就是等于瓣叶被夹子额外夹进去的瓣叶长度总和(需要去掉17mm的自然对合)。他们研究纳入183例患者,大多数为DMR患者,研究显示,该指数是患者手术效果最强力预测因素(AUC=0.9)。病人残余分流0-1+,对合缘增强指数为7.3mm;术后残余分流≥2+,对合缘增强指数为3.0mm。同时,术后即刻二尖瓣瓣环面积缩小也是即刻效果预测因素。这个研究提示,在不引起瓣叶撕裂的前提下,应该尽量多的夹合更多瓣叶,这样可以增加夹子两边瓣叶的对合,同时一定程度缩小或者预防瓣环扩张,保证长期效果。这也是在DMR患者中,MitraClip XTR往往效果更好的原因。这也可能是TEER和SEER一个差别点,SEER的术中无法反复调整对合量,并且是否可以达到TEER这样高度的对合不得而知。实际上,世界上完成SEER手术量很少,仅有少数几个医生有相关经验,如何提高SEER疗效也没被研究清楚,相反,如何提高TEER近远期疗效将在今后被全世界广大医生联合充分研究清楚,TEER疗效有望高于SEER。
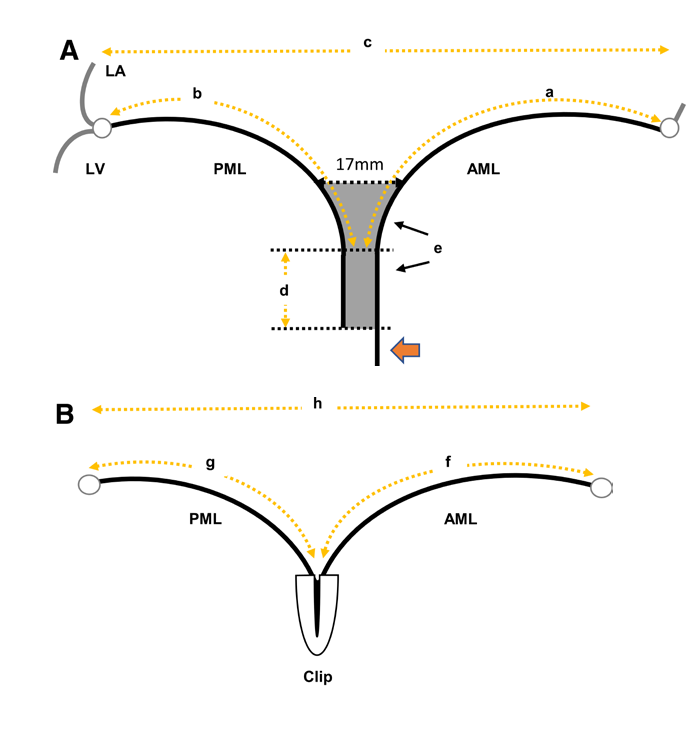
图6.对合增强指数(augmentation in coaptation )= (a+b)-(g+f)
对于DMR患者TEER术后产生的高压差,不同研究有些差异,但总体上还是倾向于有影响,引起病人心衰再住院,影响病人运动能力。Benedikt Koell研究显示[11],术后高压差(≥5mm)患者6分钟步行距离没有改善,术后高压差患者再住院发生率高,死亡率也有增高趋势(P=0.09)。美国TVT两万例DMR患者的研究随访显示,TEER术后高压差对死亡率无影响,但对再住院有明显影响(图7),术后轻度或无MR但压差5-10mmHg的患者在住院率高于术后中度MR患者,虽然两者生存率无差异,提示术后高压差影响大于中度反流。然而,另外一项研究结论不同,显示了提示术后中度反流影响大于高压差[12]。
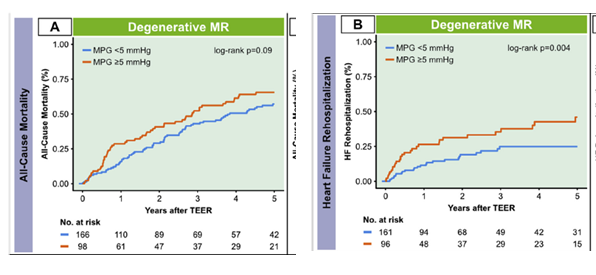
图7. DMR患者 TEER术后高压差对预后的影响
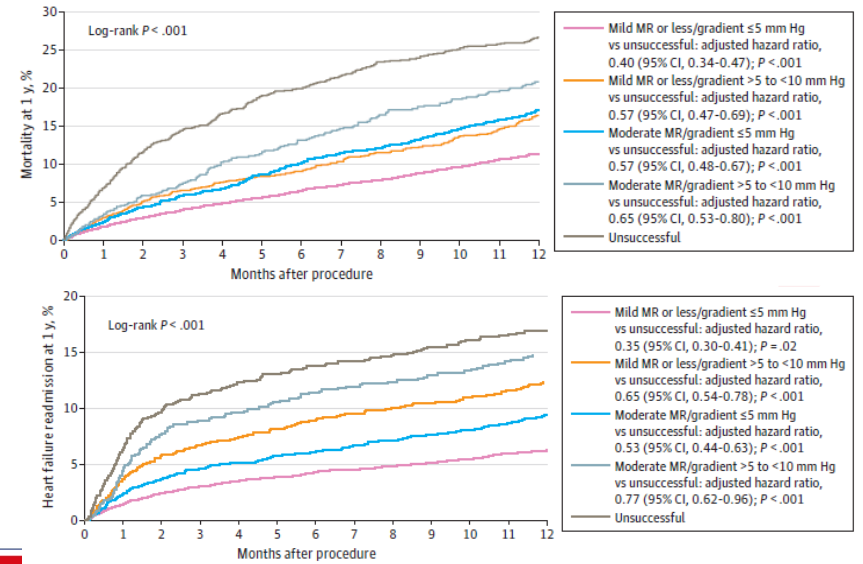
图8. DMR患者 TEER术后残余分流、压差对预后的影响
综上所述,笔者对于DMR患者的TEER手术策略建议为:①长驱直入:在不引起瓣叶撕裂、瓣膜狭窄情况下尽量多夹瓣叶,尤其是病变侧的瓣叶,保证即刻及远期效果; ②斩草除根:尽量夹掉脱垂瓣叶,保证远期效果,补充二夹有时候是需要的;③尽善尽美:反复尝试,尽量把反流减低到0-1+,保证远期效果;④避免狭窄:术后高压差对患者预后有影响,应该尽量避免。
四、 FMR患者的手术策略
对于FMR患者,在策略上与DMR患者可能较大不同。并且,外科手术在这方面经验也较缺乏,无论是AFMR或者是VFMR,目前瓣膜指南也仅是把外科手术作为IIB类的推荐。数项研究显示,对于FMR患者,术后MR 1+与2+患者预后无差异,但明显好于MR≥3+者(图9, [14])。另外一项研究显示,FMR患者术后MR1+与2+患者预后差异的见于左心不扩大、右心功能良好患者,对于左心已经扩大或者有心功能不良者两者无差异。而关于FMR术后的高压差,几个研究均认为对患者的预后及症状均无影响[11, 16]。
综上所述,建议FMR患者TEER手术策略:适可而止,不求完美,允许中度残余分流,或者轻度压差,这并不影响患者预后和症状,同时这个策略可以避免过多操作导致的并发症以及减少手术时间。但是,AFMR这个特殊类型患者是否另有差别,目前还不得而知。其实,根据FRANK-STARING机制,适当残余分流可能提高心脏收缩力,防止术后低心排反应发生,从某种意义上对心脏功能低下者是个保护因素。
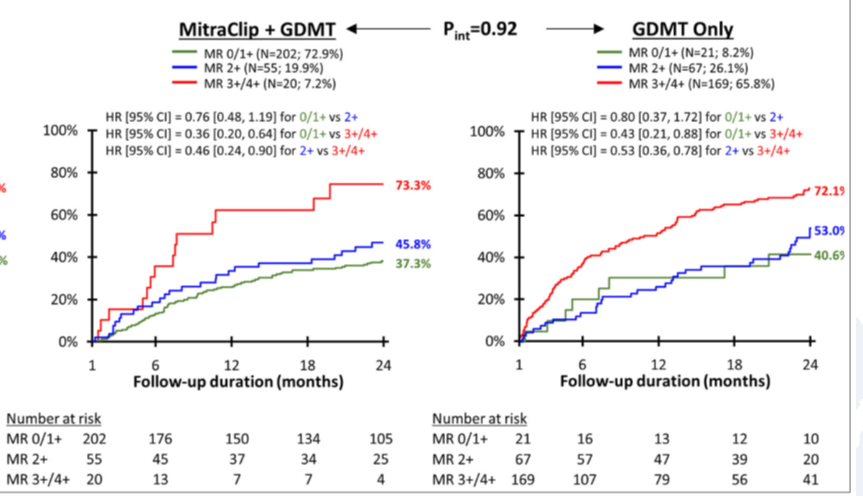
图9. COAPT研究中FMR患者TEER术后残余分流对预后影响
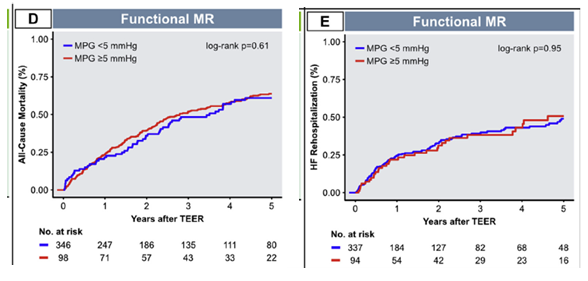
图10. FMR患者TEER术后高压差对预后影响