
李妍 亓秉超
空军军医大学唐都医院
研究背景
心力衰竭是严重危及生命的临床综合征。全球成人心衰患病率超过2%,预计到2030年将达到3%。据统计,心衰患者1年死亡率约20%,5年死亡率达50%。2022 年AHA/ACC/HFSA最新的心衰指南按照左室射血分数及病史将心衰分成射血分数降低型心力衰竭(Heart failure with reduced ejection fraction,HFrEF)、射血分数轻度降低型心力衰竭(Heart failure with mildly reduced ejection fraction, HFmrEF)、射血分数改善型心力衰竭(Heart failure with improved ejection fraction, HFimpEF)和射血分数保留型心力衰竭(Heart failure with preserved ejection fraction, HFpEF)。HFpEF即射血分数≥50%的心力衰竭,这类心衰患病率越来越高,已占所有心力衰竭住院的一半以上。HFpEF的病理生理改变包括异常的心肌舒张、血管功能异常以及心肌僵硬度的改变,这些变化最终导致了心脏舒张功能障碍。针对HFpEF的疾病建模和药物筛选平台对改善患者生存质量、降低患者死亡率至关重要。尽管动物模型有很多优势,但是有一个严重的缺点,就是不能完全模拟人类的生理病理状态。
类器官(Organoids)技术,被Science 杂志评为年度十大技术,被The New England Journal of Medicine 杂志评价为成为优良的人类临床前疾病模型。类器官指利用成体干细胞或多能干细胞进行体外三维培养而形成的具有一定空间结构的组织类似物。尽管,类器官并不是真正意义上的人体器官,但能在结构和功能上模拟真实器官,能够最大程度地模拟体内组织结构和功能,并能够长期稳定传代培养。人们已经成功体外培养出脑、肠道、胃、肝脏、胰腺等类器官,但由于心脏有多层组织组成,结构复杂,在心脏类器官领域一直进展缓慢。
研究内容
1. HFpEF心脏类器官的建模
研究人员使用人源的诱导多能干细胞(Induced pluripotent stem cells, iPSC),将其分化为心肌细胞、内皮细胞、成纤维细胞和平滑肌细胞,然后将其组装成多细胞的三维心脏类器官。通过加入疾病模拟因子,包括肥胖、炎症、糖尿病和高血压等诱导因子,建立一个基于HFpEF的高通量药物筛选平台。使用血管紧张素II和内皮素1处理以模拟高血压状态;使用高葡萄糖和胰岛素剥夺处理以模拟糖尿病状态;使用白介素1β和干扰素γ处理以模拟肥胖相关的炎症状态。研究人员按照高内涵和高通量将类器官分为三类。第一类是具有100万个细胞的大型类器官,这种类器官具有环形结构,能够通过仪器检测其收缩力和被动延展性,常被用于高内涵生理评估。第二类是具有10万个细胞的小型类器官,常被用做心血管类器官和集成式机械传感器。第二类是具有1万个细胞的微型类器官,常被用于观察分析显微镜下的微观结构。
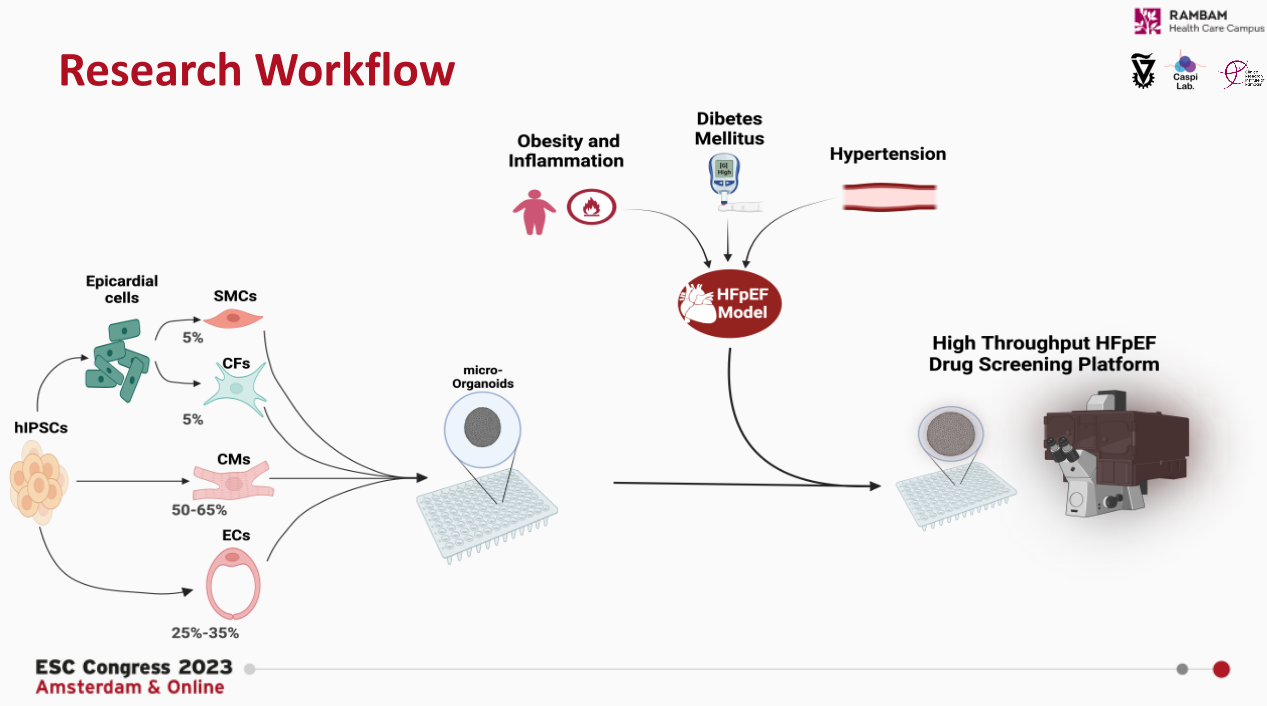
图1. HFpEF类器官建模过程
2. 对HFpEF心脏类器官的致病性评价
基于心脏类器官平台,通过分析心脏舒张期,研究人员发现与空白对照相比,HFpEF组(模拟肥胖+高血压+糖尿病状态)显著增加了心脏舒张期时长,而单一处理组无显著变化。另外,HFpEF组心脏类器官长度显著增加,且明显高于其他单一处理组,提示出现了心肌细胞肥大。在结构方面,研究人员使用Masson染料对心肌类器官切片进行染色以评估其纤维化程度,发现HFpEF组胶原(蓝色)含量显著增加,而在其余组几乎看不到任何纤维化表现。这些结果表明多种致病因素的协同作用下能够模拟出HFpEF的心脏类器官模型。
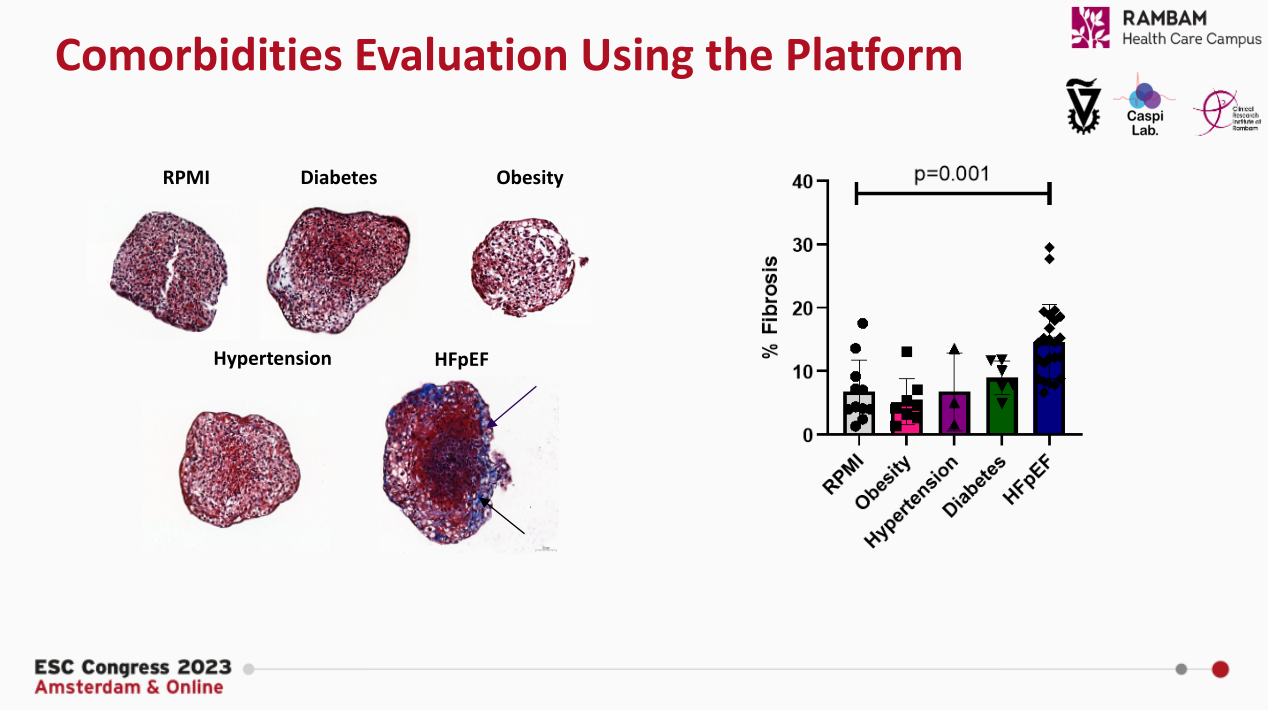
图2. HFpEF类器官致病性评价
3. 对HFpEF心脏类器官的细胞层面评价
HFpEF的一个重要表型是心脏舒张期的延长,这其中一个潜在的机制是钙信号受损。在Ca2+成像实验中,研究人员观察到了钙信号延迟。免疫荧光实验也证实了HFpEF组类器官中心肌细胞出现明显的肥大。

图3. HFpEF心脏类器官的细胞层面评价
4. 对HFpEF心脏类器官的代谢评价
异常的能量代谢是HFpEF的一个重要标志。研究人员用氧耗量和活性氧作为评价线粒体功能的指标。结果发现,HFpEF模型会导致细胞ATP含量下降,并造成活性氧产生增多,氧化应激的增加促进了一氧化氮合酶(NOS2)的转录,导致XBP1剪接缺陷,加重了HFpEF表型。

图4. HFpEF心脏类器官的代谢评价
5. 对HFpEF心脏类器官的组织层面评价
研究人员通过拉伸试验发现,在相同的拉伸长度下,HFpEF类器官需要更大的外力作用,这意味着HFpEF类器官僵硬度的增加。舒张期的延长和NT-proBNP的升高也是HFpEF的重要表型。实验发现,与对照组相比,HFpEF类器官有更长的舒张期和更高的NT-proBNP。
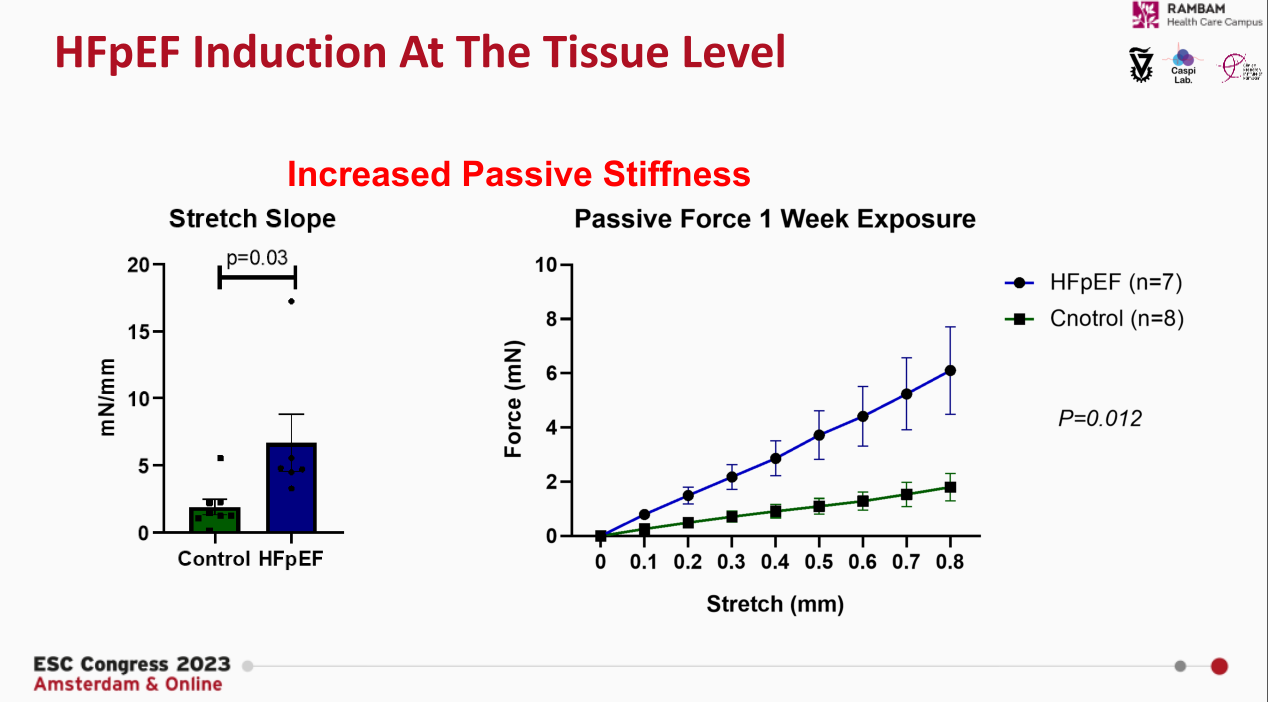
图5. HFpEF心脏类器官的组织层面评价
专家点评
亓秉超博士
类器官比传统的2D培养更具有优势,可以显示接近生理状态的细胞组成和行为。类器官通过扩增技术,可以保持基因组的稳定性,适用于生物样本库和高通量筛选。与动物模型相比,类器官能够降低实验的复杂性,适用于实时成像技术,更精准地研究人类疾病发生发展的各个阶段。心脏包含多种组织和细胞类型,由于其复杂的结构和发育机制使得在体外模拟心脏发育是一项困难的工作。Oren Caspi教授团队通过将hiPSCs诱导分化成多种心脏组成细胞,同时给与多种致病因子处理,构建出新型的HFpEF的类器官模型。通过对其致病性评价、代谢功能评价、细胞和组织学评价,证实了该心脏类器官能够作为研究HFpEF强有力的工具,对推行心血管领域药物研发具有重要意思。
李妍教授
基础研究中常用的动物模型与人类在解剖、生理及病理等方面都存在很大差异,在临床结果方面也有不同,这极大地限制了基础研究成果向临床转化。类器官的出现已有十年之久,但由于心脏结构的复杂性,直到2020年具有活性的心脏类器官才被首次构建出来。HFpEF患病率越来越高,占比超过所有心衰患者的50%,明确HFpEF的发生发展过程,阐明潜在的分子机制至关重要。Oren Caspi教授团队构建的HFpEF新型心脏类器官是目前已知的能够较全面地模拟HFpEF疾病的病理状态的类器官平台,可高度模拟人体心脏功能并实现心脏收缩、钙瞬变、信号传导及分子生化指标检测,适用于基础科学研究、心脏药物筛选和心脏毒性评价。当然,深入探究HFpEF中多种细胞相互作用、评估单一致病因素具体角色、鉴定更多的HFpEF诱导因素,进一步完善HFpEF类器官模型,仍然需要进一步探索。