
李建朝
河南省人民医院
德国莱比锡大学莱比锡心脏中心的首席研究员Holger Thiele教授在2023年ESC大会公布了最新的研究成果。
2018 ESC血运重建指南对ECMO在内的循环辅助设备推荐级别为Ⅱb/C,用于急性冠脉综合征合并心源性休克的短期循环支持。

根据IABP-SHOCK II研究结果明确指出:欧洲指南建议不要常规使用IABP(III/B级推荐)。
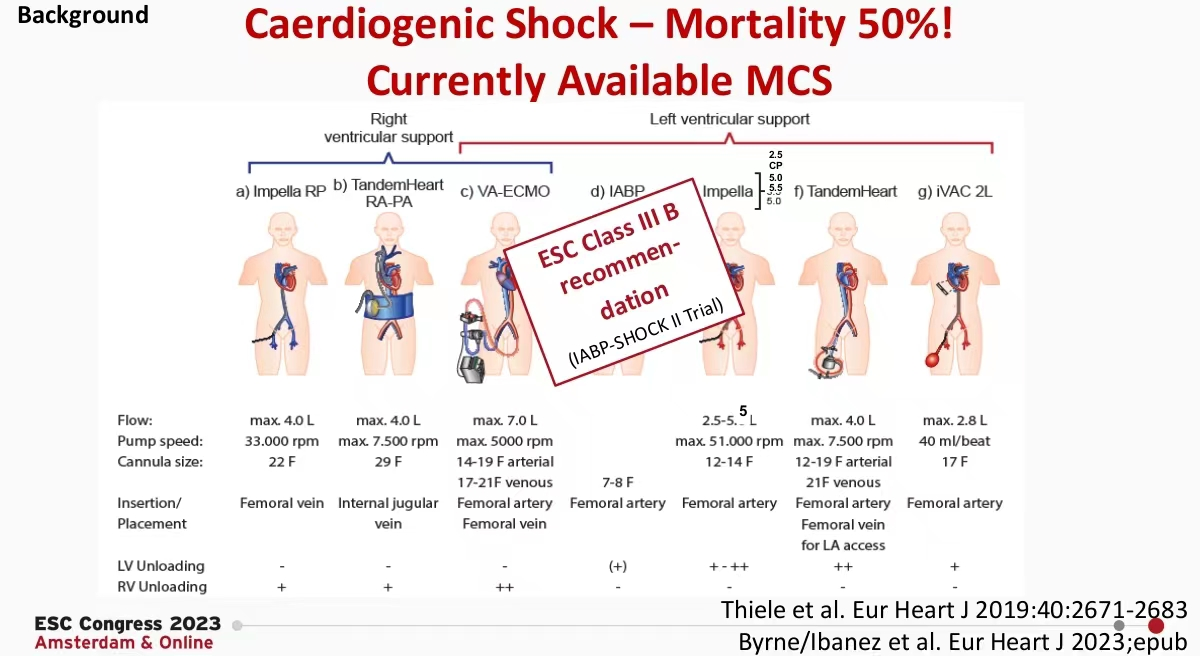
针对ECLS-SHOCK项目Holger Thiele教授也发表了最新的研究成果:早期体外生命支持(ECLS)并不能提高计划早期血运重建的急性心肌梗死并发心源性休克患者的生存率。1
心源性休克是急性心肌梗死住院患者死亡的主要原因。2循证治疗仅限于对罪犯病变的立即血运重建。3-5然而,死亡率仍然很高,在30天内达到40-50%。2为了维持严重休克时的血液动力学稳定以及改善预后所做的持续努力,已导致主动机械循环支持设备的使用的增加。特别是,近年来,静脉-动脉体外膜肺氧合(VA-ECMO)也称为ECLS的使用量增加了10倍以上。6
ECLS与其他设备不同的是能够提供全面的循环和呼吸支持。然而,关于ECLS在心源性休克和急性心肌梗死患者中应用的证据仅限于观察性研究和三项小型随机试验。7-10血液动力学支持的潜在益处可能会被设备相关的局部和全身并发症(包括出血、中风、肢体缺血和溶血)的巨大风险所抵消。
ECLS-SHOCK是第一项研究ECLS对急性心肌梗死并发心源性休克患者死亡率影响的随机试验。11来自德国和斯洛文尼亚44个中心共登记了420名计划进行早期血运重建的急性心肌梗死和心源性休克患者。参与者的中位年龄为63岁,19%为女性。患者被随机分配到早期ECLS加常规药物治疗组(ECLS组)或单独常规药物治疗(对照组)。

观察的主要终点为30天时的全因死亡。次要终点包括机械通气时间、血液动力学稳定时间和是否需要肾脏替代治疗。安全性终点包括中度或重度出血和需要干预的外周血管并发症。
最终分析共纳入417名患者。对于30天时出现全因死亡的主要终点,ECLS组209名患者中有100名(47.8%)和对照组208名患者中的102名(49.0%),相对风险[RR]为0.98;95%置信区间[CI]0.80-1.19;p=0.81)。
ECLS组机械通气的中位持续时间较长:ECLS组为7天(四分位间距[IQR]4-12),而对照组为5天(IQR3-9) ,Hodges-Lehmann组间差异的估计值为1(95% CI 0-2)。不同治疗组间的血液动力学稳定时间和肾脏替代治疗率相似。

对于安全终点,ECLS组的中度或重度出血发生率更高:ECLS组为23.4%,对照组为9.6%(RR 2.44;95% CI 1.50-3.95)。需要干预的外周血管并发症在ECLS组中也更常见:ECLS组为11.0%,对照组为3.8%(RR 2.86;95% CI 1.31-6.25)。

德国莱比锡大学莱比锡心脏中心的首席研究员Holger Thiele教授说“ECLS-SHOCK的结果表明,早期ECLS治疗并没有降低30天的死亡率,并发症也有所增加。这些发现可能会导致在临床实践中停止常规使用这些设备。”
References and notes
1 ECLS-SHOCK will be discussed during Hot Line 3 on Saturday 26 August at 16:30 to 17:30 CEST in room Amsterdam.
2 Thiele H, Ohman EM, de Waha-Thiele S, et al. Management of cardiogenic shock complicating myocardial infarction: an update 2019. Eur Heart J. 2019;40:2671-2683.
3 Hochman JS, Sleeper LA, Webb JG, et al. Early revascularization in acute myocardial infarction complicated by cardiogenic shock. N Engl J Med. 1999;341:625-634.
4 Thiele H, Akin I, Sandri M, et al. One-year outcomes after PCI strategies in cardiogenic shock. N Engl J Med. 2018;379:1699-1710.
5 Thiele H, Akin I, Sandri M, et al. PCI strategies in patients with acute myocardial infarction and cardiogenic shock. N Engl J Med. 2017;377:2419-2432.
6 Becher PM, Schrage B, Sinning CR, et al. Venoarterial extracorporeal membrane oxygenation for cardiopulmonary support. Circulation. 2018;138:2298-2300.
7 Ostadal P, Rokyta R, Karasek J, et al. Extracorporeal membrane oxygenation in the therapy of cardiogenic shock: Results of the ECMO-CS randomized clinical trial. Circulation. 2023;147: 454–464.
8 Brunner S, Guenther SPW, Lackermair K, et al. Extracorporeal life support in cardiogenic shock complicating acute myocardial infarction. J Am Coll Card. 2019;73:2355-2357.
9 Ouweneel DM, Schotborgh JV, Limpens J, et al. Extracorporeal life support during cardiac arrest and cardiogenic shock: a systematic review and meta-analysis. Intensive Care Med. 2016;42: 1922-1934.
10Banning AS, Sabate M, Orban M, et al. Venoarterial extracorporeal membrane oxygenation or standard care in patients with cardiogenic shock complicating acute myocardial infarction: the multicentre, randomised EURO SHOCK trial. EuroIntervention. 2023 May 19;EIJ-D-23-00204. doi: 10.4244/EIJ-D-23-00204. Online ahead of print.
11Thiele H, Freund A, Gimenez MR, et al. Extracorporeal life support in patients with acute myocardial infarction complicated by cardiogenic shock - Design and rationale of the ECLS-SHOCK trial. Am Heart J. 2021;234:1–11.