
导语
感染性心内膜炎(IE)是经导管主动脉瓣置换(TAVR)术后罕见但严重的并发症,尽管随着TAVR的微创治疗方式使手术有了实质性的改进,TAVR的适应症也扩展到更年轻、更健康的患者,但TAVR术后IE的发生率依然保持稳定,其发生率与外科置换术后的发生率相似。尽管TAVR术后IE被认为是人工瓣膜心内膜炎的一个亚型,但鉴于其独特的临床和微生物特征、IE相关并发症的高发生率、心脏手术的不确定性以及大多数TAVR-IE患者预后不佳,这种情况尤其具有挑战性。TAVR手术的数量预计在未来几年呈指数级增长,这也同时增加了这种危及生命并发症的患者数量。2023年JACC杂志发表了关于TAVR术后IE的最新综述,重点阐述了TAVR术后IE的流行病学、危险因素、微生物特点、临床预后以及诊疗策略等方面,因此详细了解IE及其并发症对改善临床结果至关重要。
亮点
●TAVR术后IE的发生率为0.3-2.0 / 100人/年,与SAVR后相似,虽然TAVR患者的诊断和情况有所改善,但是随着时间的推移保持稳定。
●TAVR术后的IE最常涉及的微生物为肠球菌和葡萄球菌,并与并发症和住院死亡率高相关。
●TAVR术后的住院后存活的IE患者通常表现出较差的长期预后。
●需要更多的研究来优化抗生素预防方案,评估新的影像学诊断技术来识别高危不良后果的患者,并明确TAVR术后IE患者的手术干预指征。
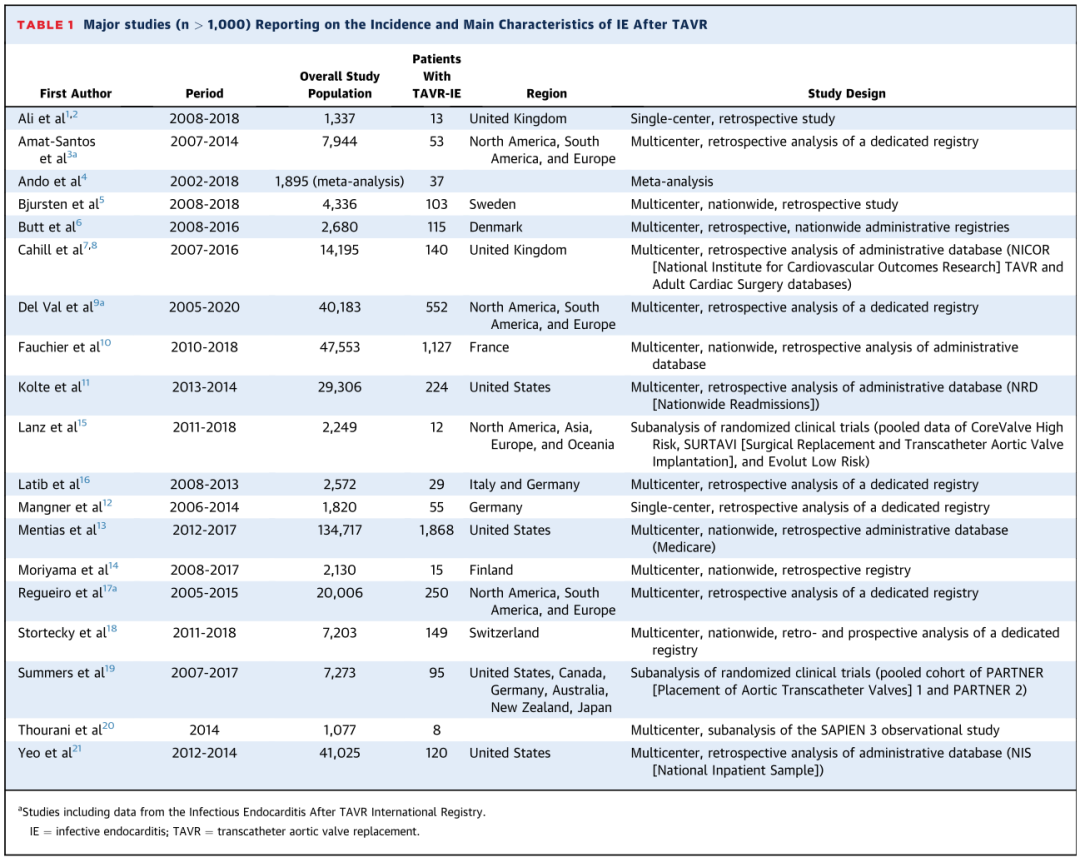



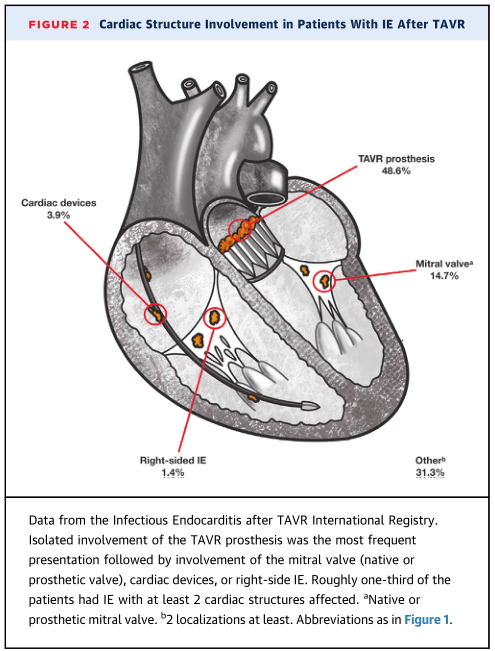



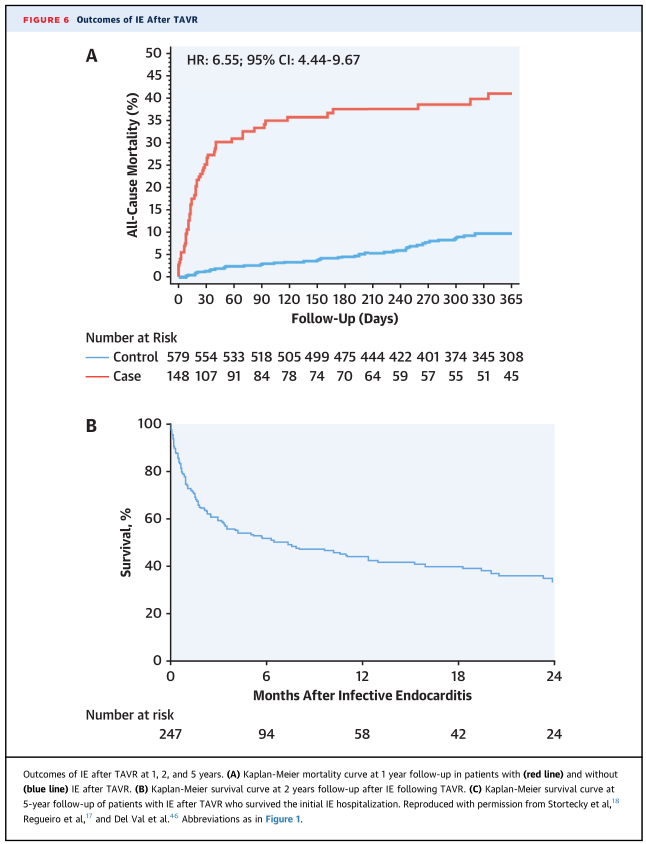
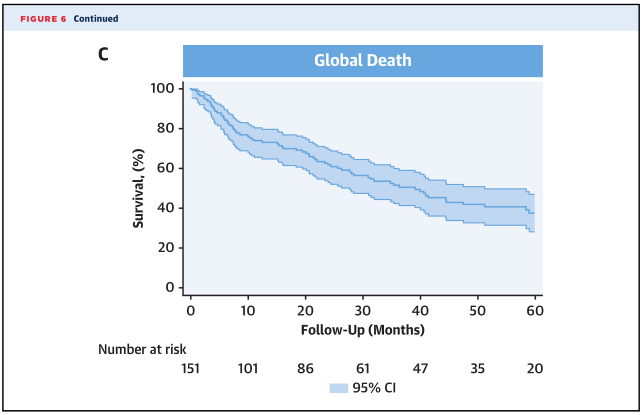


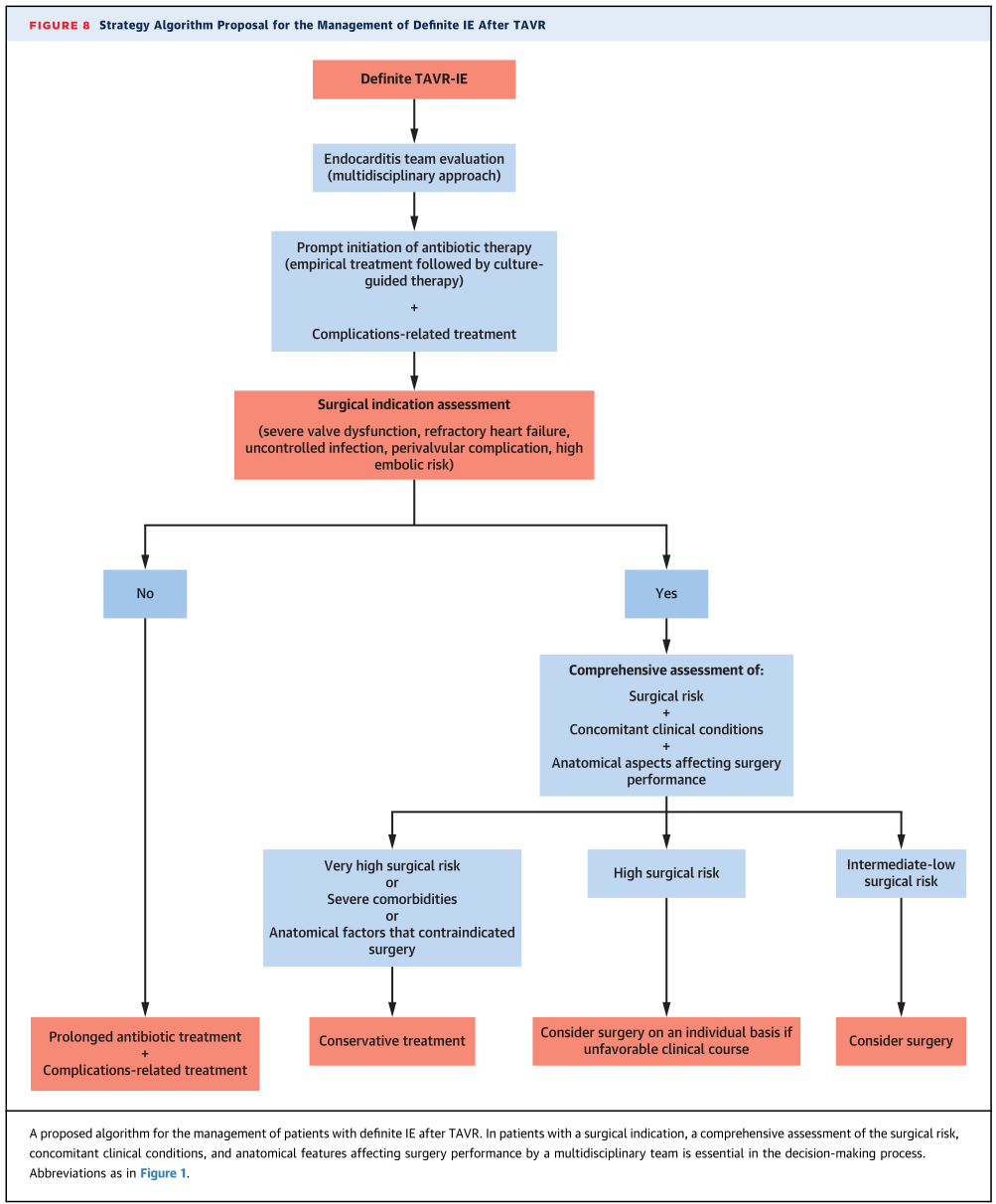
未来展望
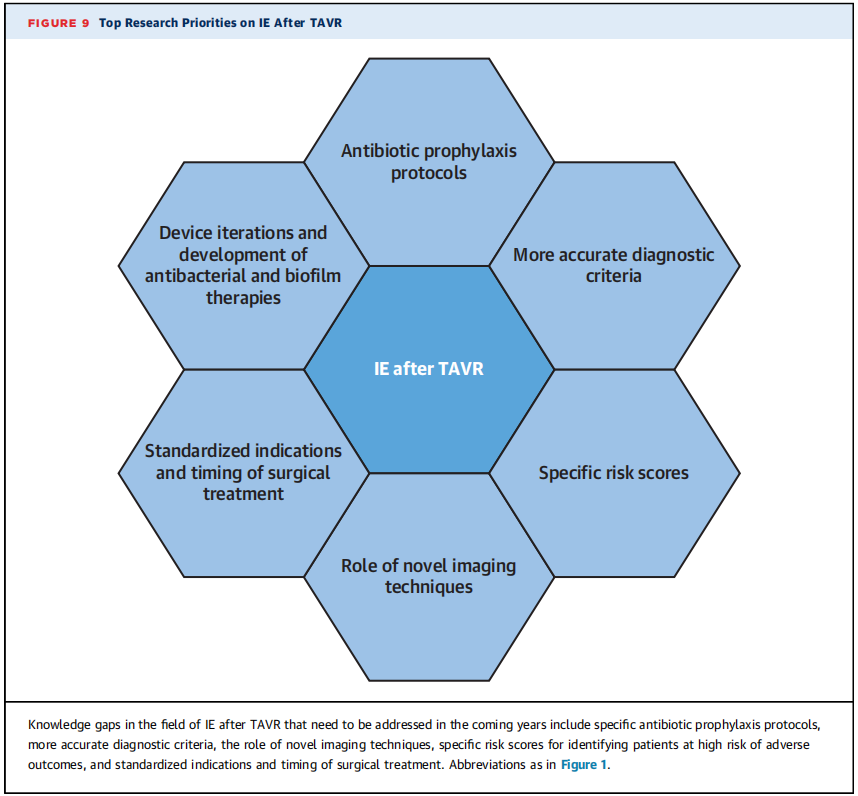
结论
专家点评
参考文献:
David Del Val, Vassili Panagides, Carlos A Mestres et al. Infective Endocarditis After Transcatheter Aortic Valve Replacement: JACC State-of-the-Art Review. J Am Coll Cardiol 2023;81(4):394–412.