
2023年7月 (总第11期)
作者:王艺;排版:王霜;校审:王斌

摘要
结构介入在成人先天性心脏病(ACHD)的治疗中起着至关重要的作用。近年来,尽管技术、设备的发展有限,但基于导管技术的结构介入手术取得了重大进展。由于每个患者在解剖学、病理生理学和外科修复等方面都是独一无二的,为了“最佳匹配”策略,许多器械设备都在超说明书使用。因此,行业需要不断创新从而更好应对ACHD的治疗,并加强与行业和监管机构的合作,以开发专用的器械设备。创新将进一步推动这一领域的发展,并为不断增长的人口提供侵入性更小、并发症更少、恢复更快的选择。在这篇文章中,我们总结了一些ACHD的结构性干预方法,并提供了休斯顿卫理公会大学的案例来进行阐明。我们希望提供成人结构性介入治疗领域更多的信息,从而激发人们对此专业的兴趣。
引言
在过去的十年中,先天性心脏病(CHD)的诊断和治疗取得了重大进展。由于小儿CHD外科和导管介入治疗的发展,ACHD患者目前约有200万人。由于90%以上的CHD儿童可存活到成年,特别是那些患有复杂病变的儿童,ACHD的人数预计将持续增长。随着ACHD人口的增长,对经导管结构性干预的潜在需求也在不断增加。结构性心脏病(SHD)包括:瓣膜疾病、间隔缺损、补片残余漏、大血管成形等广泛的非冠脉心脏病变。
从历史上看,这类缺陷的标准治疗方法是心脏外科手术。1966年,Rashkin和Miller对三名大动脉转位(TGA)婴儿进行了房间隔缺损(ASD)的球囊扩张术,以便增加心内动静脉血的混合。这也启发了许多介入心脏病专家,为进一步的介入心脏手术开辟了道路。1967年Porstmann等人进行动脉导管未闭的介入封堵治疗;1976年King等进行房间隔缺损的介入封堵治疗;2000年Bonhoeffer等人首次进行了经皮肺动脉辦置换术。随着微创介入技术的发展及创新,介入治疗成为许多先天性心脏病的主要治疗方法,以下列举的是目前正在使用的结构性心脏病介入治疗方法(表一):
• 动脉导管未闭封堵术
• 房间隔缺损及卵圆孔未闭封堵术
• 肌部及膜周部室间隔缺损封堵术
• 冠状动脉瘘、肺动静脉畸形、主动脉-肺侧支和静脉-静脉侧支栓塞术
• 主动脉血管成形术及支架植入术
• 右心室至肺动脉导管的血管成形术及支架置入术
• 肺动脉的血管成形数和支架置入术
• 肺静脉的血管成形术及支架置入术
• Fontan导管的血管成形术和支架植入术以及开窗术
• Fontan淋巴管介入术
• 心房补片狭窄的血管成形与支架置入术,补片残余漏的封堵
• 经导管肺动脉瓣介入治疗(球囊瓣成形术、肺动脉瓣置换术、瓣中瓣植入术)
• 人工瓣周漏介入封堵治疗
• 血管、瓣膜狭窄梗阻的再通介入治疗
• 经导管三尖瓣介入治疗(瓣中瓣、环中瓣、钳夹术)
• 经导管主动脉瓣、二尖瓣介入治疗(TAVI、Mitralclip等)
动脉导管未闭封堵术
动脉导管是胎儿主动脉和肺动脉之间的血管连接,将血液从肺循环引入体循环。动脉导管通常在出生后不久会闭合。如果这种通道持续存在到成年则称为动脉导管未闭(PDA)。发病率为2-10/10000,男女比例为2:1;主要临床症状与不同程度的左向右分流对血流动力学的影响不同;动脉导管未闭封堵适用于容量负荷重且分流显著的患者,如左房或左室增大、肺动脉高压等。对于净向左向右分流(QP:QS>1.5)、肺动脉压和肺血管阻力轻度至中度升高(PVR<5Wu)的患者,建议进行封堵。经导管封堵是目前成人动脉导管未闭的首选方法。不锈钢或铂金弹簧圈栓塞术是封堵小型PDA的常用方法。对于PDA较大的成年人,最常用的封堵器是Amplatzer导管封堵器(图1)。多中心试验表明,使用线圈栓塞术与导管封堵器装置的植入成功率都很高,且常见并发症发生率均较低。

图1 动脉导管未闭封堵
A:造影显示5.5mm的动脉导管并钙化;B-C:降主动脉内封堵器,造影未见残余分流;D:释放后封堵器位置稳定
房间隔封堵术(II孔型房间个缺损和卵圆孔)
房间隔缺损是成人最常见的先天性心脏病之一,通常无症状。根据位置可分为继发孔、原发孔、上腔静脉窦、下腔静脉窦和无顶冠状静脉窦。房间隔缺损封堵术的主要手术指征与显著的左向右分流有关。在QP/QS ≥1.5且无肺动脉高压的患者中,无论有无症状,房间隔缺损均可关闭。对于严重不可逆性肺动脉高压(肺动脉压大于全身动脉压的三分之二或PVR大于SVR的三分之二)或完全性右向左分流的患者,美国心脏病学会/美国心脏协会(ACC/AHA)指南不建议进行封堵。一些证据也支持额外的适应症,如斜卧呼吸-直立低氧血症和矛盾栓塞症。介入封堵是继发性ASD的首选治疗方法。美国批准的两种封堵器是Amplzer封堵器和Gore CARIOFORM封堵器。多项观察研究表明,经皮封堵术与手术相似,但并发症发生率较低,住院时间较短。经皮封堵术已被证明与右室和左室功能以及功能容量的改善有关。最常见的并发症包括封堵器错位或栓塞以及较少见的因封堵器对房间隔的侵蚀/穿孔导致的房性心律失常。
静脉窦房间隔缺损是一种少见的房间隔缺损(占所有房间隔缺损的5%至10%),发生在上腔静脉和右心房的交界处。它是由分隔上腔静脉和肺静脉的房壁缺失引起的,通常与右肺静脉部分异位引流有关。导致心房水平左向右的分流,但也可能由于频繁存在和增加肺静脉引流而增加分流。与其他ASD患者相比,他们发生艾森门格综合征和肺动脉高压的风险也更高。传统的治疗标准是进行手术矫正。2015年首次发表了一种新的经导管技术,用覆膜支架纠正了上腔静脉后壁的缺陷,通过封堵窦静脉房间隔缺损并将异常肺静脉隔入左房。多个病例和小型研究表明,对于具有合适解剖的患者,类似的技术是手术的有效替代方案。先进的横断面成像和3D建模用于术前规划以及术中图像指导,在这些复杂的病例中获得了良好的成功。
卵圆孔在胎儿发育过程中存在,允许含氧血液从右心房流向左心房。在正常发育中,原发隔和继发隔在2岁完全融合,当融合失败时,会发生卵圆孔未闭(PFO)。根据尸检和超声心动图研究,PFO是一种相对常见的疾病,可见于20%至30%的普通成年人。大多数PFO患者没有症状,但最常见和最严重的临床表现是矛盾性栓塞症导致的隐源性卒中。RECLUTE、REPORT和CLOSE试验表明,与抗血小板治疗相比,PFO封堵器对于减少复发的缺血性中风有好处。与ASD封堵器类似,美国批准了两种装置--Amplatzer PFO封堵器和Gore CARDIOFORM封堵器--用于经皮PFO封堵术。(图2)
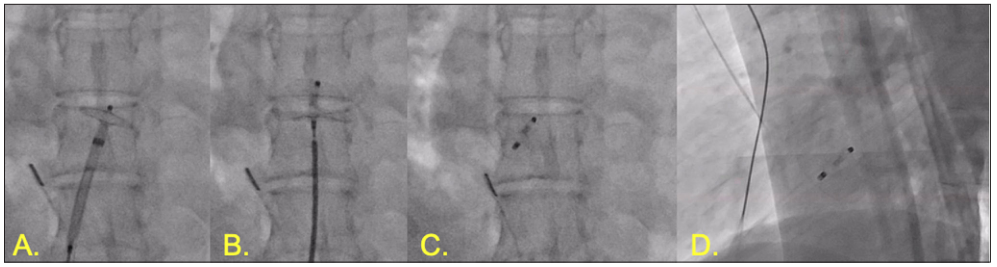
图2卵圆孔封堵术
A:封堵器释放左房面伞盘 B:释放右房面伞盘 C:完全释放封堵器 D:封堵器横向观

中央型ASD,术中超声引导输送系统穿缺损口至左房打开伞盘

ASD封堵术三维图像
肌部及膜周部室间隔缺损封堵术
室间隔缺损(VSD)约占ACHD患者的10%,大多在成年前诊断和治疗。在儿童期很多可自发闭合。室间隔缺损按部位分为膜周/主动脉下(80%,最常见)、肌部和流入/流出道,亦可发生于手术后侧残余分流、创伤、心梗等之后。对于左向右分流比大于1.5:1,且无肺动脉高压(PVR<3Wu)、左室容量有超负荷迹象、室间隔缺损相关的主动脉瓣反流或复发性心内膜炎的患者,建议进行封堵术。
使用Amplatzer封堵器进行介入治疗已趋于常态化,尤其是对于室间隔缺损补片残余漏和位于中央的缺损。膜周部的缺损进行封堵术是可行的,但存在完全性传导阻滞、三尖瓣和主动脉瓣组织受压产生反流的风险。因此,需要一种新的装置设计,以提供更好的稳定性,同时对传导系统造成更小的损伤。目前一种杂交封堵法可通过胸壁、右室壁直接将输送系统送入心内进行封堵,且无需体外循环。

超声可见嵴下0.45cm室间隔缺损,术中超声引导鞘行VSD封堵

VSD封堵术后,室水平未见残余分流,主动脉瓣及三尖瓣未受压
主肺动脉-静脉血管侧支封堵术
接受姑息性Fontan手术的单心室患者可存活至成年。Fontan手术可将全身静脉血直接连接到肺动脉。这些患者通常会出现慢性全身静脉压升高,从而导致包括侧支循环形成在内的多种并发症。由于肺血流量增加,主肺侧枝循环(APC)对血流动力学和全身血氧饱和度影响十分复杂。栓塞手术短期内可能会提供血流动力学益处,但也可能会加重渗透压的降低。另一方面,静脉静脉侧支(VVC)也会导致全身渗透压降低。静脉静脉侧支的栓塞会增加长期死亡率。研究表明,在原位心脏移植和心脏/肝脏联合移植之前进行APC和VVCs的栓塞,于减少移植手术中的出血有关。
血管成形术和支架置入术治疗主动脉缩窄
主动脉缩窄(CoA)是一种相对常见的先天性缺陷,活产儿发病率为4/10000,占所有先天性心脏病的5%-8%。它经常与其他病变联合出现,如主动脉瓣二辦化畸形(>50%),大脑“浆果”状动脉瘤,以及主动脉壁病变(例如,囊性中层坏死,动脉瘤,夹层)。少数患者在成年前并未确诊,可出现继发性高血压、头痛或流鼻血。ACC/AHA指南建议对严重的自发性或复发性主动脉缩窄(上肢/下肢静息峰值压力阶差>20 mm Hg)和/或有放射学证据的狭窄和侧支循环都需要进行干预。
开放手术修复和血管成形并支架植入术的死亡率相似,均约0-3%。CoA修补术的并发症包括再狭窄、动脉瘤、假性动脉瘤和夹层。一项观察性前瞻性研究表明,开放手术和球囊血管成形术相比,支架成形术的并发症较少(分别为2.3%、8.1%和9.8%;P<.001),手术组、支架组和球囊成形术组的主动脉壁损伤率分别为12.6%、7.1%和43.6%。因此,考虑到对主动脉壁损伤的关注,目前真实世界已转向常规使用带膜的CP支架,这已被证明可以有效地治疗CoA同时预防相关的主动脉壁损伤(图3,4)。然而,需要注意的是,覆膜CP支架被认为可提供保护,但随着时间的推移,仍然存在一些关于再狭窄和支架断裂风险的担忧。

图3 CT血管三维重建
A:黄色三角箭头示主动脉弓缩窄处 B:黄色箭头示覆膜支架植入后

图4 主动脉缩窄血管成形术
A:术前造影显示主动脉弓部狭窄 B-C:支架自膨胀扩张,于狭窄部可见“腰” D:球囊后扩 E:造影显示主动脉弓狭窄解除同时无夹层等并发症
右室-肺动脉连接部的血管成形术和支架置入术
右室流出道梗阻与多种复杂的先天性畸形有关,如肺动脉闭锁、法洛四联症、共同动脉干、Ross和Rastelli手术。如果自体的流出道不适合重建,就需要使用外科导管技术以保证RV和PA之间的连续性。尽管手术技术和管道较新,但超过60%的人工血管20年后都存在再狭窄问题,都需要再次手术。为了减少重复开胸,血管成形术和支架置入术被用作延长导管寿命的替代方法。根据一项包括221名右室-肺动脉导管阻塞患者的研究,支架植入后患者无需再接受导管手术的中位时间为3.9年,而术后5年以上患者的中位时间为3.9年。尽管支架断裂很常见,但它们与血流动力学损害或导管手术时间并不相关。如果RV-PA管道狭窄存在明显的管道返流,单独进行支架置入、经导管肺动脉瓣置换术或替换带瓣RV-PA管道应根据管道的大小、瓣膜功能和感染风险逐一进行考虑(图5)。

图5:右室流出道瓣膜介入术
A:生物辦 B-C:球扩辦
肺动脉狭窄是一种先天性及后天性疾病,可影响肺动脉及其分支的不同部位。狭窄的部位和病因是选择血管成形术的关键因素。单纯的高压球囊血管成形术(BA)通常用于近段血管,理论上先天性肺动脉狭窄的手术成功率约为60%~72%。可切割BA通常用于抗扩张性PA和远端分支狭窄。支架置入术是最有效的方式,但仅限于BA失败的病变,因为需要进行一系列扩张以匹配躯体的生长。目前,新的生物可吸收支架正在研究中,以避免再次手术干预。
肺静脉血管成形术和支架置入术
肺静脉狭窄(PVS)是一种相对罕见的异常,可以是原发的,也可以是获得性的。单纯的先天性PVS几乎仅见于婴幼儿。然而,获得性PVS在儿童和成人中都可以看到,如纵隔突起(肿瘤或纤维性纵隔炎),房颤消融时进行肺静脉隔离,以及肺静脉异常回流的外科矫正(弯刀综合征(图6、7)。对于婴儿,首选手术,肺静脉支架置入术应该作为肺移植前的最后手段,因为再狭窄的发生率很高,而且随着孩子的成长需要不断反复行支架手术进行扩张。对于成年患者而言,BA和支架都是有效的治疗选择。然而,再狭窄仍然是一个令人担忧的问题,特别是在BA组,最近的荟萃分析显示,支架置入后再狭窄和再干预率更低。

图6 弯刀综合征修复后的心脏磁共振成像显示,补片将肺静脉引流至左心房同时房间隔造孔

图7 弯刀综合征右肺静脉狭窄再干预
A:静脉造影显示右肺静脉狭窄 B-C:药物球囊充气扩张肺静脉
Fontan导管血管成形术和支架置入术、开窗关闭和Fontan淋巴介入治疗
Fontan手术是用于治疗单心室畸形的多项手术的最后一步。全腔-肺静脉连接是通过使用心外管道(ECC)来建立的。然而,随着时间的推移,大约14%到18%的人工管道容易发生狭窄,导致进行性静脉充血,运动耐量降低,最终衰竭。血管成形术的适应症是管道的尺寸缩小(~25%),而不是压力阶差是否存在。血管成形术和支架植入是治疗单纯管道狭窄的首选方法。已经使用了多个支架,建议在治疗高度钙化的管道时使用带膜支架,以防止管道剥离。成功率接近100%,并发症发生率约为0%-10%。良好的血流动力学是由广泛的连接定义的,低肺血管阻力导致较少的充血和改善的心输出量。有时,特别是在术后阶段,外科医生会在ECC和心房之间开一扇窗,以避免极度充血和低心输出量。然而,随着开窗大小的增加,血氧饱和度会降低,这需要平衡。因此,根据临床需要,可以选择经皮开窗、扩大或关闭开窗(图8)。持续开窗可导致紫绀和运动耐量受限。这可以通过使用Amplatzer房间隔封堵器(4-6 mm)、Amplatzer导管封堵器II或血管塞等装置进行开窗关闭来缓解。慢性升高的全身静脉压会使淋巴系统引流障碍。出现两个主要的并发症:蛋白丢失性肠病和塑料支气管炎,这与循环衰竭的淋巴功能障碍直接相关。

图8 Fontan开窗闭合术 箭头所示为室缺封堵器的伞盘
心房补片狭窄及补片残余漏封堵的血管成形术和支架置入术
大动脉转位的特点是房室一致但室动脉不一致。在20世纪,心房调转术介入治疗弯刀综合征的右肺静脉再通狭窄。这些手术将长期存活率从71%提高到20岁时的94%。然而,补片再狭窄或残余漏仍然是常见的并发症,导致运动能力下降,左向右分流的矛盾栓子和再介入治疗。建议对有症状的患者和有严重心脏超负荷的无症状患者进行技术上可行的补片介入治疗。多个病例系列表明,在这一人群中,经皮支架置入术和残余漏口封堵术是一种安全有效的手术替代方案。
经导管肺动脉瓣介入治疗
球囊瓣膜成形术仍然是先天性肺动脉瓣狭窄的主要治疗方法,在所有年龄段都有良好的长期结果。其结果可与外科瓣膜切开术相媲美,复发率低。经导管肺动脉瓣置换术(TPVR)是最近发展起来的ACHD干预措施之一。它已迅速发展成为具有合适右心室流出道(RVOT)形态的患者的首选治疗方法。评估主要球囊扩张瓣膜系统的两项主要临床试验(Melody和SAPIEN)显示,在瓣膜功能恢复、纽约心脏协会功能分级改善以及3年无全因死亡方面取得了出色的结果。然而,大约75%的自体RVOT扩张或修补的患者并不适合球囊扩张瓣膜。因此,自膨胀系统越来越多地被用作球囊可膨胀瓣膜系统中RVOT的混合应用的替代方案(图9)。随着这一过程的发展,重要的是要认识到相关的并发症,如冠状动脉压迫、主-肺动脉瘘和Melody瓣膜导致的心内膜炎(其发生率高达8%)。

图9 经皮肺动脉瓣置换术
经导管二、三尖瓣介入治疗
经导管二、三尖瓣介入治疗包括瓣膜内瓣膜、瓣膜环状瓣膜、夹层瓣膜、全身房室瓣和肺下房室瓣在内的介入治疗。
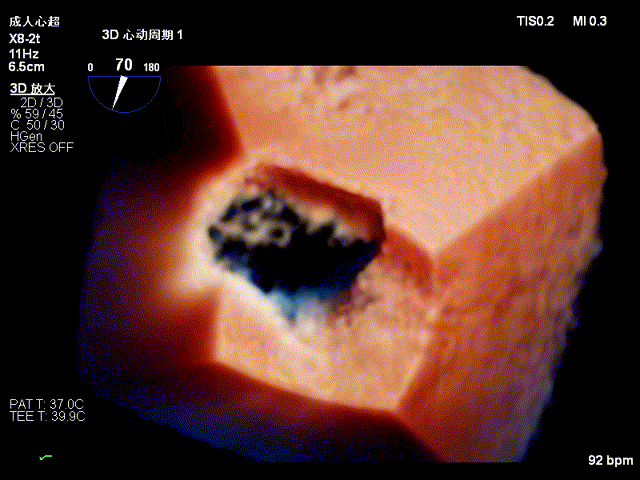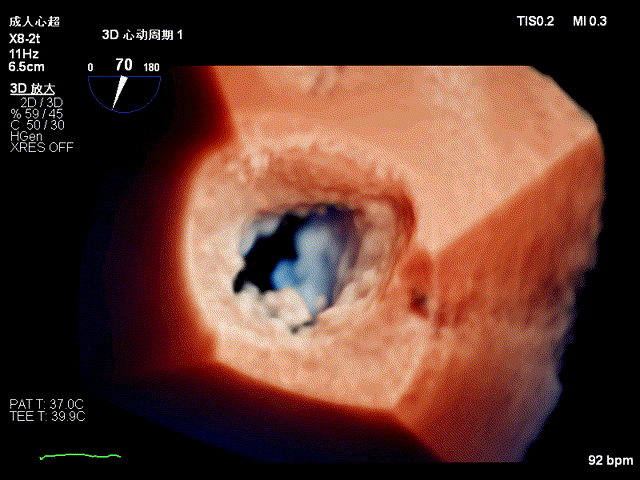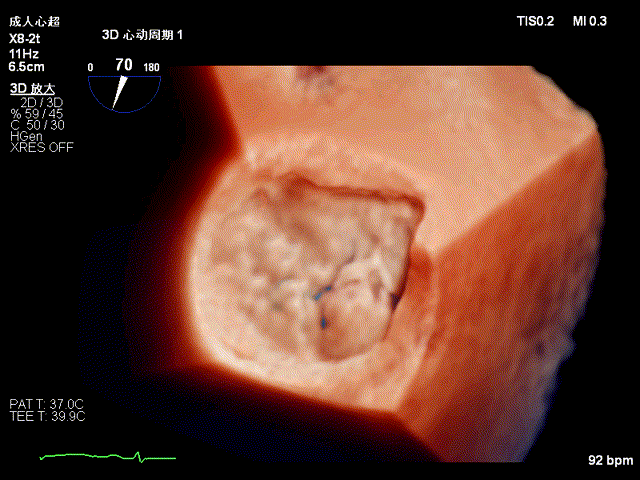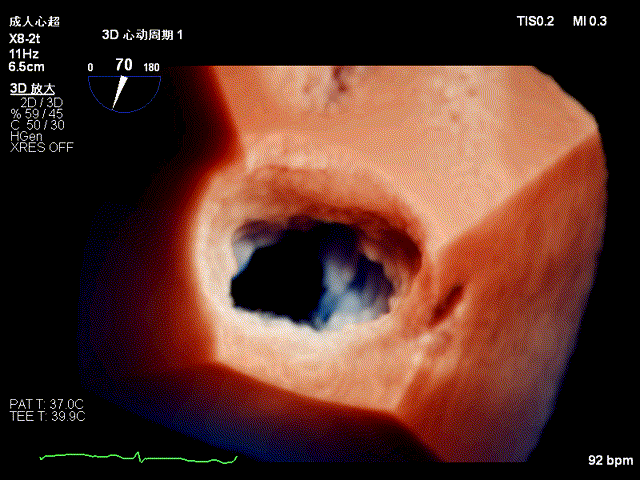
TEE显示二尖瓣后叶P2与P3区交界处脱垂三维图像
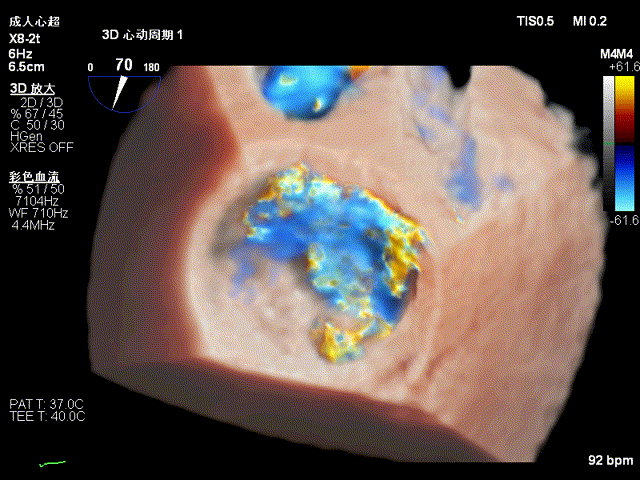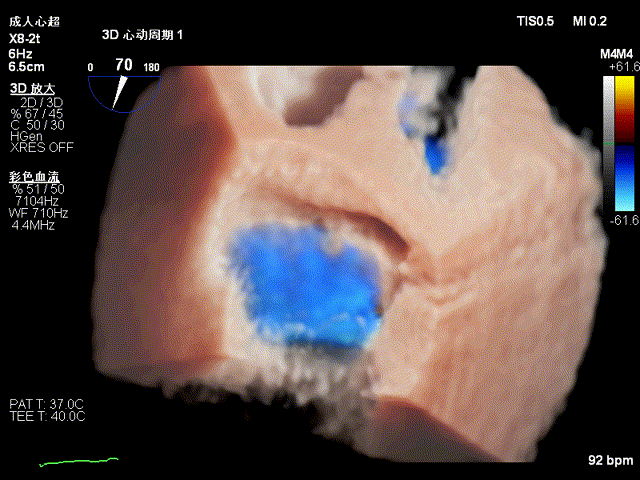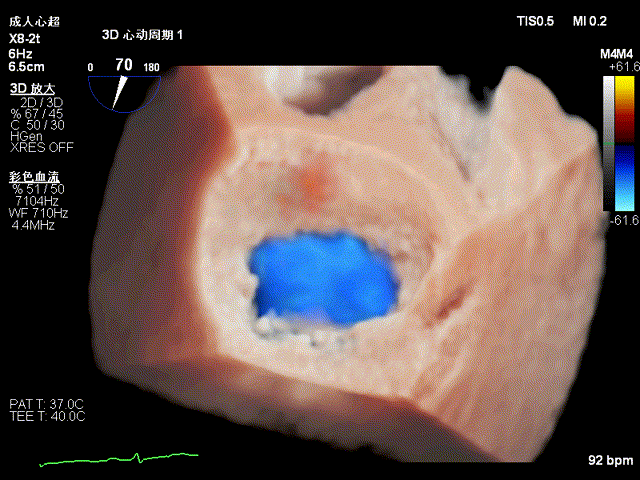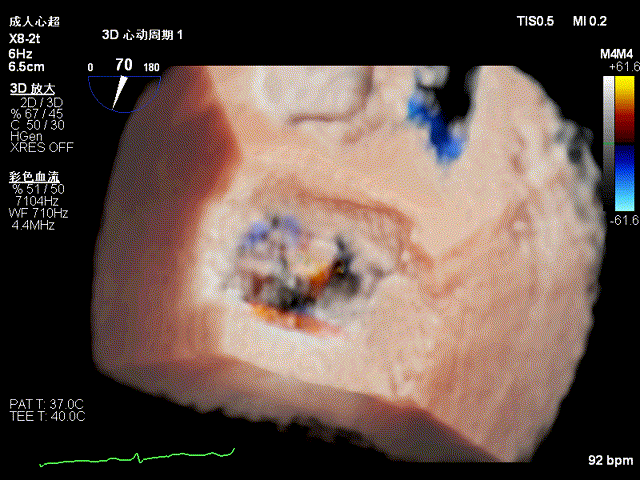
TEE三维图像显示二尖瓣反流起自P2与P3区交界处

二尖瓣钳夹术后三维图像,夹子位于P2与P3交界区,瓣口呈双孔征
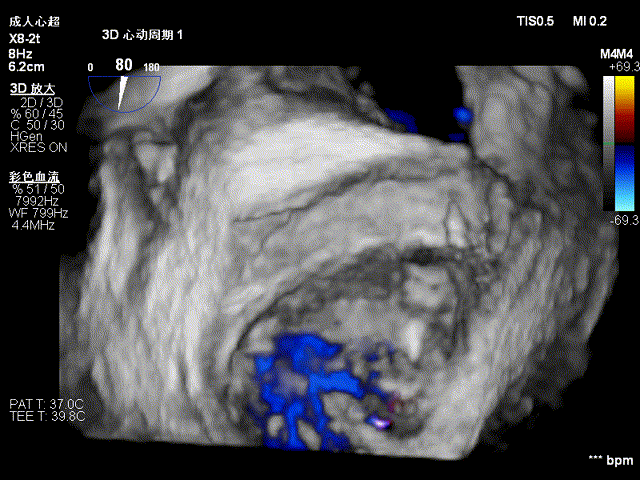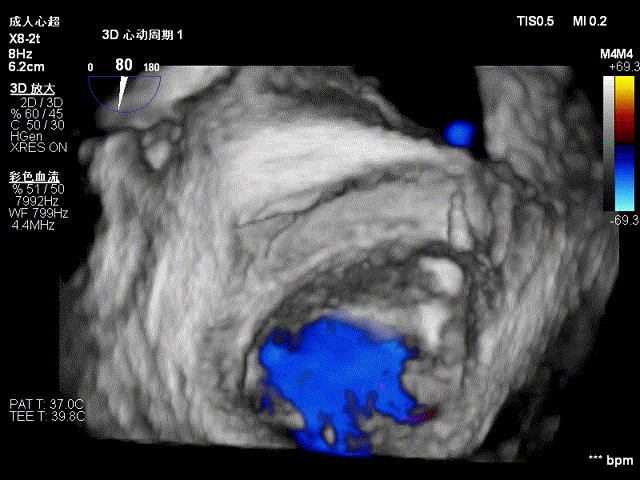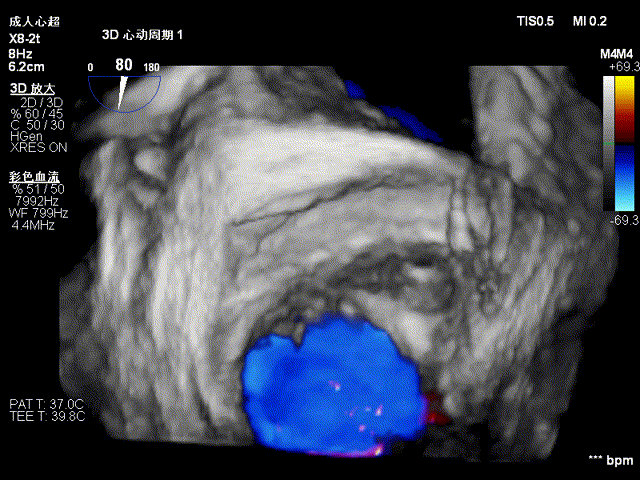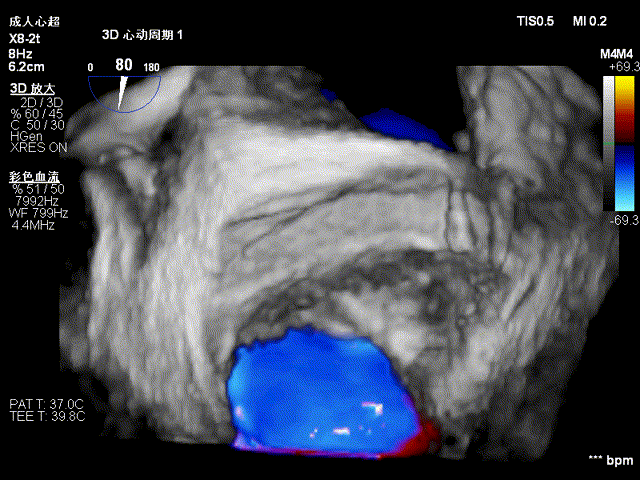
CDFI显示术前二尖瓣反流由5+减少至不足1+
总结
ACHD的干预包括一系列的手术方案,这些手术方案近几年明显增长。随着技术、成像技术的不断进步和对长期结果的了解,经导管介入治疗的数量将继续增加。然而,需要更多地关注与行业的合作,以简化设备开发的途径,并引入微创治疗方法的创新战略。
要点
随着成人先天性心脏病(ACHD)患者人数的增加,介入治疗的潜在需求也在不断增加。ACHD干预包括原始的心脏外科手术,以及从分流的封堵到大血管成形术和瓣膜介入置换术等微创治疗方法。ACHD的干预具有挑战性,因为每个患者在解剖、病理生理学和手术修复方面都是独一无二的。
心脏多学科团队的通力配合是为患者提供最佳治疗的关键因素。现阶段仍需要不断创新,并加强临床与相关行业和监管机构的合作,从而开发出专用的器械设备。
参考文献:
Bou-Chaaya RG, Zhu Z, Duarte VE, Lin CH. Percutaneous Structural Interventions in Adult Congenital Heart Disease: State-of-the-Art Review. Methodist DeBakey Cardiovasc J. 2023;19(3):78-90.
目前中南医院心血管病医院常规开展的各项介入治疗项目:
1、经皮/心尖主动脉瓣置换术
2、经皮/心尖二尖瓣钳夹术
3、经皮/心尖二尖瓣置换术
4、经皮三尖瓣钳夹术/置换术
5、经皮/心尖肺动脉瓣置换术
6、房间隔缺损/卵圆孔未闭封堵术(超声引导)
7、室间隔缺损封堵术(超声引导)
8、动脉导管未闭封堵术
9、左心耳封堵术
10、瓣周漏封堵术
11、冠状动脉瘘封堵术
12、瓣膜狭窄球囊扩张术