经导管二尖瓣缘对缘修复术(TEER)可改善外科手术高风险的症状性二尖瓣反流(MR)患者的症状,改善心功能和生活质量,并降低心力衰竭再住院,且具有良好的安全性。然而,仍有相当一部分重度症状性MR患者不适合进行TEER手术。此外,有证据表明,单纯减少而未消除MR的患者预后并不理想,残余MR≥2+生存率仍然较低。
经导管二尖瓣置换术(TMVR)应运而生,特别是针对一些二尖瓣解剖结构复杂,通过TEER治疗术后残余MR<2+可能性很低的患者,将可能成为一种新的选择。目前,有超过30种TMVR设备正在开发中,不过,只有不到10种处于临床实验阶段。其中Tendyne Mitral Valve器械(Abbott Vascular,Santa Rosa,CA,USA)的临床经验最为丰富,该器械已在全球1000多名患者中植入。
TMVR的手术成功率估计在91.7%至95.2%之间。心脏直视手术的转化率在0%至15%之间,围手术期死亡率在0%至30%之间,30天死亡率在3%至53%之间。尽管TMVR术的可行性已得到验证,但临床上仍面临着更多的问题,例如在TMVR术后的一年内,死亡率和心力衰竭再住院率仍然相对较高。
近期,发表于《European Journal of Heart Failure》的一篇综述全面总结了TMVR围手术期的注意事项,以帮助指导未来临床上优化患者选择和TMVR术前、术中和术后管理。
术前管理
NYHA心功能分级与心力衰竭住院率
2019年,在对308名TMVR患者进行分析的一项系统综述中报告,干预前一年的心力衰竭住院率为39-69%。81.5%的患者为纽约心脏协会(NYHA)心功能III/IV级。在CHOICE-MI登记中,患者接受MR再干预治疗的患者,62%为NYHA III级,23.6%为NYHA IV级心力衰竭。TMVR组NYHA IV级患者的心力衰竭再发生率高于接受TEER或高风险手术的患者(20.5% vs. 6.7%)。在Tendyne扩展临床研究中,100%的患者在术前出现NYHA III/IV级心力衰竭,在Tendye欧洲经验注册中心(TEND)中,20-86%的患者出现III/IV级心力衰竭。
预防和逆转心力衰竭和虚弱
从TEER的经验中可以了解到,心力衰竭和虚弱症状在进行TMVR患者中很常见,在干预之前,应优先考虑对所有患者优化指南指导的药物治疗。这包括适当的电生理学评估和/或心脏再同步装置治疗,有两项研究报道了手术前心脏预适应的益处,尽管在TMVR之前没有一项。在等待TMVR期间的锻炼计划应在患者术前功能分类的限制范围内考虑。
对于需要进行容量管理的患者,可在TMVR术前1至3天进行院内优化,以避免围手术期容量的显著变化,增强左心室功能,维持患者体外循环后的心功能。心功能差的高危患者术前输注左西孟旦可减少对肌力的需求和/或对机械循环支持的需求。同样,术前用心脏选择性β1激动剂(如多巴酚丁胺)稳定心源性休克的血液动力学可能是有益的,该激动剂也具有β2诱导的血管舒张作用。
术前左心室功能障碍
对于严重MR患者,左心室功能障碍是由反流射血容量(SV)增加引起的。反流性室性心动过速导致左心室舒张末期(LVEDV)和收缩末期(LVESV)容积增加,导致左心室和左心房充盈压升高,之后心力衰竭症状变得明显(图1)。既往一些研究表明,约有30-50%的TMVR患者合并有左心室功能障碍。
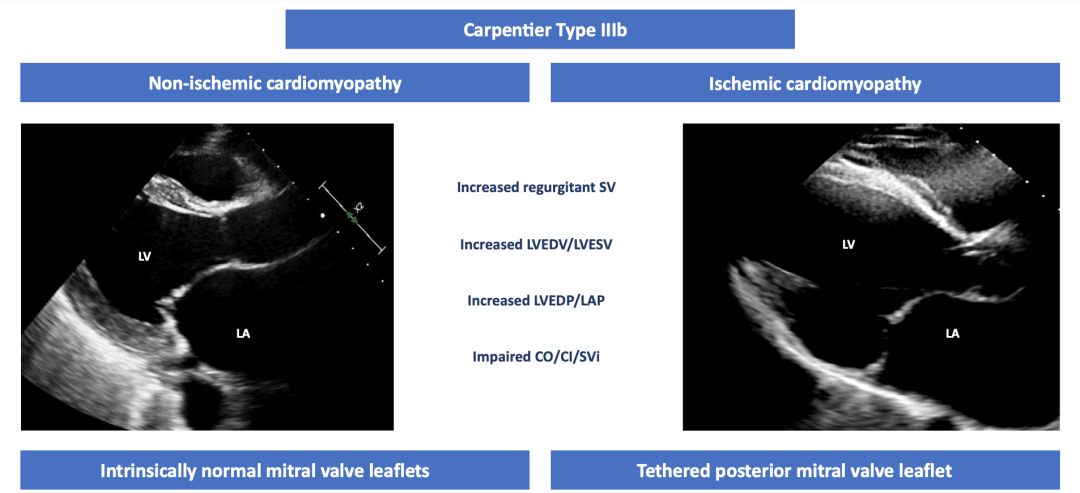
图1 继发性二尖瓣反流的分类和左心室功能障碍的病理生理机制
建议在TMVR前通过右心导管(RHC)进行全面的血流动力学评估,以提供有关围手术期心源性休克风险的预测因素。尽管目前尚无针对严重MR患者的血液动力学指南,与晚期心力衰竭患者中相似,右心房与肺毛细血管楔压(PCWP)之比<0.630和/或心脏指数<2.0 L/min/m²被认为是发生心源性休克和/或需要机械循环支持的危险因素。TMVR后可能会出现急性左心室后负荷不匹配风险的患者超声特点有:LVEF<40%、LVEDD>6 cm、LVESD>4 cm、心输出量<3.0 L/min或CI<2.0 L/min/m²的患者。此外,左心室腔较小(<3.5cm)基底部可能会有脱落风险,也应早期识别。LVEF<30%的患者可考虑运动或药物负荷超声心动图,以评估收缩储备能力,并在必要时,TMVR术前进行冠状动脉血运重建。
术前右心室功能障碍
严重MR中的右心室(RV)功能障碍与左心室不良重构、左心室间隔功能受损和毛细血管后肺动脉高压间接导致的右心室后负荷增加有关(图2)。TMVR中右心室功能障碍的真实患病率尚不清楚。
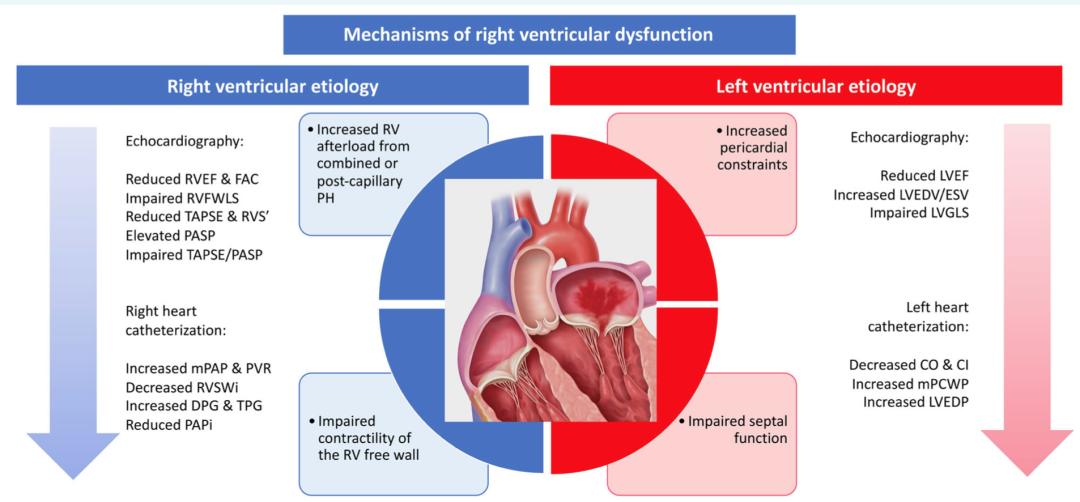
图2 右心室功能障碍的病理生理机制和识别
根据机械循环支持所得到的经验,右心功能的血液动力学评估可能有助于预测TMVR后急性右心室功能障碍的发展。右心房压力(RAP)>15 mmHg,经肺压力梯度(TPG)>15 mHg,肺血管阻力(PVR)>5WU和/或肺动脉搏动指数(PAPi)<1.8537,都是右心力衰竭的预测因素,可以在TMVR术前进行评估。RHC的血流动力学数据应结合术前经胸超声心动图进行评估。肺动脉收缩压(PASP)>60mmHg、TAPSE<15mm、S′<10cm/S或右室面积变化分数<30%均与TMVR后急性右心力衰竭的发生有关。
房颤和功能性房性二尖瓣反流
ARIC研究发现,房颤的患病率随着MR的严重程度加重而增加,这种影响在射血分数保留型心力衰竭(HFpEF)中更为明显。房颤与HFpEF和伴发中/重度MR患者的1年死亡率增加有关。房性功能性MR(aFMR)在TEER后会降低,可能是由于瓣叶接合面积增加,但也与TR恶化有关。TMVR在aFMR患者中的应用有限,因为左室尺寸通常太小。无论如何,在所有TMVR患者中,新发AF可能受益于早期节律控制。
术中管理
二尖瓣解剖的复杂性
从解剖学方面看,在二尖瓣植入假体存在许多解剖上的挑战。二尖瓣瓣环尺寸、几何形状和非刚性特点,以及需要合适的锚定位点和术后左心室流出道阻塞(LVOTO)的风险。在对563名TMVR筛查失败患者的注册分析中,13.7%的患者因解剖结构不良(包括瓣环环大小和LVOTO风险)而被排除。来自TENDE注册和Nikura等的研究数据确定了严重TR(15-16%)、既往主动脉瓣治疗(14.2%)、平均跨瓣压差>5 mmHg的二尖瓣狭窄(高达18%),中度/重度或重度二尖瓣环钙化(MAC)(7-20%)和/或LVOTO风险(4.4%)是排除的最常见解剖原因。
经心尖入路
在TMVR手术中,大约80%的病例是通过经心尖入路进行的(而通过经房间隔入路则占了20%)。经心尖入路的优点包括大口径输送鞘和假体相对于二尖瓣环同轴对齐。然而早期的研究发现,较大尺寸的输送鞘和心尖部相对较薄的心室心肌与出血风险和手术死亡率(6%至14%)增加有关。在CHOICE-MI登记研究中,TMVR患者的手术死亡率为1.8%,TEER患者为0%,高风险手术患者的死亡率为2%。在评估使用Tendyne经导管二尖瓣系统治疗症状性MR(SUMMIT)的安全性和有效性的临床试验中,目前的手术死亡率为0%。随着器械的不断发展和手术专业知识,死亡率有望进一步降低,但与TEER的死亡率仍有一定的差异。
根据器械植入的经验,结构心脏团队必须区分经心尖和经房间隔方式的适用性。具体而言,经心尖入路穿刺需要术前CT和当天经胸超声心动图来确定进入左心室心尖的最佳肋间间隙。一旦确认,采用小型开胸入路,对左心室心尖进行手术准备,以进行心尖穿刺。在经食管超声心动图(TEE)的指导下,确认最佳位置,并对左心室尖端进行血肿目视评估。仍需要进行前瞻性研究,以比较采用经房间隔入路和经心尖入路对TMVR预后的影响。
经房间隔入路
经房间隔入路的器械已经在研发中。经房间隔入路通过股静脉途径实现,避免了进入胸腔或心包腔的需要,有助于加快术后恢复,尽管同轴对准和器械再捕获更难实现,并且LVOTO的风险仍然存在。CHOICE-MI登记的经房间隔入路患者的一年事件发生率在数字上(尽管不是统计上)低于采用经心尖入路进行TMVR治疗的患者。
术中左室流出道梗阻
Sapien瓣膜在MAC/环/瓣中瓣发生LVOTO的风险在9.3%-39.7%之间(尽管是非常早期的经验)。在最近对STS/ACC/TVT登记研究的分析中,MAC/环/瓣中瓣中Sapien瓣发生LVOTO的风险为10%。CT筛查(即新左心室流出道面积<1.7cm²和0.92cm²/m²)可以预测LVOTO,灵敏度为96.2%,特异性为92.3%。左心室腔<3.5cm,二尖瓣前叶较长,二尖瓣前叶和收缩期室间隔边缘之间的距离<6mm、主动脉-二尖瓣角度<120°和心尖入路位置均为LVOTO的预测因素。对于那些尽管进行了筛查但术中仍出现LVOTO的患者,手术死亡率相当高。在一项针对194名接受TMVR的患者的研究中,LVOTO的术中死亡率为34.6%(而无LVOTO患者的死亡率为2.4%;p<0.001),术后死亡率为19.2%。在TMVR植入前,识别血流动力学上显著的LVOTO,然后重新进行定位或捕获至关重要。在使用经心尖入路TMVR器械时,建议重新定位、横向旋转以优化LVOT开口(“关闭”)或回收装置。在持续LVOTO和血液动力学可代偿的情况下,可能的治疗干预措施包括酒精性室间隔消融(ASA)、二尖瓣前叶撕裂术(LAMPOON)和“Shortcut”技术。
术中左心室血流动力学评估
目前,尚缺乏TMVR对左心室血流动力学影响的高质量临床研究。既往的临床经验认为,由于消除了MR反流相关的低后负荷,植入TMVR后可能会急剧增加左心室后负荷。医生和麻醉团队之间的沟通对于识别左心室血流动力学的急性变化至关重要。对诱导麻醉的血液动力学反应可能是左心室支持需求的第一个征兆。大多数TMVR器械的最后输送阶段与低血压有关。但这一阶段可能是短暂的,在大多数情况下,可以谨慎观察进行管理,而无立即治疗。肺动脉导管的连续血流动力学监测允许重复估算心输出量,心脏指数和其他指标。左心室内的猪尾导管和回拉压力梯度有助于评估和排除LVOTO的出现,TEE在整个过程中应通过评估左心室大小、二尖瓣环尺寸,瓣周MR或超声心动图特征发展以确认是否有LVOTO(图3)。
术中右心室血流动力学评估
TMVR植入后,由于消除MR对左心室负荷的影响,减少了心包对右心室的压力,进而改善室间隔功能。与左心室的情况一样,使用肺动脉导管进行心脏血流动力学监测可以重复估计心输出量和心脏指数,也可以重复估计肺动脉压力,RVSWi和许多其他右心室指标。TEE应通过动态测量右心室大小和收缩功能、三尖瓣反流恶化的存在和/或多普勒测量的PASP的增加来补充对右心室血液动力学的评估(图3)。

图3 心源性休克发生的高危血流动力学因素
术中机械循环和肌力药物的使用
TMVR器械的平均手术时间为121分钟(44–189分钟),绝大多数手术都是在全麻下进行的。机械循环支持需求仍然不常见(范围为4%至16%),虽然肌力药物常被用来降低急性失代偿性心力衰竭的风险。在Tendyne扩展临床研究中,没有出现需要静脉-动脉体外膜肺氧合(VA-ECMO)的情况,但有四名患者使用了主动脉内球囊反搏(IABP)来治疗急性左室功能不全。86.5%的患者需要术中肌力药物支持,所有患者在术后早期均停止了肌力药物。其他TMVR器械对机械循环和肌力药物需求的详细数据仍然有限。
术后管理
急性左室功能障碍的处理
急性左心室功能障碍的临床表型最常表现为低血压,毛细血管楔后压力或左心室舒张末期压力增加。TEE显示LVEF突然下降、左心室腔急性扩张和/或自发声学显影。图4为TMVR相关心源性休克的管理流程。
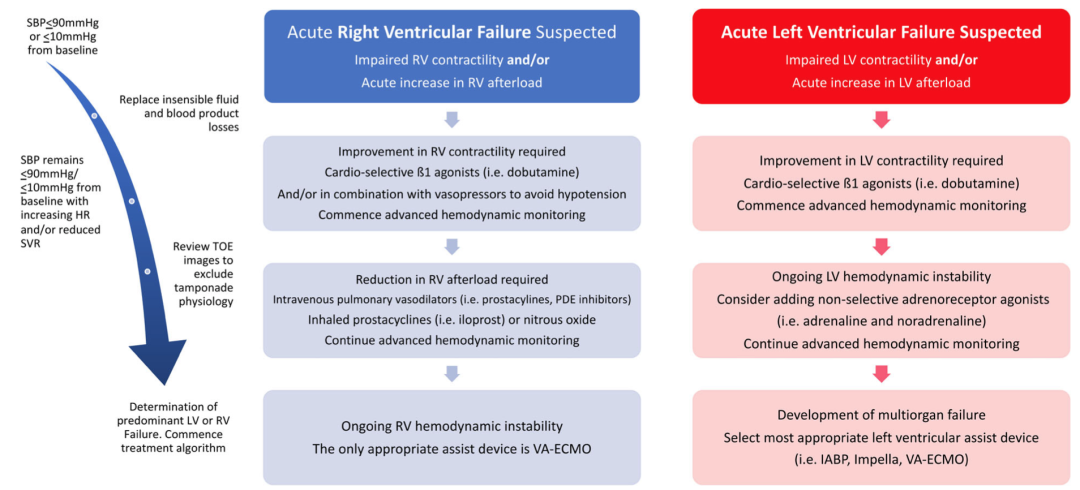
图4 TMVR相关心源性休克的围手术期管理
首先,建议充分补充无感液体和/或血液丢失量。对于术前有更严重左心室功能障碍的患者(LVEF<40%、LVEDD>6 cm、LVESD>4 cm、心输出量<3.0 L/min或心脏指数<2 L/min/m²的患者),建议在血液动力学出现不稳定特征前,优先使用药物促进心肌收缩。优先使用心脏选择性β1激动剂(如剂量起始范围为2.5–5μg/kg/min[最大10μg/kg/min]的多巴酚丁胺,其也具有β2诱导的血管舒张作用减少后负荷),而不是非选择性肾上腺素受体激动剂(包括肾上腺素和去甲肾上腺素),后者可能会过度增加左心室后负荷。如需要,应植入IABP用于稳定左心室后负荷逐渐增加的TMVR患者,因为任何血液动力学不稳定都可能是短暂的。VPA-ECMO很少应用,但对血流动力学严重不稳定的患者可能是必要的,尤其是那些有出血并发症并需要长时间心尖修复的患者。需要IABP或VPA-ECMO机械循环支持的患者术后早期死亡的风险最高。
急性右心室功能障碍的处理
TMVR的患者不太可能发生急性右心室功能障碍,但在术后如出现长时间低血压的情况下,应考虑可能出现急性右心室功能障碍。右心室功能恶化可能是由于左心室功能受损(由于左心室后负荷增加或左心室间隔运动受损)、右心室游离壁功能障碍或未识别的肺动脉高压引起的右心室后负荷增加。右心房压力>15mmHg,跨肺压力梯度>15mmHg,PVR>5WU和/或PAPi<1.85为急性右心力衰竭的高危指标。超声心动图测量,如PASP>50 mmHg、≥2+TR和/或TAPSE<15 mm,也可能被认为是危险因素。急性右心室功能障碍的临床表型可能包括中心静脉压或肺动脉压突然升高、TEE显示RVSWi下降、RAP/PCWP比率增加,伴有右心室扩张和收缩功能恶化。
如果临床、血流动力学或超声心动图指标表明可能进展为急性右心室衰竭,应对患者进行药物支持治疗。对于游离壁收缩力受损的患者,心脏选择性β1激动剂,如多多巴酚丁胺(剂量起始范围为2.5–5μg/kg/min静脉注射[IVI,最大剂量10μg/kg/min])被视为一线治疗药物。如果先前未识别或肺动脉高压不断升高导致急性右心室压力超负荷,可能需要使用肺血管舒张剂,如米力农(10分钟内负荷剂量为50μg/kg,随后为0.375–0.75μg/kg/min IVI)或吸入/静脉注射前列环素,如伊洛前列素(2.5μg吸入,随后为5μg推注[最大45μg/24 h])(图4)。
术后即刻管理
谨慎的术后管理是手术成功的关键。目前建议TMVR患者应以与外科MVR患者类似的方式进行管理,并通过明确的流程从重症监护室切换到特护病房,然后再切换到普通病房。需要达到明确的血液动力学指标,包括mPAP,心脏指数和所需容量状态。应保持对心尖部位出血并发症的警惕。早期拔管和走动以促进快速恢复。左胸腔积液非常常见,可能需要引流。在血液动力学稳定的患者中,建议在48小时内取出肺动脉导管和动脉线,并在清醒和非禁食后进行连续经胸超声心动图检查,以确定二尖瓣压力梯度和收缩功能稳定。目前还没有证据表明在接受TMVR的患者中使用直接口服抗凝剂的益处。
术后并发症,死亡率和心力衰竭再住院
残余MR
可行性试验和真实世界的登记研究数据均证实,在接受TMVR的患者中,96–100%的MR降低为≤1+。与TEER不同,在TEER中,残余MR的程度与较差的结果相对应,这在TMVR中并未得到验证。在对96名接受TEER或TMVR的左心室功能障碍患者进行的配对分析中,96%的TEER患者的MR≤2+MR,而TMVR患者均无残余MR。两组患者经倾向评分匹配后,在30天时,TMVR和TEER主要终点(全因死亡率或心力衰竭住院率)没有显著差异,然而,在第1年时,尽管残余MR更低,TMVR患者的全因死亡率或心力衰竭再住院率实际上更高(TEER:n=5[10%]vs.TMVR:n=15[32.6%];p=0.008)。
血栓形成、出血和抗凝
术后,TMVR患者一般应用联合抗血小板治疗(阿司匹林81–100 mg/天或氯吡格雷75 mg/天)和抗凝治疗(IVI-肝素联合华法林治疗≥3个月[或房颤患者终身服用]),目标国际标准化比率应达到2.5–3.5。这与TEER术后完全不同,TEE术后使用阿司匹林(每日100 mg)和氯吡格雷(每日75 mg)方案,持续3个月。在Tendyne扩展临床研究中,30天时,入路部位和出血并发症并不常见,然而,在前100名患者中发现瓣膜血栓形成率(1年时为6%)相对较高。TENDER登记研究显示,30天时血栓形成和出血事件的发生率明显更高。在全球可行性研究的2年结果中,累计血栓/出血事件分别为9%和27%。目前已知器械、手术(即MAC/环/瓣中瓣)和患者相关因素(包括房颤、左心室功能障碍、高凝状态和抗凝不足)与血栓和出血并发症的发生有关。建议在TMVR前进行筛查,以评估出血和血栓形成的风险。
死亡与心力衰竭再住院
尽管TMVR的手术成功率很高,但TMVR的30天至1年死亡率和心力衰竭住院率仍高于TEER患者。目前为止,这一现象仍未得到充分的理解或解释。
在医院康复期间,经心尖入路TMVR的30天和1年死亡率更接近于开放手术。经心尖入路TMVR方法是否有晚期不良后遗症(即血栓形成、心肌破裂、心律失常)的研究较少,但值得注意。急性手术成功率高但死亡率持续升高的问题仍令人担忧。在第二个术后时期(即30天至1年),优化心力衰竭症状、遵守指南指导的药物治疗和密切监测抗凝方案仍然是临床医生管理TMVR患者的首要任务。
总结
在TMVR术前,心力衰竭很常的,这些病人的围手术期管理需要有效的团队合作。与其他导管二尖瓣修复治疗相比,接受经心尖TMVR的患者30天和1年结果与开放手术更为一致,这表明在技术发展阶段外,这些患者的心力衰竭和抗凝的最佳管理仍需进一步优化。在TMVR器械植入过程中建立侵入性血流动力学检查对于拓宽这一认知至关重要。早期经验表明,左心室后负荷增加大多是短暂的,左心室收缩力能够得到很好的维持。右心室收缩性的改善更为明显,最有可能与MR的消除和左心室容积减少和肺动脉压降低间接改善有关。TMVR可行性研究的结果在每一步均取得了重要进展,从患者选择到手术操作和器械研发。仔细优化药物治疗和考虑术中血流动力学是未来努力的关键。
参考文献:
Hungerford SL, Dahle G, Duncan A, Hayward CS, Muller DWM. Peri-procedural management of transcatheter mitral valve replacement in patients with heart failure. Eur J Heart Fail. 2022;10.1002/ejhf.2758. doi:10.1002/ejhf.2758