
2023年5月(总第4期)
亮点:
●外科手术和经导管主动脉瓣和二尖瓣生物瓣的耐用性有限,并且容易发生结构性的瓣膜衰退。
●仅考虑与瓣膜相关的再干预或死亡低估了结构性BVD的发生率。
●结构性BVD的定义需要通过影像学来证实瓣叶、瓣架或支架的永久性结构改变和血流动力学衰退。
生物瓣功能障碍(BVD)和生物瓣衰败(BVF)可能由结构性或非结构性原因引起。由于瓣膜结构性的衰退,外科瓣膜和经导管生物瓣膜的耐用性都有限。目前尚不清楚经导管置换的瓣膜是否具有类似于外科手术置换瓣膜的长期耐用性。准确描述BVD和BVF的患病率和结局仍存在挑战。基于瓣膜再干预或死亡仅获得了最严重的病例,所以结构相关性的BVF的真实发生率和发生时间被低估了。此外,许多严重BVD患者可能不会接受瓣膜的再干预治疗,因为他们拒绝或者认为风险太高了。尽管结构性BVD直接或间接导致死亡,但死亡原因不能归类为与瓣膜相关。由于这些原因,使用成像技术而不是由是否干预来定义BVD是重要的。然而,早期仅局限于高跨瓣压力梯度来定义结构性BVD和BVF高估了其发生率,因为他们还包括人工瓣膜-患者不匹配(PPM)等非结构性功能障碍。
最近的声明,包括欧洲心胸外科协会/欧洲经皮冠状动脉介入治疗协会、VIVID(瓣中瓣国际数据库)和VARC 3(瓣膜学术研究联盟-3)利用超声心动图对瓣膜形态学和血流动力学衰退的随访重新定义了结构BVD。本专家共识文件的主要目的是提出或补充以下方面的标准化定义和测量方法:主动脉或二尖瓣生物瓣置换术后的非结构性和结构性BVD和BVF。这些定义支持研究中的标准化报告并有助于指导临床实践。
主动脉瓣BVD的评估
人工瓣膜的结构和功能成像对于评估BVD的存在、阶段和类别至关重要,经胸超声心动图(TTE)是评估的主要方式,计算机断层扫描(CT)可提供有关BVD病因学的重要增量信息。尽管美国指南建议在外科主动脉瓣置换术后(SAVR)基线、5年、10年和此后每年进行TTE随访,最近的使用建议指出,在SAVR后<3年内进行TTE随访可能是合适的,特别是在人工瓣膜跨瓣压差升高的情况下。写作小组的意见是,在使用生物瓣膜进行SAVR或经导管主动脉瓣置换术(TAVR)后,建议在基线时进行TTE,理想情况下是术后1至3个月、1年,此后每年进行一次,或在出现任何新的症状或怀疑有并发症时的任何时间进行。表1总结了测量人工生物瓣膜血流动力学的超声心动图参数的主要建议。应特别注意左心室(LV)流出道直径和速度的测量,这在手术或经导管人工瓣膜的情况下通常具有挑战性。
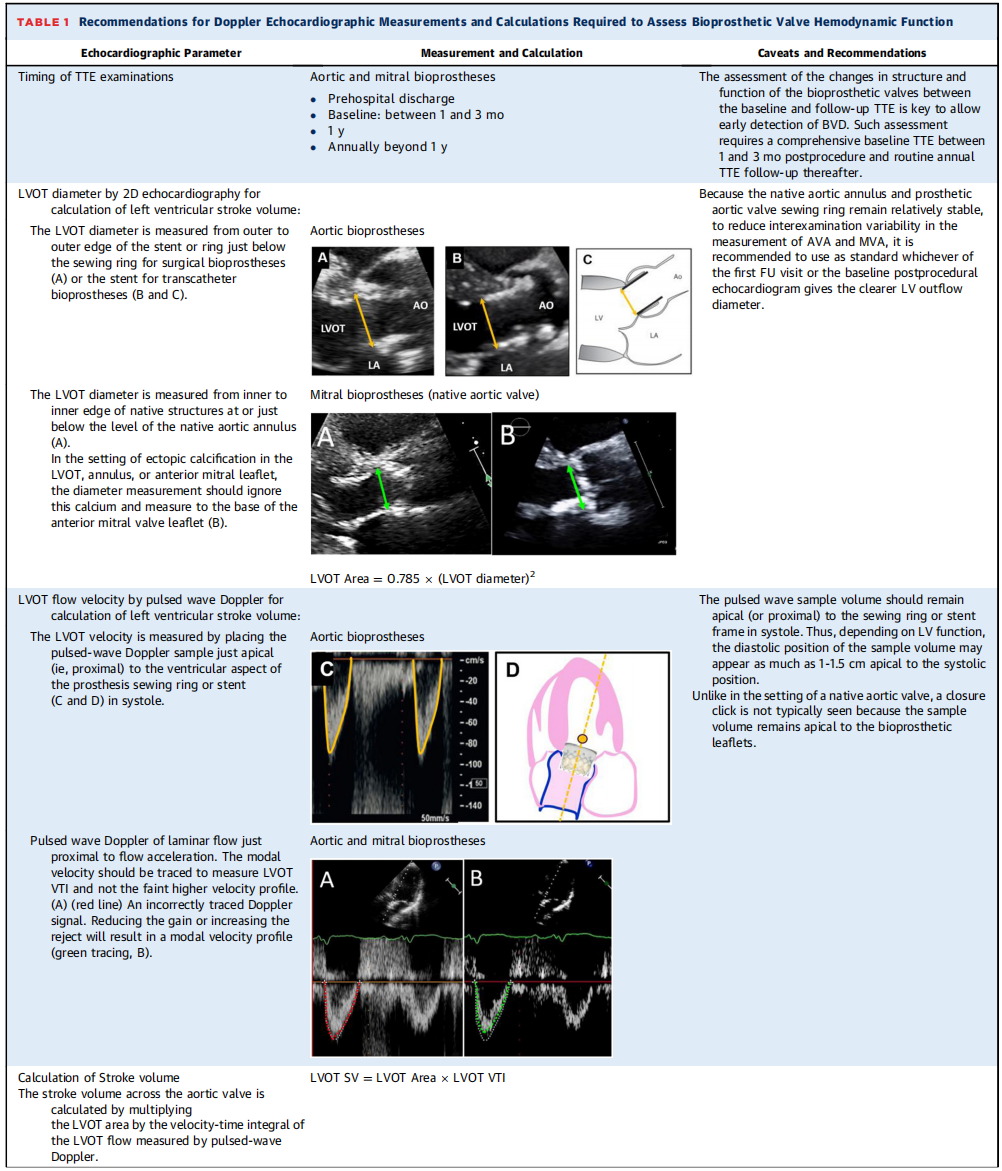
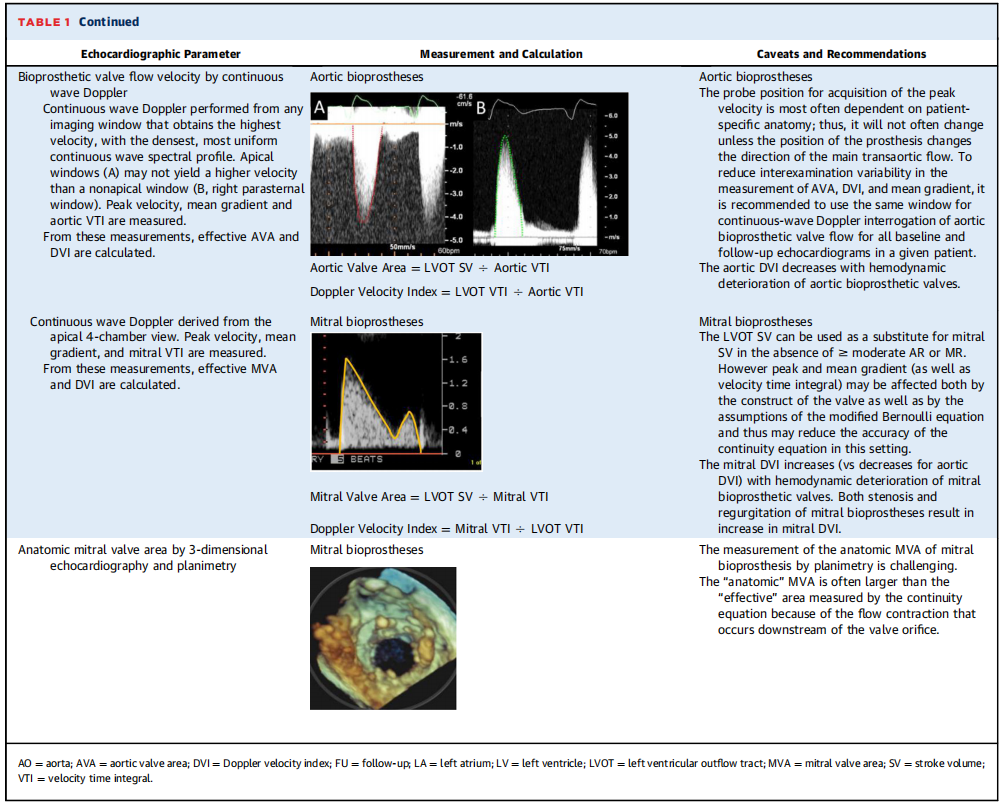
表1:评估生物瓣膜血流动力学所需的多普勒超声心动图参数测量和计算的建议
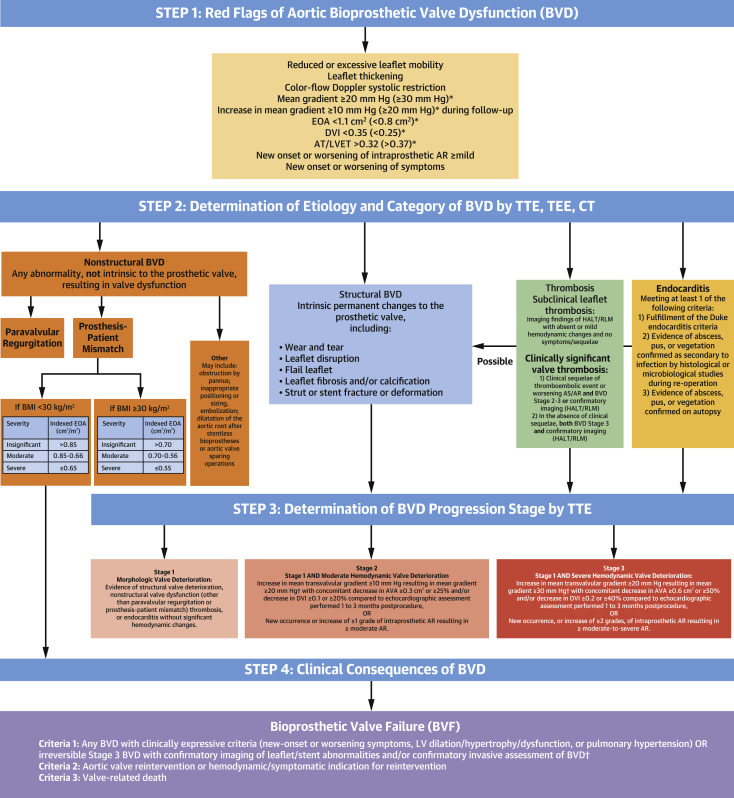
图1:主动脉瓣生物瓣BVD和BVF的检测、分期和分类
上图显示了主动脉瓣生物瓣BVD的检测、分期和分类的4步算法。*代表高度可疑BVD的红色预警。当临床存在和/或超声心动图红色预警(第1步)但无法通过TTE或其他方法(TEE或CT)来确认小叶/支架的永久性结构异常时可以使用心导管术对平均梯度或有效瓣口面积进行侵入性测量。AR=主动脉瓣返流;AS=主动脉瓣狭窄;AT=加速时间;BMI=体重指数;BVD=生物瓣膜功能障碍;CT=计算机断层扫描;DVI=多普勒速度指数;EOA=有效瓣口面积;FU=随访;HALT=低衰减小叶增厚;LVET=左室射血时间;RLM=小叶运动减弱;TEE=经食管超声心动图;TTE=经胸超声心动图。
图1描述了关于主动脉的BVD和BVF的检测、分期和分类的4步算法。对步骤1中描述了任何临床或超声心动图异常的存在应引起对BVD的怀疑,并在必要时进一步的TTE评估和其他检查(经食管超声心动图[TEE]、多排螺旋CT或心导管术)来确认BVD的存在(表2)。步骤2通过TTE和其他成像方式来评估瓣膜小叶的形态和活动度是区分BVD可能病因的关键:即非结构性BVD、结构性BVD、瓣膜血栓形成和瓣膜心内膜炎(图1,表3)。步骤3包括从基线到随访期间的TTE检查生物瓣的形态或功能的任何变化,来确认BVD的存在并确定BVD进展的阶段:第1阶段:瓣膜形态学衰退,但无明显血流动力学变化;第2阶段:中度血流动力学瓣膜衰退;第3阶段:严重血流动力学瓣膜衰退(图1、表4)。没有形态学或血流动力学瓣膜恶化(第1、2或3阶段)并不排除非结构性BVD的存在,而第2或3阶段的存在意味着存在形态学瓣膜改变(第1阶段)(中心插图)。
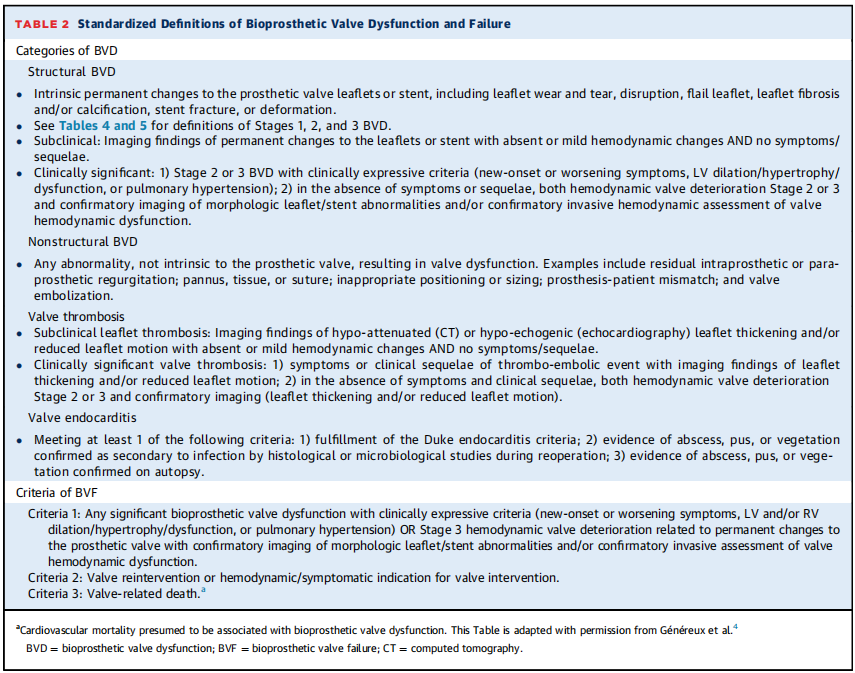
表2:生物瓣功能障碍和故障的标准化定义
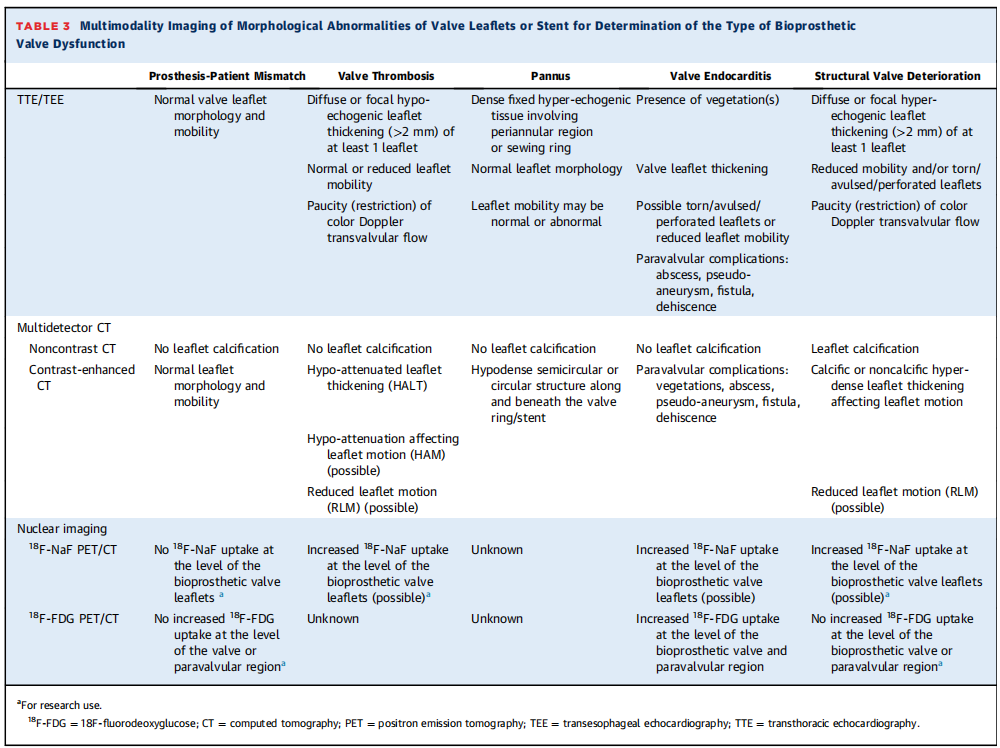
表3:瓣叶或支架形态异常的多模态成像,用于确定生物瓣膜功能障碍的类型
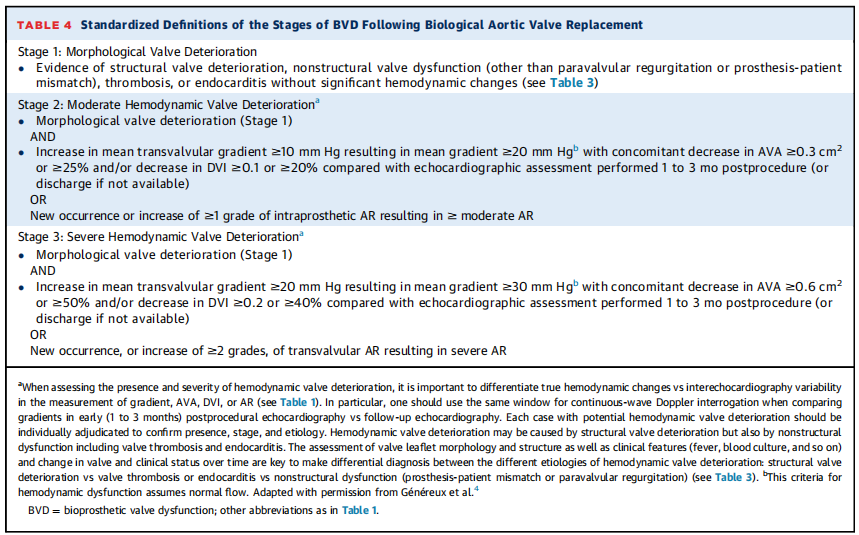
表4:主动脉瓣生物瓣置换术后BVD阶段的标准化定义
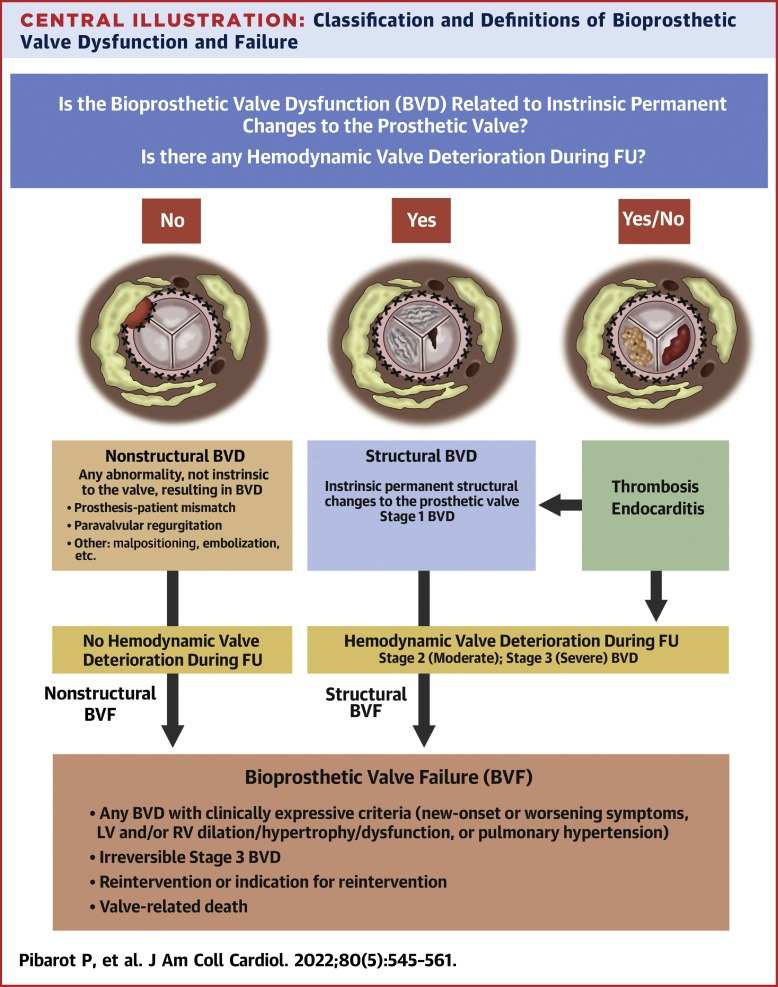
中央插图:生物瓣功能障碍和失效的分类和定义
非结构性BVD
非结构性BVD定义为任何非瓣膜装置的固有异常,导致血流动力学瓣膜功能障碍(图1,表2)。包括瓣周返流;瓣下血管翳过度生长;定位不当(包括术中位置不当和术后迁移)或尺寸(型号过小或过大)以及PPM。血管翳在VARC-3中被归类为非结构性BVD,因为它与生物瓣膜本身结构的衰退无关。然而,血管翳的发展可能导致获得性和不可逆的BVD,最终可能需要重新干预。
瓣周返流和PPM是非结构性BVD的两个重要原因,生物瓣瓣叶本身没有形态学异常(中央插图)。TEE可能有助于区分瓣周返流(非结构性BVD)与跨瓣返流(即结构性BVD)。这些非结构性BVD在最初瓣膜置换手术开始时就已经存在,并且通常在随访期间保持稳定。然而,在一些罕见的病例中,瓣周返流可能在随访期间改善或进展,或者可能在植入时没有但在随访期间发生,通常是由于感染性心内膜炎的结果。因此,PPM以及绝大多数瓣周返流病例不能归类为1、2或3阶段的BVD:即在随访期间没有形态学或血流动力学上瓣膜衰退的证据(图1,表4)。尽管如此,非结构性BVD仍可导致BVF并最终需要重新干预(中央插图)。
主动脉瓣PPM定义为有效瓣口面积指数(EOA)≤0.85cm²/m²;严重的PPM为瓣口指数EOA≤0.65cm²/m²(图1)。瓣口指数EOA的较低值(即中度和重度PPM分别≤0.70和≤0.55cm²/m²)适用于肥胖患者(体重指数≥30kg/m²)的主动脉瓣PPM。
结构性BVD
结构性BVD定义为瓣膜固有的永久性变化,包括生物瓣膜小叶、支架、缝合环或瓣座(图1、表2和4)。结构性BVD包括小叶磨损和撕裂、破裂、连枷样小叶、小叶纤维化和/或钙化和增厚,以及影响血流动力学性能的瓣座或支架的断裂或变形。因此,结构性BVD的诊断需要满足1阶段BVD的标准,并通过TTE或其他成像方式(即TEE或CT)记录生物瓣的不可逆结构变化(表3,中央插图)。瓣膜结构性衰退进程常从第1阶段开始:即瓣膜出现结构变化,但是没有血流动力学功能的衰退;然后发展到第2阶段:有中度血流动力学的瓣膜衰退;然后发展到第3阶段:严重的血流动力学的瓣膜衰退,最终发展为BVF(表4)。但是,也有例外;例如,瓣叶出现重大和急性结构变化,如小叶脱垂、撕裂或穿孔,可能导致严重的血流动力学瓣膜衰退(即第3阶段)和立即BVF。因此,这些阶段不一定在所有患者中都是连续的。
在随访期间TTE发现高平均跨瓣梯度(>20mmHg)和/或有效瓣口面积(EOA)(<1.2cm²) 或低多普勒速度指数(DVI)(<0.35)是红色预警但不足以确认BVD的存在和病因。事实上,没有因血栓形成或结构性瓣膜衰退导致的获得性人工瓣膜狭窄的情况下,严重的PPM可能会导致跨瓣梯度升高。这就是为什么形态学改变和血流动力学衰退对于结构性BVD的定义是必要的(图2,表4)。支持结构性BVD诊断的血流动力学变化关键是梯度显著增加,同时EOA或DVI减少和/或跨主动脉瓣返流新发或加重(表4)。因此,除非梯度非常高(≥50mmHg)并且瓣膜结构明显异常,否则不应建立结构性BVD或BVF的诊断,并且不应仅基于随访期间单一TTE检查显示的高压力梯度和/或小的瓣口面积(AVA)或DVI。
瓣膜血栓形成
瓣膜血栓形成可分为亚临床血栓形成和有临床意义的血栓形成(表2)。如果通过TTE(梯度增加或瓣叶运动减弱)或由于临床事件(血栓栓塞事件、心力衰竭)怀疑瓣叶血栓,应通过对比增强CT或TEE进一步检查以确认诊断(表3)。在CT上,目前临床瓣叶血栓形成的定义需要存在低衰减小叶增厚(HALT)和小叶运动减弱(RLM)。影响小叶运动的低衰减被认为是小叶血栓的同义词。当存在HALT/RLM或影响小叶运动的低衰减但没有或轻度瓣膜血流动力学衰退,且没有症状/后遗症时,考虑亚临床小叶血栓形成(图1,表2)。在高达50%的病例中,亚临床血栓形成无需任何治疗即可自发消退(表2和4)。目前,没有证据表明亚临床小叶血栓形成对临床结果有显著影响,因此在存在这种异常时没有理由进行抗凝治疗。具有临床意义的瓣膜血栓形成需要以下条件:1)出现临床血栓栓塞事件的后遗症或衰退相关性的狭窄或返流,以及血流动力学瓣膜功能障碍或影像学证实(HALT/RLM)。2)在没有临床后遗症的情况下,BVD3期(即严重的血流动力学瓣膜衰退)和影像学证实存在(HALT/RLM)(图1、表2和4)。与临床瓣膜血栓形成相关的BVD通常可通过使用维生素K拮抗剂进行抗凝治疗来解决,但在治疗结束后可能会复发。在某些情况下,它可能会发展为瓣叶纤维化和钙化,从而变得不可逆(即结构性BVD),最终导致BVF和再干预(图1,中央插图)。需要进一步的研究和指南来确定预防和治疗TAVR或SAVR后瓣叶血栓形成所需的抗凝方案类型和持续时间。
瓣膜心内膜炎
生物瓣膜心内膜炎至少符合以下标准之一:1)满足Duke心内膜炎标准;2)再次手术期间组织学或微生物学确认继发于感染的脓肿、脓液或赘生物的证据;3)尸检证实有脓肿、脓液或赘生物的证据(图1、表2和表3)。心内膜炎通常与形态学和血流动力学相关瓣膜衰退有关,因此可能导致2期或3期BVD(狭窄和/或返流)(表4)。CT和正电子发射断层扫描(PET)-CT可为心内膜炎和脓肿等并发症的诊断提供重要的增量信息(表4)。心内膜炎相关的BVD可能会通过静脉注射抗生素来解决,或者可能导致BVF并需要再次干预(图1,中心插图,表2)。
生物瓣失效
所有类别的BVD(即非结构性、结构性、血栓形成或心内膜炎)都可能导致症状、心力衰竭或死亡和/或需要瓣膜再干预。因此,BVF定义的标准仍然是瓣膜耐久性的重要临床指标和再干预的触发因素(图1中的步骤4)。然而,与重新手术相比,经导管瓣中瓣 (VIV)手术通常相对简单且解剖结构有利;因此,再干预的界限是定义BVD临床影响的另一个重要考虑因素。表2显示了EACPI/欧洲心胸外科协会和VARC-3先前提出的BVF的3个标准的定义。BVF标准1包括以下内容:1)任何BVD(非结构性、结构性、血栓形成或心内膜炎)与临床表现(即新发或恶化症状、左室扩大/肥厚/功能障碍或肺动脉高压)相关;2)在缺乏临床表现的情况下,不可逆的3阶段BVD(图1,表2)。标准2包括瓣膜再介入或再介入的指征,意味着满足1期BVF的标准。标准3包括瓣膜相关性死亡。
二尖瓣BVD的评估
与主动脉瓣生物瓣一样,二尖瓣BVD和BVF的检测、分期和分类主要基于TTE对生物瓣膜结构和功能的随访(图2、表2和5)。其他成像方式,包括CT可以提供重要的补充信息,特别是对于二尖瓣BVD类别的鉴别诊断(表3)。表5描述了二尖瓣BVD的分类和分期标准。二尖瓣压力梯度高度依赖于流量和时相,并且二尖瓣射流和舒张期充盈时间可能因患者而异。因此,我们不支持在随访期间使用梯度增加的指标(图2、表5),而是将随访期间DVI的变化作为怀疑存在血流动力学瓣膜衰退并确定二尖瓣BVD进展阶段的主要标准。对于二尖瓣生物瓣,DVI定义为连续多普勒测量的二尖瓣口血流速度-时间积分与通过脉冲波多普勒测量的LV流出道速度-时间积分之比,因为该参数在存在二尖瓣生物瓣狭窄的情况下增加(图2,表5)。DVI>0.6的增加和/或二尖瓣EOA(通过连续性方程法测量)的减少,通常与随访期间平均梯度>5mmHg的增加相关,符合2阶段BVD(即中度血流动力学瓣膜衰退)。与主动脉生物瓣膜一样,二尖瓣BVD可分为非结构性和结构性功能障碍、血栓形成和心内膜炎(图2、表2和表3)。

表5:二尖瓣生物瓣置换术后BVD阶段的标准化定义
二尖瓣BVD的分类
非结构性BVD定义为任何非瓣膜装置固有的异常,导致二尖瓣功能障碍(图2,中央插图,表2)。包括二尖瓣瓣周返流;血管翳、腱索或缝线卡顿小叶;位置或尺寸不当,以及PPM。二尖瓣PPM定义为EOA≤1.2cm²/m²,严重PPM指EOA≤0.9cm²/m²(图2)。对于二尖瓣PPM,EOA的较低值(中度PPM≤1.0和重度PPM≤0.75cm²/m²)适用于肥胖(体重指数≥30kg/m²)患者。中度PPM、重度PPM可能发生在20%-70%、2%-10%的二尖瓣置换术中。严重的二尖瓣PPM与二尖瓣置换术后的存活率降低和肺动脉高压无法消退有关。
二尖瓣与主动脉瓣生物瓣的结构性BVD、瓣膜血栓形成和心内膜炎的定义参数和标准相似(图2、表2和5)。因此,在随访期间任何TTE测量到高峰值的E速度或平均梯度和/或高DVI或小的二尖瓣口面积不应被解释为结构性BVD的确认并用作再次干预的触发因素。对于二尖瓣生物瓣膜,结构性BVD的诊断需要通过TTE或其他成像方式可视二尖瓣小叶或支架的永久性结构变化,2阶段或3阶段结构性BVD的诊断需要在随访期间记录血流动力学瓣膜功能的显著衰退(狭窄和/或跨瓣膜二尖瓣返流)(表3和5)。TEE对评估小叶形态和二尖瓣生物瓣的活动性并确定瓣膜返流的位置和严重程度特别有帮助。
二尖瓣BVF
定义二尖瓣BVF的存在和分期的标准与主动脉瓣BVF的标准相似(图2,表2)。二尖瓣BVF患者可能会接受手术或经导管再介入治疗。
对主动脉瓣或二尖瓣疾病患者终生管理的影响
共同决策为患者选择合适的瓣膜
外科手术或经导管介入治疗的目的是减少自身瓣膜疾病造成的血流动力学负担、缓解症状、改善生活质量,并在某些情况下延长患者生存期。选择瓣膜修复还是置换取决于几个因素,包括患者的预期剩余寿命;修复瓣膜或人工瓣膜的预期耐久性;瓣膜解剖的成像(超声和CT)评估;PPM的风险;并发症的风险;继发瓣膜、主动脉或LV疾病;血管通路;和患者的偏好。因此,心脏瓣膜协作组强烈支持多学科心脏团队与患者共同决策采取个性化治疗方案。
在做出治疗决策时,应审查以下问题:1)机械瓣膜的耐用性优势,尤其是在年轻患者中,与终生抗凝的风险、不便和生活方式限制;2)对二尖瓣疾病进行瓣膜修复或年轻患者进行主动脉疾病的自体肺动脉移植手术(Ross手术)的可能性;3)生物瓣膜衰退的风险和时间进程;4)如果需要再次手术的选择和可行性。
患者从自体瓣膜疾病转化为人工瓣相关疾病
瓣膜置换术可以缓解但不能完全解决心脏瓣膜病,但是患者并不总是清楚这件事。如何协调患者对其瓣膜疾病的管理与实际临床选择的问题是复杂的(图3),这取决于对患者的教育和临床医生对患者偏好的有限了解,共同决策可能具有挑战性。例如,患者对再次手术风险(例如耐久性)的偏好存在很大差异。进一步研究清楚患者对这个问题的偏好是有帮助的,除此之外改善患者的教育背景和为患者和临床医生提供决策。
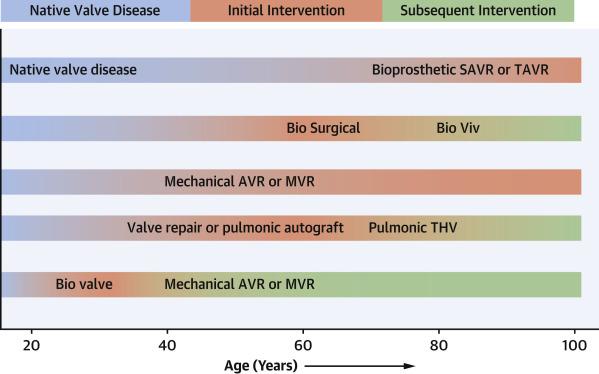
图3:瓣膜疾病在患者一生中的潜在轨迹
总结和结论
手术或经导管主动脉瓣或二尖瓣置换术后的BVD和BVF可能由结构性或非结构性瓣膜功能障碍引起。由于瓣膜结构性衰退,生物瓣膜的耐用性有限。基于瓣膜再干预或死亡的结构性BVF定义低估了BVF的真实发生率。然而,仅基于随访期间超声心动图中存在的高跨瓣梯度的定义高估了结构性BVD和BVF的发生率。高压力梯度可能是由严重的PPM引起的,这属于非结构性BVD。因此,主动脉或二尖瓣结构性BVD的定义必须包括通过 TTE、TEE和/或CT确认瓣叶(或支架)的永久性结构变化(即第1阶段BVD)以及随访期间TTE发现瓣膜血流动力学功能衰退的证据。(即中央插图第2或3阶段BVD)。
参考文献:
Philippe Pibarot, Howard C Herrmann, Changfu Wu,et al. Standardized Definitions for Bioprosthetic Valve Dysfunction Following Aortic or Mitral Valve Replacement: JACC State-of-the-Art Review. J Am Coll Cardiol, 2022, 80(5):545-561.
专家简介
王斌
武汉大学中南医院
向上滑动阅览
王霜
武汉大学中南医院
超声医学科教学主任、中国民族医药学会健康产业分会理事,主要从事心血管疾病的超声心动图临床及科研工作,曾在韩国首尔大学心脏中心研修心血管超声介入新技术,专注于介入及瓣膜病等围术期经食道超声引导及监测工作,参与多项临床试验研究,在国内外期刊发表学术论文数篇。

