导语
QFR(Quantitative Flow Ratio,定量血流分数),可无创、快速、精准地进行冠脉生理学评估,从而准确评估心肌缺血程度,指导优化介入手术策略,包括FAVOR III China及其亚组在内的一系列临床研究证明,应用QFR指导PCI介入治疗能使患者获益,并且能降低总体医疗负担。
欧洲经皮心血管介入治疗协会(EAPCI)发布2023年最新应用冠脉功能学进行PCI规划与指导的专家共识,详细阐述了应用QFR指导PCI介入治疗的全流程,并强调:博动QFR是唯一被证明能改善临床预后的基于造影的血流储备分数(FFR)工具。本次发布的EAPCI临床共识主要目的是就应用冠状动脉生理学评估技术进行PCI手术规划、病变类型识别和PCI预后优化提供最新证据和专家意见[1]。

从确定手术适应症到规划和指导PCI
当既往没有心肌缺血的证据时,指南建议使用FFR或瞬时无波比值(iFR)来评估冠脉中度狭窄导致血液动力学改变。多支病变(MVD)患者接受PCI治疗时也可考虑使用FFR进行评估[2]。在过去十年间,从仅通过冠脉造影来指导血运重建已扩展到如何更好地利用生理学工具干预得到最佳术后结果。生理学评估至少能在3个方面改善PCI的结果:1)改善手术规划并进行模拟,2)提高PCI术中的精准程度,以及3)优化PCI术后评估结果(图1)。

图1 冠脉生理学评估工具在规划和指导PCI手术中的应用
冠脉生理学评估在PCI中的应用进展
充血性和非充血性压力指数
此前,FFR是确定冠脉狭窄血流受限较广泛使用的生理学技术,许多临床研究表明,在慢性冠脉综合征(CCS)患者中,FFR可在临床上用于指导延期或立即进行血运重建。造影剂诱导的FFR依赖于碘造影剂给药诱导的次最大心肌充血,已被推荐作为FFR的无腺苷替代方式。与充血性压力指数相比,非充血性压力指数(NHPR)因其副作用更少、成本更低,手术时间更短和易于操作而在临床实践中得到越来越多的应用,这有助于在PCI术中对于不同血管或不同阶段进行多次测量。在1年和5年随访中,iFR(一种NHPR)指导的PCI治疗远期预后不劣于FFR指导的血运重建治疗[3]。
功能性冠脉造影
FFR和NHPR助推了生理学评估在冠脉狭窄诊疗中的应用,但其需要额外耗材、药物及伴随的副作用催生功能性冠脉造影(FCA)技术的发展。FCA可以从有创冠脉造影或无创计算机断层扫描冠脉造影(CCTA)中获得类似的信息,这两种方法得出的数值与基于压力导丝的FFR均具有良好的可比性。计算机断层扫描衍生的血流储备分数(FFRCT)是通过将CCTA血管的3D重建与流体动力学相结合来获得的,而博动医疗的QFR是唯一一个拥有前瞻性RCT(Randomized Controlled Trial,随机对照试验)研究证据且能提高血运重建临床获益的基于冠脉造影的生理学指标。基于博动QFR的冠脉生理学史上最大规模的RCT研究,即FAVOR III China研究,其结果证明,与传统冠脉造影相比,QFR在用于决定冠脉血运重建时,能够改善临床预后,该研究结果已于2021年发表在《Lancet》杂志上[4]。博动医疗一直秉持着持续创新的精神,迄今为止QFR技术已经经过3次迭代更新,名称由一代FFRQCA、二代QFR到三代μQFR(国际版为μFR)。
纵向血管功能分析
在PCI术前,当传感器穿过狭窄时,可以看到冠状动脉内压力下降,纵向血管功能分析可反映血管压力损失的分布情况,并区分病变是局灶性病变还是弥漫性病变(图2和图3)。纵向血管分析允许通过观察回撤曲线主观地或通过使用压力-回撤梯度指数(PPGindex)客观地识别疾病属于局灶性病变还是弥漫性病变,该指数可以手动进行测量,具有较高的可重复性。通过自动计算每单位时间的瞬时FFR梯度,即dFFR(t)/dt指数,可区分弥漫性和局灶性疾病PPGindex和dFFR(t)/dt也可通过博动QFR计算得出,并具有更强的简便性及可及性,且已有研究证明了其与临床预后的相关性[5][6]。PCI术后的纵向血管功能分析可以识别支架内和支架外的残余局灶压力梯度,为指导额外的支架后扩张或PCI手术提供切实的依据。

图2 用于定义阻塞性冠状动脉疾病的局灶性、串联性和弥漫性病变的标准
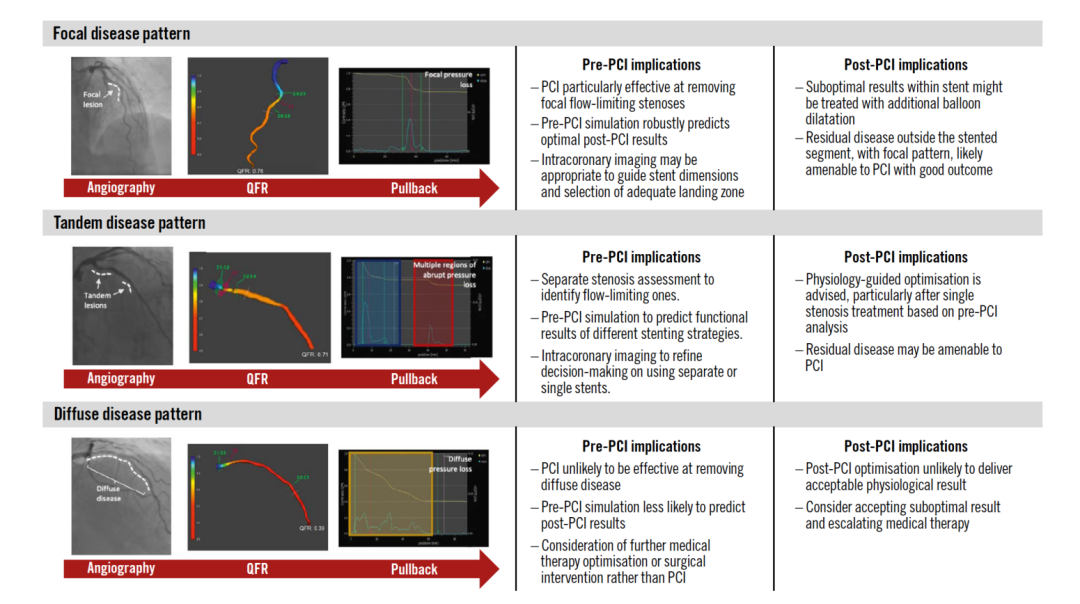
图3 PCI术前和术后通过纵向血管分析发现的血流限流性病变类型
与血管造影术配准
将博动医疗QFR定义病变生理学模式生理学与冠脉造影相结合,可以准确定位限流性动脉粥样硬化疾病,并有助于制定手术计划。配准图为压力损失区域的清晰分布提供了路标,从而能够对可能受益于PCI的特定靶病变进行最佳定位,并实现长度测量。
PCI术后生理学结果的模拟
尽管有证据表明,PCI术后冠脉生理学指标欠佳与较差的预后相关,但关于这些指标是否可用于优化PCI的手术方案并最终改善患者预后的证据相对较少。由于PCI的目的是解决产生缺血的病变,因此在植入支架前预测给定策略的血液动力学结果是避免产生次优干预结果的合理方法。有不同的方法来模拟基线纵向血管分析的功能性PCI结果(图4)。iFR回撤曲线的相关研究已经证明了其预测PCI术后结果的能力,回撤曲线也被证实用于其他NHPR,如全心动周期舒张压比率(RFR)和舒张期舒张压比率(DPR)。相较于其他指标,博动医疗残余QFR技术循证医学证据更加全面,已被证明可以预测PCI术后FFR[7],且与预后相关[8],模拟指导手术[9]或者实际指导手术[10]均可带来更优异的预后。

图4 基于纵向血管分析的功能性PCI术后结果模拟方法
PCI术后生理学评估
PCI术后利用生理学评估可以识别残余限流性疾病,区分残余局灶性病变和弥漫性疾病,并提供预后信息。虽然PCI术后较高的FFR与较低的不良临床结果发生率有关,但目前最佳PCI结果的临界点仍有争议。同样,目前基于博动医疗QFR多项术后最佳生理学结果与预后的研究其切值也存在不同,伴随不同临床疾病(如糖尿病)[11]、不同冠脉状态(多支病变、钙化等)[12、13],对患者术后生理学值可能越严格。PCI术后次优的生理学结果潜在机制如图5所示。PCI术后冠脉生理学评估指导下的额外干预措施可以改善最终临床预后,需注意避免过度治疗。例如当确定功能学不理想的原因,如需要治疗长病变或侵蚀性病变时,通过冠脉内成像可能有助于更好地了解次优功能学结果的原因,并有助于选择更安全的策略。

图5 PCI术后次优生理学结果的机制
影像学和生理学评估在PCI规划和指导中的互补作用
虽然PCI的目的是消除冠脉狭窄,但其长期效果受到手术器械、策略等因素的影响。血管腔内影像技术,如血管内超声(IVUS)和光学相干断层扫描(OCT),可以更好地解决手术因素的影响。此外,研究者更感兴趣的方向是,在易发生动脉粥样硬化病变进展或者斑块破裂的非血流限制的病变是否与未来更高的事件风险有关,而众多研究结果表明博动医疗RWS(Radial Wall Strain,径向壁应变)技术可以通过冠脉造影识别斑块进展及破裂风险[14、15、16、17],在临床应用上具有简便、精准及经济性,是心血管风险分层金字塔的至高点[18]。基于生理学(如博动医疗QFR的虚拟支架技术)提供的血流限制性狭窄的位置信息、斑块特征和分布信息以及与血管成像提供的血管直径结合,可能有助于选择PCI的器械和策略,包括病变准备、PCI无斑块着陆区以及支架直径和长度的选择,最终改善手术的长期预后。
基于冠脉生理学评估的PCI手术规划和优化流程
建议在PCI术前对靶血管病变进行全面的模拟分析,并在模拟的支持下协助手术规划和策略制定,博动医疗虚拟支架技术已得到临床验证,与基于造影指导PCI手术相比,虚拟支架指导可得到更优的术后生理学结果。PCI术后,应结合生理学和/或血管内成像技术对结果进行评价,并在残留局灶性病变或压力损失时进行PCI手术的优化。图6和图7分别显示了使用PCI术前和术后利用冠脉生理学进行综合病变评估的建议流程。
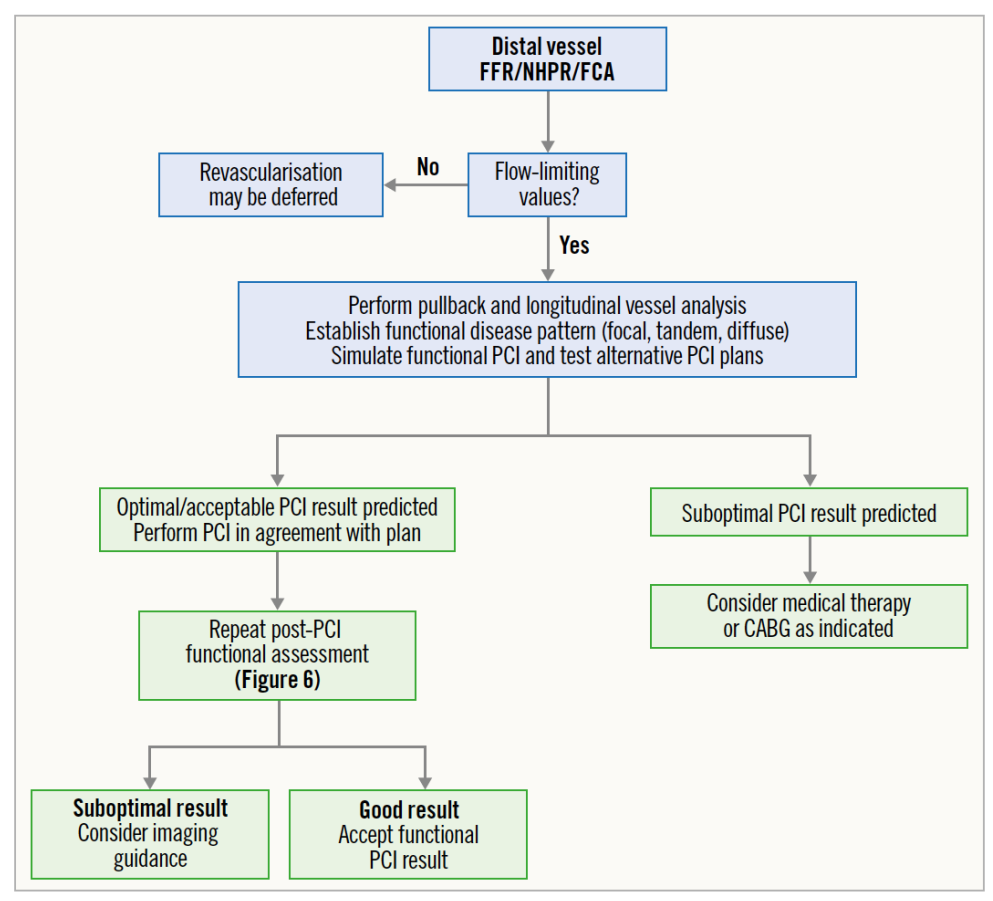
图6 PCI术前生理学评估和手术规划流程

图7 PCI术后生理学评估和功能性PCI结果优化流程
未来方向和展望
冠脉生理学评估技术在PCI手术规划和模拟中的应用是一个越来越令人感兴趣的领域。结合冠脉造影结果,基于压力导丝的生理学技术(以FFR为代表)或FCA技术(以QFR为代表)进行的生理学评估有助于权衡PCI手术规划中的重要决定。PCI术后的生理学评估则通过支架的纵向血管分析进一步优化PCI手术。这些生理学相关技术,再加上血管内成像手段,可以准确地识别不同的冠脉病灶类型,彻底改变了PCI治疗的方式,真正实现了术前、术中、术后的精准诊疗。