
杨剑
空军军医大学西京医院

本文特邀作者 空军军医大学西京医院 李兰兰 刘洋 杨剑
导语:
2022是特殊而不平凡的一年,疫情防控政策不断调整优化,3D打印技术在结构性心脏病领域的应用也取得了诸多进展:
首先,医学影像技术的发展使得心血管成像的速度、质量、分辨率及精度都得到很大程度提升,尤其是CTA、心脏磁共振(CMR)、三维超声图像等多模态影像技术融合,充分发挥出多种影像学技术和方法的长处,使得心血管影像学数据源具有充分保障;
其次,心血管3D打印技术的方法学和材料学也获得了长足发展,多彩多材料混合打印已成为结构性心脏病领域3D打印领域的常规技术,超声及DSA下透视可见材料的发展及应用,对于3D打印技术指导结构性心脏病介入治疗起到了至关重要的作用,连续液界制造(CLIP)等光固化革命性技术给心血管3D打印的临床应用打开更广阔的空间,新的复合水凝胶材料学给未来发展带来更多可能;
再次,3D打印技术在结构性心脏病领域应用范围越来越广阔,已涉及到经导管主动脉瓣置换术(TAVR)、经导管二尖瓣置换术(TMVR)、经导管二尖瓣缘对缘修复术(TEER)、经导管三尖瓣置换术(TTVR)、经导管肺动脉瓣置换术(TPVR),水凝胶治疗心衰、肥厚性心肌病射频消融、左心耳封堵等几乎全部的结构性心脏病诊疗新技术;
从次,3D打印技术在结构性心脏病领域于我国开始逐步推广及普及,据不完全统计,目前国内已有300+以上医院开展了3D打印技术指导结构性心脏病的应用,同时,我国的心血管医疗器械企业(马克医疗、健世科技等),已联合将3D打印指导结构性心脏病治疗的方法和理念,推广至美国Henry Ford医院,加拿大St.Paul医院,法国波尔多里尔大学附属医院,德国美因茨心脏中心等10余个国际知名中心;
最后,结构性心脏病领域3D打印技术的学术科研成绩斐然,2022年已有数十篇结构性心脏病领域3D打印技术SCI文章获得发表,由西京医院及阜外医院联合主编的《经导管主动脉瓣置换术中的3D打印技术》《经导管二尖瓣介入治疗术中的3D打印技术》等多部专著成功出版,顺利召开2022“国际心血管3D打印技术高峰论坛”,浓缩了来自海内外10个国家地区上百位顶尖专家在心血管3D打印领域深刻思想和前沿进展,同时,关于心血管3D打印的团体标准起草也列入日程。
目前,3D打印技术指导结构性心脏病诊疗的理念逐步深入人心,已为上千例患者提供个性化的精准数字化治疗方案,使心血管疾病治疗的概念、策略、技术不断更新,还会不断将我国结构性心脏病的诊治水平提升到新的高度。
应用高质量的医学图像数字化建模,可实现个性化且精准的心血管3D模型。
目前,随着影像技术的发展,可用于3D建模的临床影像数据主要包括CTA、心脏磁共振(CMR)、三维超声图像。
其中CTA影像因为采集时间短、范围广、图像质量佳等特点,成为了最常用于心血管建模的医学影像,新一代以CT-CardioGraphe 为代表的心血管专用型CT的面世及安装,在一个心跳周期内就能快速完成心脏动态图像的采集,能够在使患者受到的辐射量大为减少的同时,为心血管3D打印提供高质量的4D原始CT数据。
CMR图像的应用类似于CTA,尤其对于心腔、心肌的分割优势更为显著,但由于图像采集过程中耗时太久,并对患者有诸多限制,应用较少。
此外,心脏超声图像近年来也逐渐应用于3D建模打印,图像采集过程中不会产生辐射,并能清晰显示心脏瓣膜,对于显示局部复杂的动态结构具有一定优势,其局限性在于不良的声窗及探头位置、采集角度的变化将导致图像重复性不稳定。
如今,3D打印建模软件已能够实现CTA、心脏磁共振(CMR)及三维超声图像等多模态影像融合技术,这种方式可集合不同影像的优势并弥补不足,达到精准展示模型细节的目的。
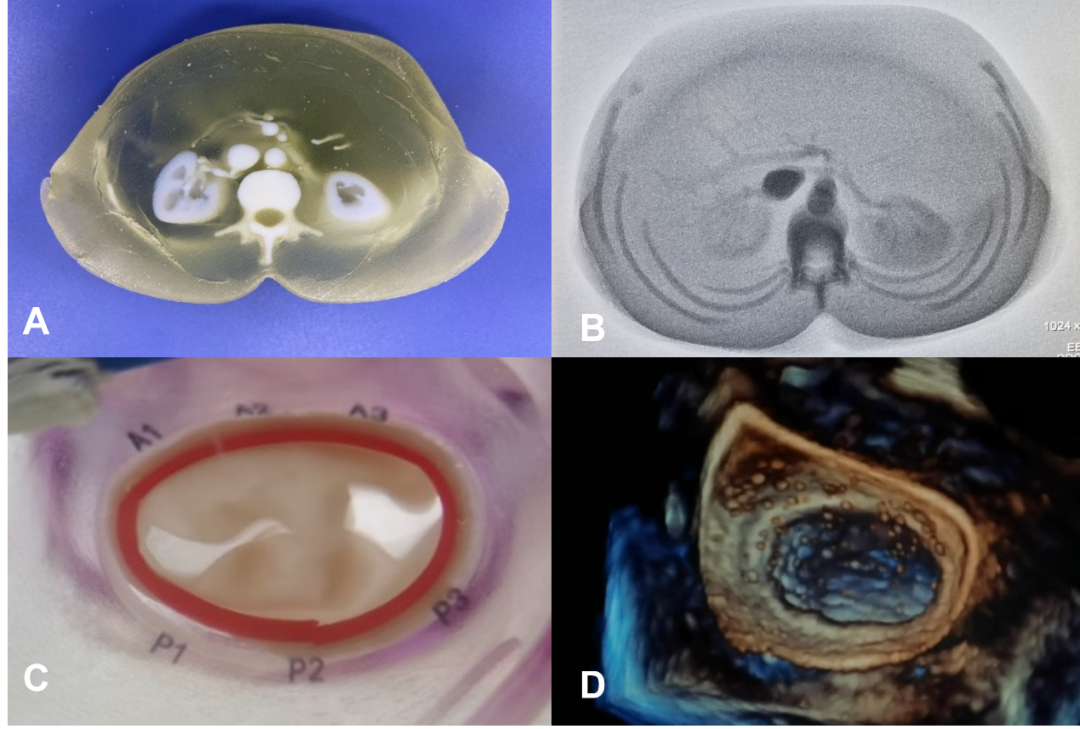
图1. DSA透视及超声下可见的心血管3D打印材料(A. DSA透视显影的心血管3D打印材料;B. A图材料的DSA透视影像;C. 超声下可见的心血管3D打印材料;D. C图材料的食道三维超声影像)
此外,近年来诞生的一项新的光固化革命性技术,连续液界制造技术,也就是CLIP技术(Continuous Liquid Interface Production),不仅大大加快了固化过程,相较于传统光固化技术提升了数十倍效率,同时也能打印出更精细的特征(小于20微米),而且可以使用弹性材料,以及某些生物材料,在未来CLIP技术将会给心血管3D打印的临床应用打开更广阔的空间。
2022年,西安交通大学唐敬达教授团队研发的复合水凝胶材料,可保障高拉伸性和良好的抗疲劳性,利用光固化技术打印了具有心脏瓣膜形态的模型,并在体外模拟实验中表现出了在流体环境下持续单向流动的功能。
目前,在结构性心脏病领域3D打印技术应用过程中,应根据实际需求,综合考虑打印机和材料成本、周期、精度、色彩、柔性等条件,选择最适宜的3D打印技术。
经导管主动脉瓣置换术(TAVR)可有效治疗主动脉瓣狭窄或关闭不全,近年来在我国获得蓬勃发展,2022年有近8000例的临床应用。TAVR手术全程采用DSA及超声等影像技术引导操作,术前利用患者个性化的3D打印模型,可直接观察主动脉瓣病变结构及毗邻结构(图2)。各种主动脉瓣疾病的解剖学差异巨大,主动脉瓣环、左室流出道、窦管交界、升主动脉尺寸各不相同,瓣叶的长度、厚度、钙化分布、瓣口狭窄等也千姿百态,因此需要TAVR团队认真分析每一例患者的具体解剖病理学特点,制定个性化手术策略。

图2. 多彩多材料3D打印的主动脉瓣病变及毗邻结构模型
面对解剖结构复杂患者,基于医学影像难以判断多种异常结构对手术风险的影响,术前可按照原始比例打印出类似于心脏组织材料的患者模型模拟球囊或介入瓣膜植入(图3),直观确定术后发生的挤压形变和相应的并发症,如瓣周漏、冠脉阻塞、瓣环破裂等。
西京医院马燕燕等回顾性纳入2018~2021 年在国内28 家心脏中心行TAVR 的868 例患者临床资料,研究结果表明心血管3D 打印对TAVR 的辅助指导作用显著,可缩短TAVR 手术时间,减少中度瓣周漏等并发症,助力TAVR 个性化方案的制订及精准实施,有着广阔的应用前景。

图3. 应用3D打印模型模拟TAVR手术(A. 体外模拟球囊扩张判断冠脉阻塞风险;B. 体外模拟球囊扩张判断瓣周漏风险;C. 体外模拟支架瓣膜植入)
西京医院翟蒙恩等的研究表明采用3D打印心血管模型体外模拟手术过程的教学方式,对于提高学员手术掌握程度和学习效率方面有重要作用。

图4. 应用3D打印模拟器模拟TAVR手术(A. 专家指导学员应用3D打印模拟器模拟TAVR手术;B. 模拟TAVR跨主动脉弓及跨主动脉瓣操作;C. 输送器头端跨越模拟器的瓣环平面;D. 模拟TAVR释放瓣膜操作;E.TAVR瓣膜在模拟器内完全释放,脉动流下启闭良好。)
如开发新的治疗主动脉瓣关闭不全的带定位件的器械,以及测试国产球囊扩张式瓣膜性能,都可以应用3D打印主动脉根部模型或3D打印模拟器模拟TAVR手术,于导管室内X线透视下真实体验经心尖入路植入Ken-Valve(宁波健世)的调节定位件入窦及完全释放过程,以及经股动脉入路植入PrizValve(纽脉医疗)显影点定位及释放位置确定等核心步骤,协助不断优化新型器材的设计开发(图5)。
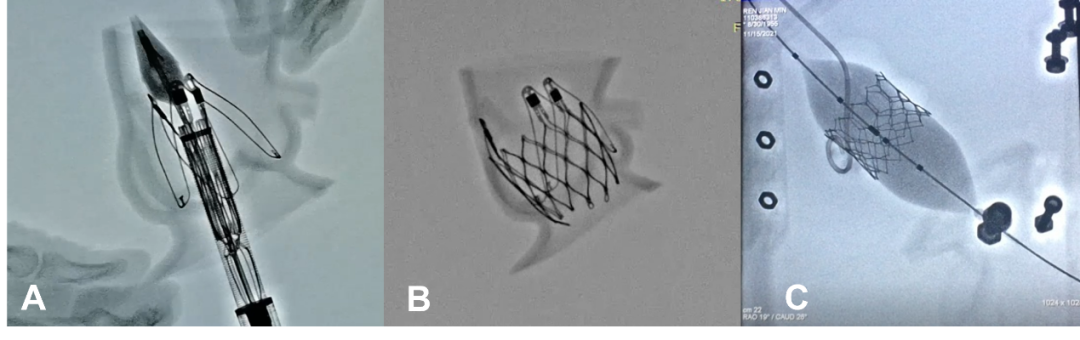
图5. 应用3D打印技术助力开发测试新型TAVR介入器械(A. 体外模拟Ken-Valve的调节定位件入窦;B. 体外模拟Ken-Valve的完全释放;C. 体外模拟PrizValve显影点定位及释放位置确定)
(2)3D打印指导经导管二尖瓣置换术
按照自体二尖瓣的病变情况,TMVR技术被分为四个大类 (图6):
① “瓣中瓣”(Valve in valve)技术,针对既往外科二尖瓣生物瓣衰败的患者;
② “环中瓣”(Valve in ring)技术,针对既往外科瓣膜成形术植入人工二尖瓣瓣环的患者;
③ 原位钙化瓣环植入(Valve in MAC),针对自身二尖瓣瓣环有严重钙化或关闭不全的患者;
目前国内西京医院、中山医院、阜外医院、华西医院等多家心血管中心已将3D打印技术与多种类型的TMVR技术相结合,开展多种3D打印指导的精准经导管二尖瓣置换术:评估新左室流出道面积,筛选适应症;辅助介入瓣膜更好地定位在二尖瓣瓣环,减少瓣周漏;有效地帮助术者选定精确房间隔穿刺点,精准选择瓣膜类型及型号,优化同轴性(图6-9)。
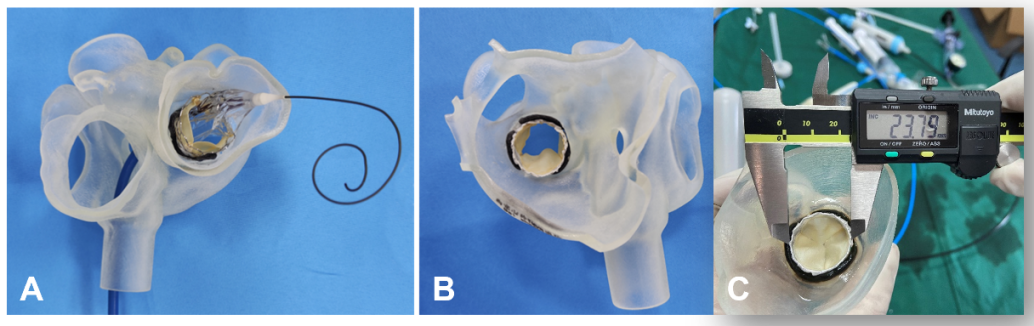
图6. 3D打印指导二尖瓣“瓣中瓣”技术(A. 应用球囊扩张式瓣膜,左室面观;B.完全释放后的形态,左房面观;C. 应用游标卡尺精准测量各项参数)
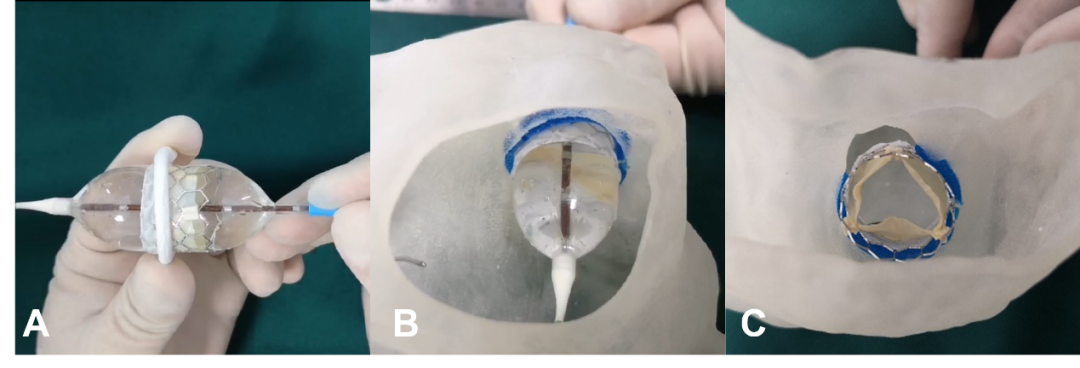
图7. 3D打印指导二尖瓣“环中瓣”技术(A. 于单纯成形环内应用球囊扩张式瓣膜;B. 应用球囊扩张式瓣膜于3D打印模型内模拟球囊扩张,左房面观;C. 完全释放后的形态,评估瓣周漏情况,左室面观)
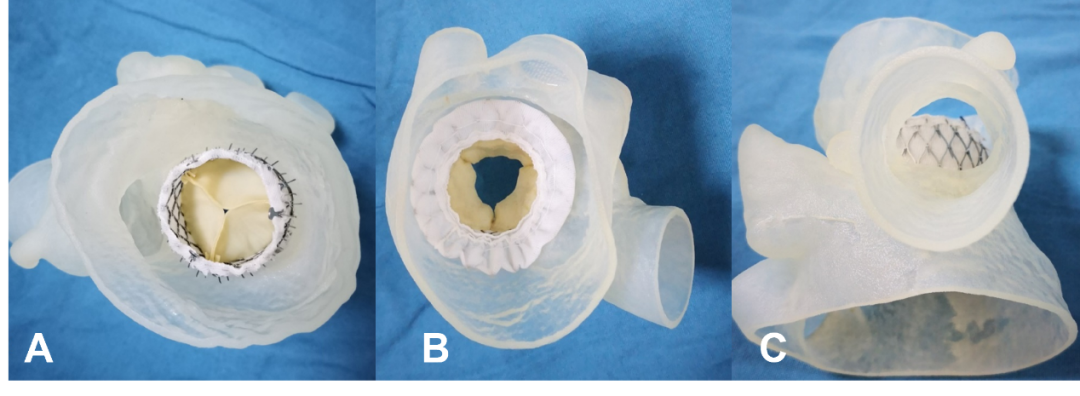
图8. 3D打印指导二尖瓣原位瓣膜植入技术(A. 完全释放后的形态,左室面观;B. 完全释放后的形态,左房面观;C. 完全释放后的形态,评估新左室流出道情况,主动脉面观)
(3)3D打印指导经导管二尖瓣修复术
国内马克医疗设计的TEER体外模拟器,可通过超声探头清晰观察瓣叶活动状态,并设计有多个房间隔穿刺预留口,能够真实模拟TEER全手术流程,有助于熟练掌握器械操作,提升术中人员间的默契配合并指导术者制定安全可行的手术策略。
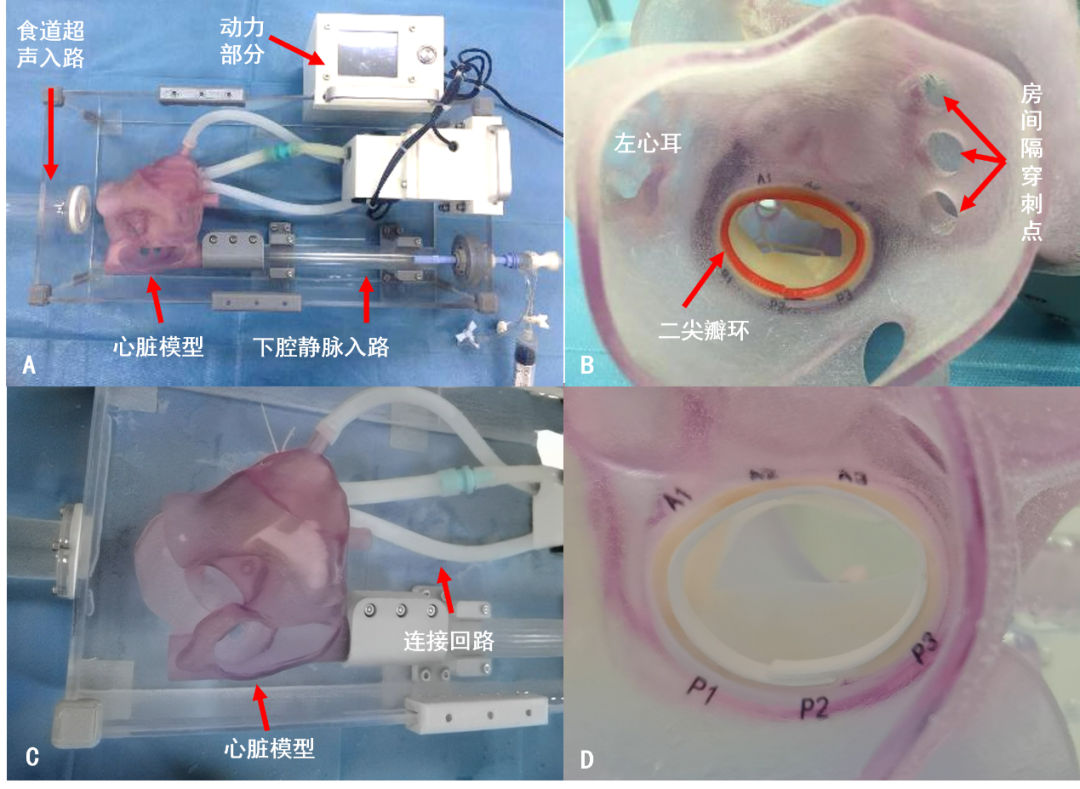
图9. 基于3D打印的脉动TEER模拟器 (A.模拟器的整体外观;B. 3D打印的全心脏模型,可见二尖瓣及不同房间隔穿刺位置; C. 全心脏模型左心房面观;D. 3D打印的二尖瓣,标记A区和P区)
(4)3D打印指导经导管三尖瓣置换术
我国自主知识产权的Lux-Valve及Lux-Valve plus(健世科技)是我国第一款具有自主知识产权的新型三尖瓣介入瓣膜,同时也是全球首款不依赖径向支撑力锚定的瓣膜,能够通过前瓣夹持件定位、室间隔锚定件防止移位,适应三尖瓣瓣环三维结构,并且降低了瓣周漏及传导阻滞等并发症的发生。长海医院及西京医院团队,应用3D打印技术体外模拟实验的方法,熟悉该系统的使用方式,确定瓣膜型号、介入瓣膜植入位置、系统调弯角度以及锚定位置等,实现精准释放(图10)。
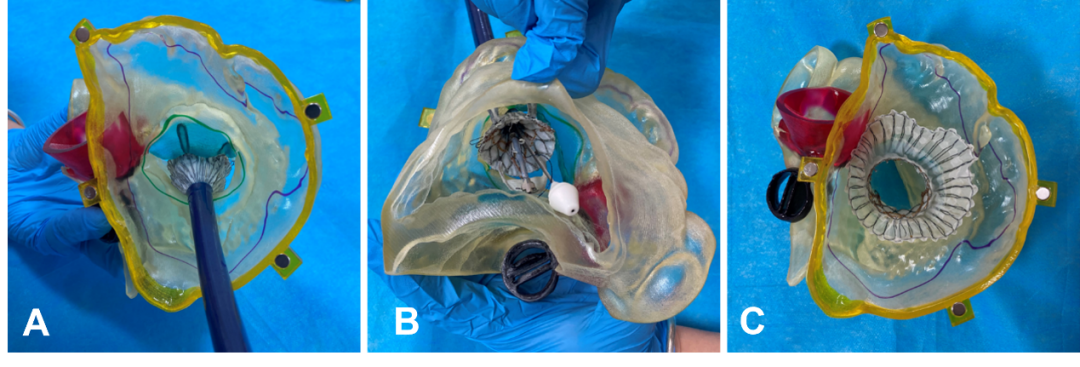
图10. 采用3D打印技术体外模拟Lux-Valve手术操作(A. 输送器跨越右心房,部分释放瓣叶抓捕装置,右房面观;B. Lux-Valve完全释放,右室面观;C.瓣膜完全释放,与自体模型良好匹配,右房面观)
同时,将该技术推广至美国Henry Ford医院,加拿大St.Paul医院,法国波尔多里尔大学附属医院,德国美因茨心脏中心等10余个国际知名中心,在TVT,TCTAP2022等国际会议进行报道和手术转播(图11)。
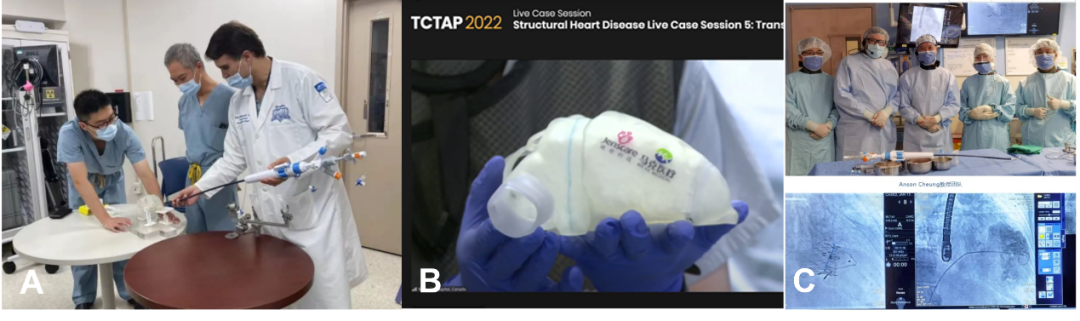
图11. 3D打印指导经导管三尖瓣置换术的全球推广(A. 加拿大专家术前应用3D模型模拟TTVR手术;B. TCTAP2022等国际会议进行报道;C. TVT国际会议进行手术转播)
(5)3D打印指导经导管肺动脉瓣置换术
经导管肺动脉瓣置换术(TPVR,又称经皮肺动脉瓣植入术PPVI),于2000年10月由Philipp Bonhoeffer教授团队首次报道,是最早应用于临床的经导管瓣膜置换技术,主要被用于治疗法洛四联症(TOF)外科矫正术后并发右室流出道狭窄和/或肺动脉瓣反流(PR)的患者,可替代外科肺动脉瓣置换,改善该类患者的长期预后。
2020年ESC成人先心病指南推荐对解剖条件合适的右室流出道功能不全患者应首选经导管治疗。阜外医院及西京医院团队,应用3D打印技术及杭州启明公司国产自膨式Venus-P肺动脉瓣膜及迈迪顶峰的PT Valve瓣膜,成功实施流出道结构较大且形态呈“金字塔”形等挑战性病例,术中显示瓣膜锚定良好,无瓣周漏,患者早期出院并正常生活(图12)。
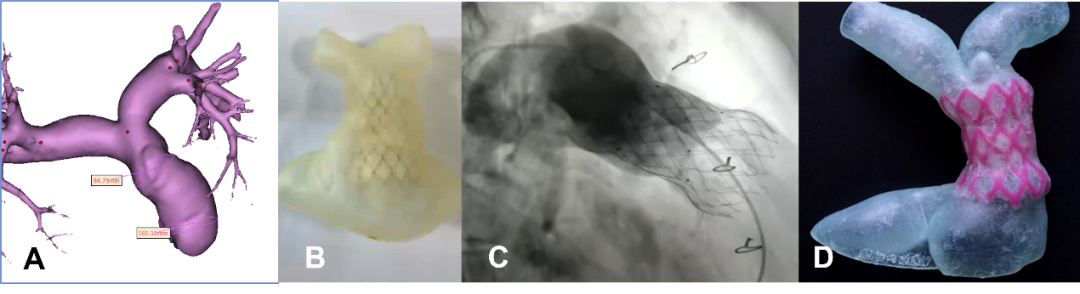
图12. 3D打印指导经导管肺动脉瓣置换术(A. 术前三维建模;B. 术前应用3D模型模拟TPVR手术;C. 手术中精准将瓣膜植入预定部位,取得良好手术效果;D.术后3D打印模型评估TPVR手术效果)
(6)3D打印指导室间隔射频消融术
近年来,超声引导下经皮穿刺室间隔射频消融术治疗梗阻性肥厚型心肌病取得了重大进展及突破。
该治疗技术也称为Liwen术式,是在超声引导下经皮通过心外膜穿刺将射频电极针经心尖送至室间隔肥厚部位,高频电波可使局部肥大心肌凝固坏死,从而达到拓宽左室流出道的目的,已于JACC、JAMA Cardiology等发表多篇高水平论著文章,充分证实该技术的安全有效性。
西京医院刘丽文教授团队利用3D打印技术打印出个性化肥厚性心肌病患者的心肌及室间隔肥厚部解剖模型,可明确观察心脏解剖结构,尤其是冠状动脉分布位置,确定最佳穿刺点位置,设定合理的电极针路径,防止电极针对冠状动脉以及传导束的损伤,保证手术的安全性。
2022年,3D打印技术已经作为Liwen术式术前的标准化评估流程中最为重要的一环,召开多期《Liwen术式治疗肥厚型心肌病培训班》,带教全国百余中心开展并培养多位独立术者(图13)。
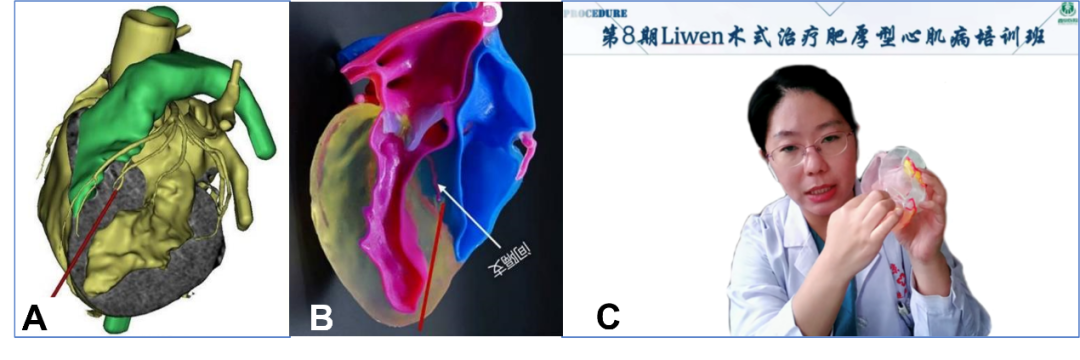
图13. 应用3D打印模型模拟Liwen手术(A. 术前数字化三维建模,标记手术入路;B. 3D模型精准展示局部解剖结构;C. 应用3D打印模型开展Liwen手术技术培训)
(7)3D打印指导左心耳封堵术
左心耳封堵术通过介入手术的方式应用专用封堵器堵塞左心耳,预防房颤时左心耳(LAA)血栓的形成,可达到药物抗凝的治疗效果,降低房颤患者由血栓栓塞引发长期残疾或死亡的风险及出血风险。
采用3D打印技术,可1:1还原左心房及左心耳模型,体外反复多角度测量左心耳口径及深度,规划房间隔穿刺位点并模拟手术操作,帮助医生多次模拟手术积累经验,提升手术成功率,缩短患者暴露在X线的时间和手术时间(图14)。
国内仁济医院、唐都医院、新桥医院、新疆维吾尔自治区人民医院、山西医科大学第一医院等多家医院已常规开展3D打印指导左心耳封堵术。
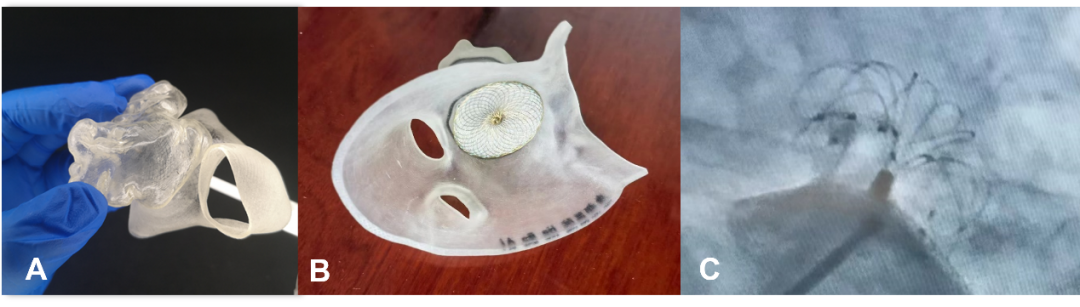
图14. 3D打印指导左心耳封堵术(A. 应用3D打印模型模拟左心耳封堵术;B. 于3D模型释放封堵器,评估封堵效果;C.超声及透视引导下行左心耳封堵术)
(8)3D打印指导经导管心内膜下藻酸盐水凝胶治疗心力衰竭
射血分数降低的心力衰竭(HFrEF)是一种源于心脏结构性或功能性病变使心室过分充盈,射血能力受损而形成的复杂的临床病症。
近年来,西京医院陶凌教授团队与德柯医疗合作攻关,成功开展经导管心内膜下藻酸盐水凝胶治疗:通过植入性海藻酸盐水凝胶,增厚心肌壁,为室壁提供力学支撑,降低室壁应力,维持心脏相对良好的形态、尺寸和力学性质,最终减缓甚至逆转心室的扩张,改善心脏的生理功能。于2021年3月19日开展了全球首例植入,该技术配合辅助应用3D模型,通过DSA(数字减影血管造影)与TEE(经食道超声心动图)双重导航定位,确保水凝胶安全且有效地递送,于2022年11月24日在European Heart Journal杂志发表(图15)。
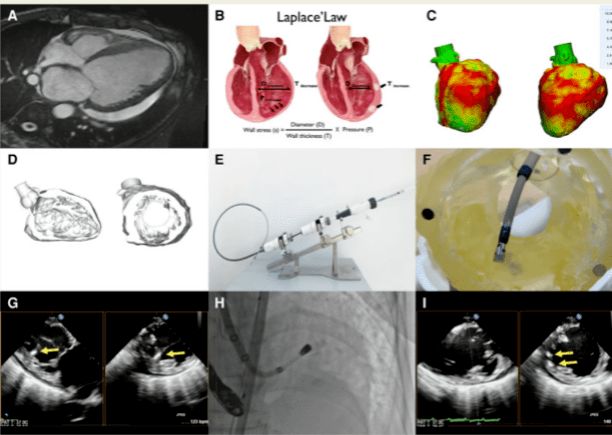
图15. 3D打印指导经导管心内膜下藻酸盐水凝胶治疗心力衰竭(Eur Heart J. 2022 Nov 24:ehac671.)
专家简介
杨剑
空军军医大学西京医院
西京医院心血管外科一病区主任,博士生导师。美国心脏协会专家会员(FAHA), 美国心脏病学会专家会员(FACC)。获聘陕西省中青年科技创新领军人才,陕西省科技创新团队带头人,为陕西省杰出青年科学基金项目获得者,获评第四届“国之名医”。研究领域包括心血管3D打印、新器械研发、应用转化及临床研究等,主编《心血管3D打印技术》等5部专著,在Eur Heart J,JACC等发表SCI论文100余篇。承担国家重点研发计划、国家自然科学基金等10余项课题,经费1000余万元。荣获国家科技进步二等奖、中华医学科技一等奖等多项奖励,授权国家专利30余项。
刘洋
空军军医大学西京医院
心血管外科博士,副主任医师,副教授,硕士研究生导师。微创结构性心脏病组组长,ECMO组组长。美国马里兰大学医学院博士后。国家心血管病专家委员会微创心血管外科专业委员会委员。专注心血管疾病微创治疗。先后开展微创介入瓣膜病修复及置换术,瓣膜置换术后瓣周漏介入封堵术,冠状动脉漏介入封堵术等多项心血管疾病微创治疗新技术。在国内外发表研究论著70余篇,其中SCI论著28篇;主持军队重大专项子课题1项,国家自然科学基金1项,军队及省部级课题各3项;参加“863”重点课题,“十二五”、“十三五”国家重大科技专项等课题13项。获国家专利11项;主编专著1部,副主编专著3部,参编专著8部。获得省级科技进步一等奖1项,并先后获得美国ASAIO青年医师奖,欧洲Euro-ELSO青年研究者奖,中国医师协会心血管外科分会杏林奖,树兰卓越工程青年医师资助计划,中华医学会胸心血管外科分会Lillehei 奖学金及厄尔巴肯奖学金。现任中国医师协会心血管外科分会结构性心脏病专委会委员,中国研究型医院学会血管外科专委会青年委员,陕西省药理学会心血管药理学专业委员会常委,陕西省生物医学工程学会体外循环专业委员会委员,中国医疗保健国际交流促进会心脏重症分会陕西省工作委员会委员。
李兰兰
空军军医大学西京医院
心血管外科研究实习员,生物医学工程专业,工程硕士。TAVR团队核心成员,亚太结构青年俱乐部成员。研究方向主要包括为结构性心脏病介入治疗的影像诊断、心血管生物力学仿真及3D打印,尤其擅长心脏瓣膜疾病、瓣周漏、主动脉弓缩窄等结构性心脏病介入治疗的术前CTA影像学评估。主持西京医院学科助推项目1项,在SCI及中文核心期刊发表论文10余篇,参编论著5部。


