
作者简介
心血管内科主任医师,现为北京大学第三医院药物临床试验机构主任。2018年被国家食品药品监管总局聘为心血管系统及肾病临床专家咨询委员会委员,参加国家食品药品监管总局 ICH E6、E8、E14 和E17工作组。从事新药临床研究20余年,作为主要研究者完成Ⅰ期新药研究40余项,重点关注创新药早期临床研究及心脏安全性评估。作为主要研究者及主要参与者完成心血管药物临床试验Ⅱ期-Ⅳ期30余项。主要兼职:中国药理学会药物临床试验专业委员会副主任委员及北京肿瘤学会临床研究专委会主任委员。
心血管内科副主任医师。2009年于北京大学获医学博士学位,同年进入北医三院心内科工作,2017—2018年在美国密歇根大学心脏中心做访问学者。目前主要从事冠心病介入治疗及机制研究,心脏核医学,高血压,心肌病,心力衰竭,心律失常研究。目前发表SCI论文11篇,中文论文11篇,参与多篇心内科论著的编译。

2020级科学型博士,2020年毕业于天津医科大学,同年录取为北医三院心脏内科科学型博士。目前主要从事冠心病发病机制与代谢相关基础研究,目前发表SCI论文4篇,其中第一作者2篇,中文论文1篇。

2018级专业型博士,2015年毕业于郑州大学,同年推荐免试为北医三院心脏内科专业型硕士,2018年转博。目前主要从事冠心病发病机制与代谢相关研究,目前发表SCI论文1篇,中文论文3篇。
人体内存在着数万亿的微生物,统称为共生微生物群。随着DNA测序技术和生物信息学的进步,我们对微生物群的多样性的认识在过去20年里迅速增长。估算人体内的细菌大致与人体细胞一样多,其中绝大多数居住在下消化道,估计有1014个。尽管人们对于肠道菌群的认知取得了一些进展,但人们对特定的共生微生物与它们的哺乳动物宿主相互作用的分子机制知之甚少。越来越多的研究表明,共生微生物不仅仅是被动的居民,而且它们在局部和系统地调节重要的宿主生理系统中起着重要作用。
微生物可通过细胞因子信号调节宿主免疫系统。I型干扰素是一类结构相似的细胞因子,主要由干扰素-a (IFN-a)和干扰素-b (IFN-b)两种不同的蛋白组成,所有这些蛋白都通过常见的I型干扰素受体(IFNAR)发挥作用。IFN-I的表达可受到转录水平上的调控,并可在所有有核细胞中被诱导高表达,以响应模式识别受体(PRRs)对病原体的感知。最近研究表明IFN-I不仅作用于感染过程中,其低水平的结构性表达,在维持体内平衡时具有重要的作用。事实上,IFN-Is具有调节几乎所有免疫效应细胞的发育或功能的能力,有助于抗炎症和抗肿瘤反应。但IFN-Is在没有感染的情况下被诱导和调控的机制仍有待阐明。由于IFN-I对机体健康的重要性,了解IFN-I如何在健康个体中被调控并可能被破坏导致疾病的机制是至关重要。
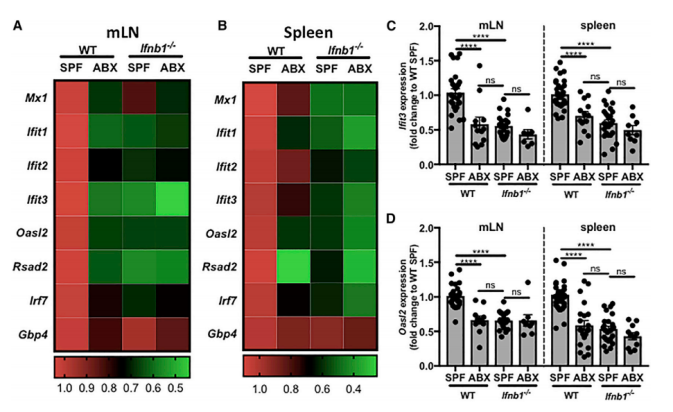
FIG 1:微生物群的减少减少了局部和全身的ISG表达。1A、1B:对SPF级以及ABX(抗生素鸡尾酒法,氨苄西林+新霉素+甲硝唑持续灌胃7天,模拟GF无菌鼠)干预的野生型小鼠和IFN-b1敲除小鼠的肠系膜淋巴结(mLN)和脾脏,分别进行基因探针,发现在ABX干预的野生型小鼠和IFN-b1敲除小鼠中,干扰素刺激基因(ISG)表达均显著下降。1C、1D:Ifit3和Oasl2基因结果统计如图。
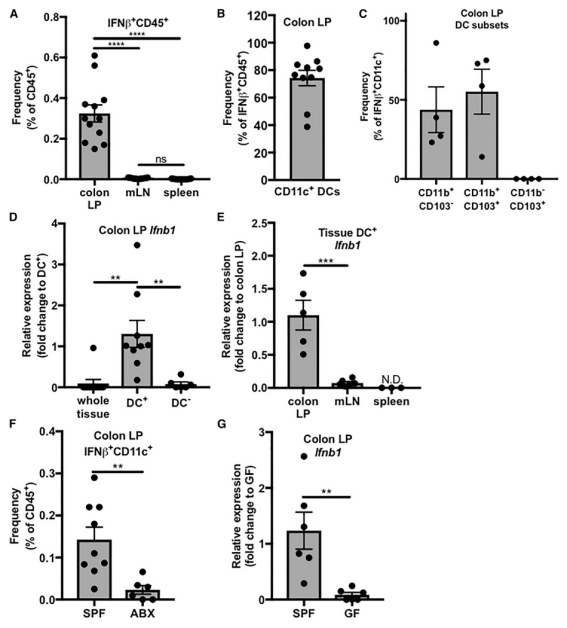
FIG 2:共生菌群通过树突状细胞调节结肠LP中IFN-b的表达。2A:通过流式细胞分析,发现在结肠固有层(LP)、mLN、脾脏中,结肠LP存在大量表达IFN-b的白细胞(IFN-b+/CD45+)。2B:将这些包细胞分选出来后流式细胞进一步发现,70%以上为树突状细胞(CD11c+/IFN-b+/CD45+)。2C:进一步分选发现,这些树突状细胞主要为CD11b+的树突状细胞2型亚群。这些发现表明,在非感染状态下,IFN-b主要来自于结肠固有层的树突状细胞2型亚群。2F、2G:但是当研究人员利用ABX干预或直接使用无菌鼠时,结肠固有层的CD11c+/IFN-b+/CD45+显著减少,IFN-b1分泌下降。
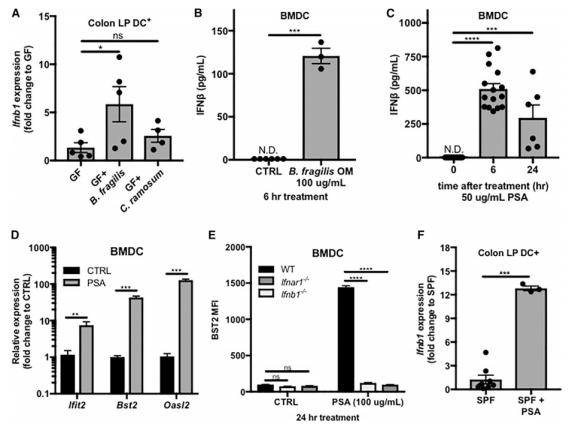
FIG 3:脆弱拟杆菌荚膜多糖在体内和体外诱导IFN-b。3A:用脆弱拟杆菌(B.fragilis)和梭状芽胞杆菌(C.ramosum,无荚膜)分别诱导无菌鼠,发现只有脆弱拟杆菌可以诱导无菌鼠结肠固有层树突状细胞高表达IFN-b1。3B:分离脆弱拟杆菌外膜,以100ug/ml浓度干预骨髓源树突状细胞(BMDC),发现可显著刺激IFN-b1的表达。3C:脆弱拟杆菌外膜整体不呈现时间依赖性,以50ug/ml的浓度下,干预BMDC 6h即可达到较高IFN-b1表达。3D、3E、3F:继续分离外膜中的荚膜多糖(PSA),利用PSA干预BMDC,可显著提高ISG的表达,以及结肠固有层树突状细胞IFN-b1的分泌。
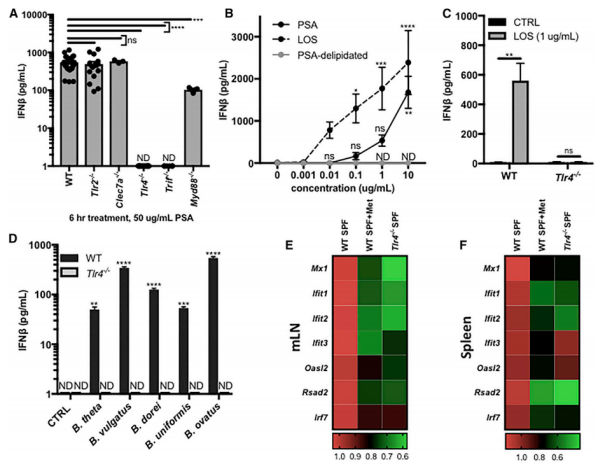
FIG 4:拟杆菌外膜糖脂信号通过TLR4诱导IFN-b表达。4A:先前研究证实,PSA通过TLR2/1异二聚体和dectin-1在DCs上发挥作用。但TLR2/1敲除及dectin-1(Clec7a)敲除小鼠在介导IFN-b1分泌中并无作用,反而TLR4及Trif敲除小鼠表现出显著的IFN-b1表达抑制。4B:脆弱拟杆菌外膜中缺乏脂多糖,取而代之的是脂寡糖(LOS),为PSA的组成部分。利用利用PSA及LOS干预BMDC,发现相较于PSA,LOS更能刺激IFN-b1的表达。4C:但在TLR4敲除的小鼠中,LOS对于IFN-b1的诱导作用收到了阻滞。4D:除脆弱拟杆菌外,其余的拟杆菌属均可发挥诱导IFN-b1高表达的作用,但该作用均会因TLR4受体的敲除而阻滞。4E、4F:而经过甲硝唑灌胃的小鼠,或TLR4敲除的小鼠的肠系膜淋巴结或脾脏中,均可以观察到ISG的表达抑制。
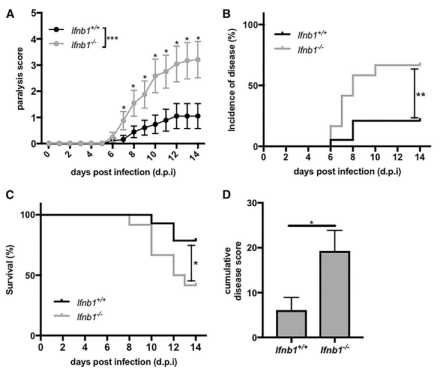
FIG 5:IFN-b对于保护小鼠抵抗VSV感染是必需的。将水泡性口炎病毒(VSV)分别感染野生型与IFN-b1基因敲除小鼠,野生型老鼠无论是在麻痹评分(5A)、疾病发生率(5B)、感染生存率(5C)以及累计疾病得分中(5D),均表现出更好的抵抗性与耐受性。
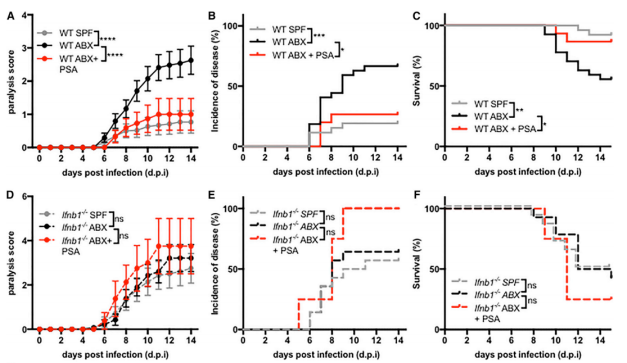
FIG 6:微生物诱导的IFN-b增强了小鼠对VSV感染的耐性。6A、6B、6C:将VSV分别感染野生型SPF鼠、野生型ABX鼠以及用PSA干预了的野生型ABX鼠,从三组麻痹评分、疾病发生率,感染生存率可知,野生型ABX鼠较野生型SPF鼠和PSA干预的野生型ABX鼠对VSV的耐性更差。6D、6E、6F:后又将VSV分别感染IFN-b1基因敲除SPF鼠、IFN-b1基因敲除ABX鼠以及用PSA干预了的IFN-b1基因敲除ABX鼠,从三组麻痹评分、疾病发生率,感染生存率可知,三组无显著差异,IFN-b1在VSV的生物耐性中发挥重要作用。

FIG 7:B. fragilis PSA通过TLR4信号通路诱导IFN-b表达从而缓解BMDCs的病毒感染。7A、7C:利用绿色荧光标记的VSV病毒示踪BMDC感染情况,结果提示,随着PSA浓度的提升,BMDC感染数量显著减少,且已感染VSV的BMDC细胞生存率显著上升。7E:但当敲除IFN-b1或TLR4时,上述对于VSV病毒的抵抗作用被阻滞。7B、7D、7F:之后探索是否在其他病毒感染中也能有相同的抵抗作用,于是利用绿色荧光标记的鼠适应甲型流感病毒PR8株,结果同上。
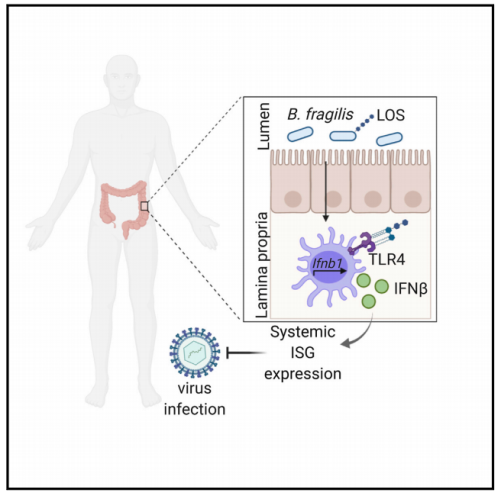
在本研究中,我们发现共生菌群通过结肠固有层(LP)树突状细胞(DCs)诱导IFN-b,局部和系统地调控IFN-I反应,增强对病毒感染的抵抗力。此外,我们发现了一种特定的共生微生物诱导IFN-b的分子机制:拟杆菌门的人类肠道共生微生物的外膜相关糖脂可诱导表达IFN-b。同时,以脆弱拟杆菌为例,我们确定启动IFN-b表达的信号通路是toll样受体4 (TLR4)-TRIF通路。
