作者简介

北京大学第三医院心内科血管医学研究所研究员, 博士研究生导师。中国病理生理学会副秘书长,中国病理生理学会受体信号转导专业委员会副主任委员,青年委员会主任委员,中国病理生理学会血管医学专业委员会秘书长,北京市药理学会心脑血管专业委员会副主任委员。Molecular Pharmacology,Cardiology Plus等国内外杂志编委。主持国家各级课题18项,包括:国家自然科学基金血管重大研究计划集成项目首席科学家、国家自然科学基金重大研究计划、自然科学基金重点国际合作项目、面上项目共8项、国家“973”项目、“重大新药创制”科技重大专项目子课题等。在Trends Pharmacol Sci., Cell research, Eur Heart J, The FASEB Journal,JBC,Br J Pharmacol.等杂志发表SCI论文100余篇。获国家发明专利授权6项,省部级科技进步一等奖3项。主要研究方向为心血管受体与心血管疾病。

北京大学第三医院心内科医师,医学博士,毕业于北京协和医学院阜外医院,师从我国著名心血管代谢病学专家唐熠达教授,主要研究领域为心血管疾病临床辅助决策工具开发及应用、心血管疾病与代谢性疾病临床与机制研究。作为主要参与者参与国家科技支撑计划、公益性行业科研专项等课题的设计及实施。目前已发表SCI论著及核心期刊中文论著近20篇,获得授权专利1项,目前为American College of Cardiology Fellow-in-Training学员,研究成果在AHA、ACC亚太会、东北心血管病会议等学术会议中进行展示,发明的心肌梗死WAMI评分有极大的临床应用价值已在临床实践中进行推广。

直博生在读,2019年本科毕业于南方医科大学临床医学专业,同年进入北京大学第三医院心内科攻读博士学位。

住院医师,目前在北京大学第三医院进行住院医师规范化培训,目前主要从事冠心病与脂质相关临床研究工作,目前发表文章2篇。
研究亮点:
PKA RIα响应cAMP动力学而发生液-液相分离
RIα凝析物能动态隔绝cAMP并保持高PKA活性
RIα相分离是有效的cAMP区室所必需的
PKA癌蛋白干扰RIα小体,导致异常信号和生长
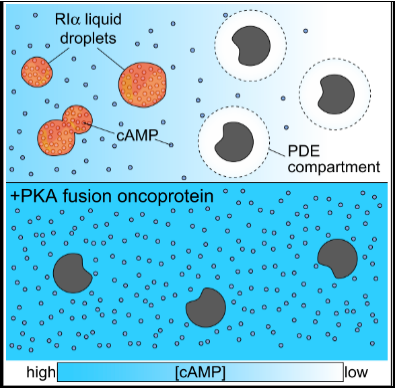
cAMP/PKA信号通路在生物系统中普遍存在,cAMP(3’,5’-环磷酸腺苷)能够响应数百个GPCR的激活产生多样化信号,产生不同的细胞反应。已有研究表明cAMP信号的特异性可以通过cAMP的区室来实现,而区室调控的机制对各种生物系统具有重要的生理意义,例如心血管系统、癌症的发生发展等。
2020年9月生命科学顶级期刊《Cell》的一项研究发现了调控cAMP区室的新机制,即蛋白激酶A的I型调节亚基(PKA RIα)的相分离可调控cAMP区室,这也是首次从相分离的角度认识cAMP区室。
那么什么是cAMP区室呢?
cAMP区室(cAMP compartmentation)大约在35年前被提出,是指不同细胞区域之间的cAMP浓度是不同的,可以防止不同的信号通路之间的干扰,由此用来解释cAMP信号的特异性。
事实上,cAMP梯度和cAMP微区现象已经在实验中被证明了,并且磷酸二酯酶(PDE)被认为是限制局部cAMP扩散的主要屏障。但多项计算研究证明PDE不能单独发挥形成cAMP梯度的作用,因为PDE的分解活性无法满足cAMP的快速扩散。值得注意的是,最近的研究报道了较低的胞质cAMP扩散速率,这比最初的估计更有利于cAMP区室。然而,这其中具体的cAMP限制机制有待阐明。
目前公认,cAMP信号主要由cAMP依赖性蛋白激酶A(PKA)转导。PKA是一种四聚体全酶,由一个调节亚基二聚体和一对催化亚基组成。cAMP与PKA调节亚基的结合可激活PKA催化亚基的活性,从而磷酸化细胞中的多种分子。
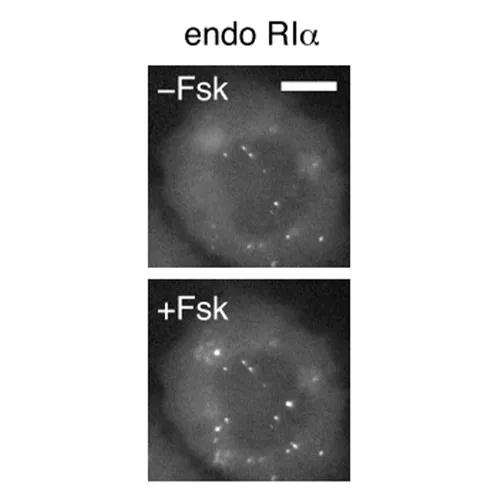
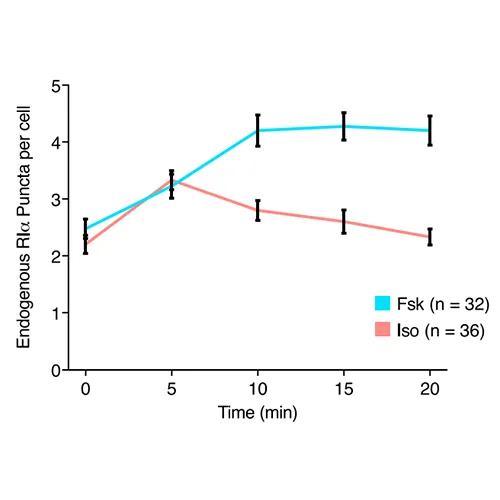
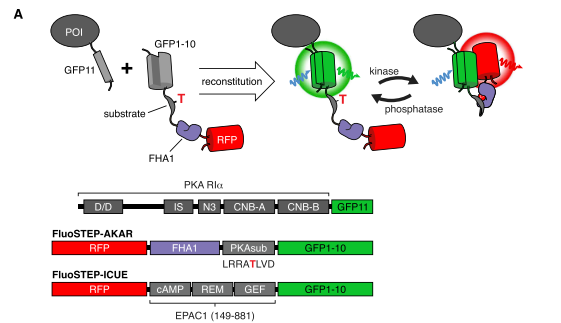
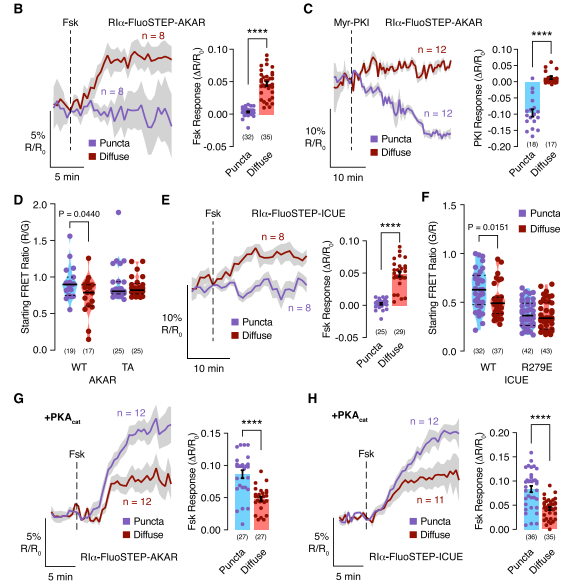
该研究首先发现,PKA的I型调节亚基(RIα)在内源性水平上经历液-液相分离(liquid-liquid phase separation,LLPS)。LLPS是指生物大分子(例如蛋白质和核酸)可以通过液-液相分离(LLPS)凝聚成类似液体的无膜凝析物,是近几年来国际生命科学领域的一个新兴热点。该研究表明,RIα在体外和体内都能发生液-液相分离。

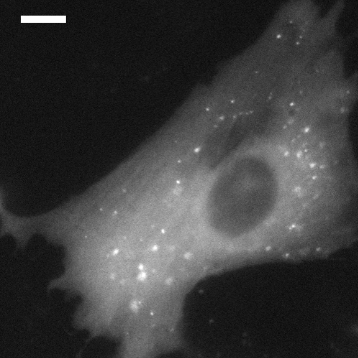
B(乳大鼠心肌细胞)