导管消融终止持续性心房颤动的预测因素
2015-08-11 15:36
导管射频消融是治疗持续性房颤的有效方法[1,2]。房颤在射频消融中终止是持续性房颤导管消融的理想手术终点,可以逆转心房的电重构,并预示着患者具有良好的长期预后[3.4]。但并不是每例患者都能实现通过消融终止房颤,未终止的患者需要进一步电/药物转律治疗。而一味追求通过消融来终止房颤,又会是消融时间延长,增加并发症的发生率,同时可能导致消融过度,损伤心肌遗留瘢痕。因此,通过相关指标预测持续性房颤在消融过程中终止的方式,可以指导优化选择适合导管消融治疗的持续性房颤患者。本文主要就持续性房颤导管射频消融术中房颤终止的预测因素进行综述。
1 导管消融终止房颤对长期预后的影响及机制
持续性房颤心房重构程度严重,研究表明,在消融过程中仅行环肺静脉电隔离,房颤终止率为1.5—3%[5],线性消融后房颤终止发生率可达16%[6],联合碎裂电位消融后房颤终止率可达30%以上[7]。
目前持续性房颤导管射频消融术中房颤终止对预测成功率的作用存在一定的争议,少数中心报道在持续性房颤导管射频消融术中,房颤是否能通过消融终止与预后并无明显关联[8],也有的中心发现房颤终止仅与消融术后复发的心律失常的类型相关[9]。但多数研究表明,与导管消融未终止的患者相比,通过导管消融终止房颤的患者术后复发率更低 [9-13],并且房颤持续时间越短,房颤终止所带来的获益越明显[14]。Heist等[15]对对首次行导管消融的持续性房颤患者随访大于1000天后,发现房颤终止组患者的未复发率(48%)明显高于房颤未终止组(58%),并且房颤终止组患者复发类型中房颤的比例(43%)低于房颤未终止组(46%),且消融终止房颤是持续性房颤导管消融术后临床成功的独立预测因素。
房颤终止提示患者的心房重构程度更小,是持续性房颤心房状态相对良好的标志 [5]。同时,房颤在消融中终止意味着心房基质发生质的改良,终止了房颤的发生和维持,可明显提高术后窦性心律维持率,是射频消融中理想的手术终点[5,9,13]。并且消融终止房颤可以更大程度的逆转心房重构,有学者比较了持续性房颤导管消融后3个月时房颤终止组和房颤未终止组患者左心房大小的变化,发现房颤终止组患者的左房内径和左房容积较术前减小的程度明显大于房颤未终止组的患者[3]。
2 房颤终止的预测因素
2.1 房颤持续时间
持续性房颤在消融过程中,房颤终止与否是心房重构程度的一个表现。而房颤的病理性改变会随房颤持续时间的延长而加重 [6]。因此房颤持续时间越长,房颤通过消融终止的难度也就越大。有中心统计了90例首次行导管消融治疗的持续性房颤患者的房颤持续时间,通过消融终止房颤的患者,平均房颤持续时间为22±24个月,显著短于消融术式完成后房颤未终止的患者(60±44个月),并且得出房颤持续时间是房颤术中终止的独立预测因素[16]。
Komatsu等[14]入选了132例持续性房颤患者,根据房颤的持续时间将患者分为小于3年组和大于3年组,对患者进行了肺静脉电隔离联合碎裂电位消融策略。房颤持续时间小于3年组的患者房颤终止率(57%)明显高于持续时间大于3年组(21%)。并且对于持续时间大于3年的长程持续性房颤患者,在消融过程中过度追求房颤终止可能会造成不必要的消融,并不能提高术后的成功率。长期持续的房颤导致心房重构不断进展,促进房颤本身的维持,即使通过努力最终实现房颤的终止,其潜在的心房重构或因消融过度而新形成的手术瘢痕可能会为房速的形成提供机会。因此,对于病程过长(大于3年)的持续性房颤患者,在选择射频消融治疗时应适可而止,不应过度追求通过消融终止房颤。
2.2 左房大小
左房重构与房颤的发生发展具有明显关系,而左房增大是左房重构的结构表现,持续性房颤患者在消融中难以终止表明左房重构严重,心律失常基质严重[6]。随着左房的扩大,心房细胞亚结构和胞外基质病理性改变也逐渐进展,导致心肌纤维化严重,降低心房内传导速度,促进折返的形成,使房颤不易终止[17,181]。
目前关于评估左房扩大的指标主要是左房前后径(left atrial diameter, LAD),LAD与持续性房颤的消融终点相关[16]。有学者在比较递进式消融房颤终止组与未终止组的LAD后发现,前者的LAD明显小于后者(44±7 vs. 47±8mm),并且多因素回归分析得出LAD是房颤终止的独立预测因子(OR = 0.92, P = 0.002)[15]。但是由于心房是近似椭圆球形,LAD并不能完全代表左房空间大小,尤其是在左房扩大时,LAD不能代表左房上下及左右方向的扩大,因此左房容积在预测左房终止方面可能会更加精确,但还需要临床试验进行进一步验证。
2.3 房颤周长(atrial fibrillation cycle length)AFCL
2.3.1 心腔内测量AFCL
在持续性房颤射频消融术中,AFCL在预测能否房颤终止方面具有十分重要的意义[19]。常用的获得AFCL的方法为在左心耳出测量10个或30个颤动周期后取平均值[2,5]。消融前于左心耳处测量AFCL,AFCL越长,房颤在术中终止的可能性越大[19]。Rostock等[5]发现AFCL每延长10ms,房颤终止的可能性较前增加72%。
Haissaguerre等[2]在行持续性房颤消融治疗的同时不断测量AFCL的变化,发现导管消融房颤未终止组患者AFCL基线水平是(130±14)ms,明显短于导管消融终止房颤组患者AFCL(156±23)ms,消融后房颤终止组患者AFCL延长值显著高于未终止组患者(延长值35±9 vs. 27±12ms)。O’Neill等[20]在左心耳测量导管消融房颤终止组和房颤未终止组的AFCL,同样发现终止组AFCL长于房颤未终止组,AFCL是预测导管消融房颤终止的独立预测因素,其根据AFCL将患者分组,AFCL越高的分组房颤终止率越高(图1)。
动物实验证明,慢性房颤模型心内膜细胞的有效不应期较急性房颤模型显著缩短,且AFCL较也更短,AFCL缩短是心房肌不应期缩短及房颤触发电活动增多的表现。AFCL越长,表明心房电重构越轻,故对于AFCL较短的持续性房颤患者,房颤在术中终止的可能性较小,反之AFCL越长,房颤终止可能性越大[15,21]。通过术中测量AFCL,术者可以对患者的心房电重构程度做出有效评估,为消融策略的制定提供参考。
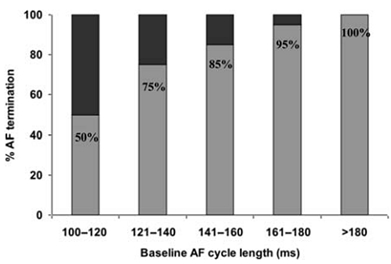
图1. 不同基线AFCL组的持续性房颤患者在射频消融过程中房颤终止的比例,灰色条代表房颤终止,黑色条代表房颤未终止而需要转律治疗。可见AFCL越高,房颤终止率越高。(引自O’Neill et al, Eur Heart J 2009;30:1108)
2.3.2 体表心电图AFCL
虽然于左心耳测得的AFCL可以预测房颤的消融终点,但仅能术中对消融提供指导,不能为患者术前的筛选提供帮助。Mastsuo等[16]研究发现体表心电图可以用来评估AFCL,并可预测持续性房颤的消融终点。其对持续性房颤患者射频消融术前测量V1导联上10个明显的颤动波(最低电压>0.01mV,见图2)间期,并用平均值作为体表心电图AFCL,发现体表心电图AFCL与术中在左心耳测得的AFCL具有很强的相关性,且多因素分析后显示体表心电图AFCL是房颤终止的独立预测因子,对于体表心电图AFCL>142ms的患者,其预测术中房颤终止的阳性预测值是98.1%,阴性预测值是36.1%。
通过体表心电图V1导联进行的AFCL时频分析在预测房颤的转归、评估心房结构重构的程度上所起的作用越重要[22,23]。术前进行体表心电图AFCL的测量可以为患者进行电学方面的评估,为患者的治疗做出指导。但是此方法存在一定的缺陷,若心房颤动波较小(<0.01mV)则难以实现AFCL的测量,故并不适用于所有持续性房颤患者。
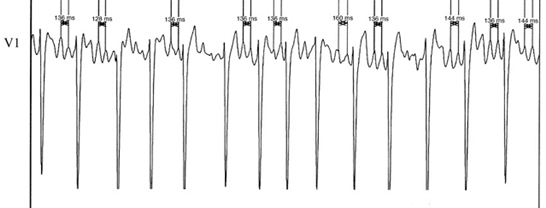
图2. 体表心电图AFCL,从V1导联测量10个未融合在QRS波群及ST段里的明显颤动波。(Mastsuo et al. J Am Coll Cardiol, 2009;54:789)
2.4 左心耳收缩速度
研究表明,心房结构及组织的重构同时会发生在左心耳[26]。通过经食道超声心动图脉冲多普勒测得的左心耳收缩速度,可以反映左心房整体的收缩功能,左心耳收缩力的减小引起左心耳收缩速度减慢,因此,左心耳收缩速度的减慢是左心房功能减退表现[25]。
Kumagai等[3]对持续性房颤患者导管射频消融术前应用经食道超声心动图测量房颤时左心耳收缩速度,发现房颤终止组的左心耳收缩速度明显快于房颤未终止组(0.42±0.23 vs. 0.24±0.11m/s, P<0.001),并且左心耳收缩速度是房颤终止的预测因子,其预测房颤终止的界值是0.27m/s(敏感度71.4%,特异度63%)。
3 结语
持续性房颤在导管射频消融治疗过程中,导管消融终止房颤和转复窦律是理想的消融终点。各类预测方法可以为持续性房颤在导管消融术前进行评估及术中治疗提供参考依据。针对目前存在的针对房颤终止可能性的多种预测方法,采取多种方法联合应用,可以更加准确的评估患者状态,如患者具有更长的AFCL、更短的房颤持续时间及更小的左房尺寸,则其导管消融终止房颤的可能性更大,此类患者更适合行导管消融治疗。有学者将房颤持续时间与体表心电图AFCL结合,如果持续性房颤患者的体表心电图AFCL大于142 ms并且其房颤持续时间小于21个月,那术前预测房颤通过射频消融终止的特异性可达到100%[16]。
持续性房颤的机制研究和治疗是心律失常领域的热点,随着研究的深入和技术的更新,导管射频消融在治疗持续性房颤方面已经取得了较为满意的效果。但是由于持续性房颤的机制复杂,患者个体差异大,导管射频消融术对患者的治疗效果也参差不齐。通过有效的评估,多方法联合预测其术中房颤终止方式(即消融终点)的可能性,权衡利弊,可以优化筛选适合导管消融的患者,选择合适的治疗方案,防止过度消融,减少并发症的发生率,达到良好的治疗效果。
参考文献
1. Calkins H, Brugada J, Packer DL, et al. HRS/EHRA/ECAS Expert consensus statementon catheter surgical ablation of atrial fibrillation: Recommendations for personnel, policy, procedures and follow-up. A Report of the Heart Rhythm Society (HRS) task force on catheter and surgical ablation of atrial fibrillation. Heart Rhythm. 2007; 4: 816-861.
2. Haissaguerre M, Sanders P, Hocini M, et al. Catheter ablation of long-lasting persistent atrial fibrillation: critical structures for termination. Cardiovasc Electrophysiol. 2005; 16: 1125-1137.
3. Kumagai K, Sakamoto T, Nakamura K, et al. Pre-procedural prediction of termination of persistent atrial fibrillation by catheter ablation as an indicator of reverse remodeling of the left atrium. Circulation journal: official journal of the Japanese Circulation Society, 2012, 77(6): 1416-1423.
4. 张劲林, 苏晞, 唐成, 等. 以终止持续性心房颤动为手术终点的递进式消融 200 例总结. 中国心脏起搏与心电生理杂志, 2012, 26(3): 221-224.
5. Rostock T, Salukhe TV, Steven D, et al. Long-term single and multiple procedure outcome and predictors of success after catheter ablation for persistent atrial fibrillation. Heart Rhythm. 2011;8:1391-1397.
6. Oral H, Pappone C, Chugh A, et al. Circumferential pulmonary-vein ablation for chronic atrial fibrillation. N Engl J Med. 2006;354: 934-941.
7. Schmitt C, Estner H, Hecher B, et al. Radiofrequency ablation of complex fractionated atrial electrograms (CFAE): Preferential sites of acute termination and regularization in paroxysmal and persistent atrial fibrillation. J Cardiovasc Electrophysiol. 2007;18:1039-1046.
8. Di Biase L, Santangeli P, Mohanty P, et al. Dose termination of atrial fibrillation during ablation of long standing persistent atrial fibrillation predict the outcome of at follow-up? Results from a prospective randomized study. J Am Coll Cardiol. 2013, 61(10):E355
9. Elayi CS, Di Biase L, Barrett C, et al. Atrial fibrillation termination as a procedural endpoint during ablation in long-standing persistent atrial fibrillation. Heart Rhythm. 2010;7:1216-1223.
10. Estner HL, Hessling G, Ndrepepa G, et al. Acute effects and long-term outcome of pulmonary vein isolation in combination with electrogram-guided substrate ablation for persistent atrial fibrillation. Am J Cardiol. 2008;101:332–337.
11. Oral H, Chugh A, Good E, et al. Randomized evaluation of right atrial ablation after left atrial ablation of complex fractionated atrial electrograms for long-lasting persistent atrial fibrillation. Circ Arrhythm Electrophysiol. 2008;1:6–13.
12. Yoshida K, Chugh A, Good E, et al. A critical decrease in dominant frequency and clinical outcome after catheter ablation of persistent atrial fibrillation. Heart Rhythm. 2010;7:295–302
13. Fiala M, Chovancík J, Nevralova R, et al. Termination of long-lasting persistent versus shortlasting persistent and paroxysmal atrial fibrillation by ablation. Pacing Clin Electrophysiol. 2008;31:985–997.
14. Komatsu Y, Taniguchi H, Miyazake S, et al. Impact of atrial fibrillation termination on clinical outcome after ablation in relation to the duration of persistent atrial fibrillation. PACE. 2012;35:1436–1443.
15. Heist E K, Chalhoub F, Barrett C, et al. Predictors of atrial fibrillation termination and clinical success of catheter ablation of persistent atrial fibrillation. Am JCardiol. 2012, 110(4): 545-551.
16. Matsuo S, Lellouche N, Wright M, et al. Clinical predictors of termination and clinical outcome of catheter ablation for persistent atrial fibrillation. J Am Coll Cardiol. 2009;54:788–795.
17. Allessie M, Ausuma J, Schotten U. Electrical, contractile and structural remodeling during atrial fibrillation. Cardiovasc Res 2002;54: 230–246.
18. Burstein B, Nattel S. Atrial fibrosis: mechanisms and clinical relevance in atrial fibrillation. J Am CollCardiol. 2008;51:802–809.
19. O’Neill MD, Jais P, Takahashi Y, et al. The stepwise ablation approach for chronic atrial fibrillation-evidence for a cumulative effect. J Interv Card Electrophysiol. 2006;16:153–167.
20. O'Neill MD, Wright M, Knecht S, et al. Long-term follow-up of persistent atrial fibrillation ablation using termination as a procedural endpoint. Eur Heart J. 2009 May.30:1105–1112.
21. Sih HJ, Zipes DP, Berbari EJ, et al. Differences in organization between acute and chronic atrial fibrillation in dogs. J Am Coll Cardiol. 2000;36:924–31.
22. Holm M, Pehrson S, Ingemansson M, et al. Non-invasive assessment of the atrial cycle length during atrial fibrillation in man: introducing, validating and illustrating a new ECG method. Cardiovasc Res. 1998;38:69–81
23. Holmqvist F, Stridh M, Waktare JE, et al. Atrial fibrillation signal organization predicts sinus rhythm maintenance in patients undergoing cardioversion of atrial fibrillation. Europace. 2006;8:559–65.
24. Antonielli E, Pizzuti A, Palinkas A, et al. Clinical value of left atrial appendage flow for prediction of long-term sinus rhythm maintenance in patients with nonvalvular atrial fibrillation. J Am Coll Cardiol. 2002; 39: 1443–1449.
25. Agmon Y, Khandheria BK, Meissner I, et al. Are left atrial appendage flow velocities adequate surrogates of global left atrial function? A population-based transthoracic and transesophageal echocardiographic study. J Am Soc Echocardiogr. 2002; 15: 433–440.
阅读数: 1429
1 导管消融终止房颤对长期预后的影响及机制
持续性房颤心房重构程度严重,研究表明,在消融过程中仅行环肺静脉电隔离,房颤终止率为1.5—3%[5],线性消融后房颤终止发生率可达16%[6],联合碎裂电位消融后房颤终止率可达30%以上[7]。
目前持续性房颤导管射频消融术中房颤终止对预测成功率的作用存在一定的争议,少数中心报道在持续性房颤导管射频消融术中,房颤是否能通过消融终止与预后并无明显关联[8],也有的中心发现房颤终止仅与消融术后复发的心律失常的类型相关[9]。但多数研究表明,与导管消融未终止的患者相比,通过导管消融终止房颤的患者术后复发率更低 [9-13],并且房颤持续时间越短,房颤终止所带来的获益越明显[14]。Heist等[15]对对首次行导管消融的持续性房颤患者随访大于1000天后,发现房颤终止组患者的未复发率(48%)明显高于房颤未终止组(58%),并且房颤终止组患者复发类型中房颤的比例(43%)低于房颤未终止组(46%),且消融终止房颤是持续性房颤导管消融术后临床成功的独立预测因素。
房颤终止提示患者的心房重构程度更小,是持续性房颤心房状态相对良好的标志 [5]。同时,房颤在消融中终止意味着心房基质发生质的改良,终止了房颤的发生和维持,可明显提高术后窦性心律维持率,是射频消融中理想的手术终点[5,9,13]。并且消融终止房颤可以更大程度的逆转心房重构,有学者比较了持续性房颤导管消融后3个月时房颤终止组和房颤未终止组患者左心房大小的变化,发现房颤终止组患者的左房内径和左房容积较术前减小的程度明显大于房颤未终止组的患者[3]。
2 房颤终止的预测因素
2.1 房颤持续时间
持续性房颤在消融过程中,房颤终止与否是心房重构程度的一个表现。而房颤的病理性改变会随房颤持续时间的延长而加重 [6]。因此房颤持续时间越长,房颤通过消融终止的难度也就越大。有中心统计了90例首次行导管消融治疗的持续性房颤患者的房颤持续时间,通过消融终止房颤的患者,平均房颤持续时间为22±24个月,显著短于消融术式完成后房颤未终止的患者(60±44个月),并且得出房颤持续时间是房颤术中终止的独立预测因素[16]。
Komatsu等[14]入选了132例持续性房颤患者,根据房颤的持续时间将患者分为小于3年组和大于3年组,对患者进行了肺静脉电隔离联合碎裂电位消融策略。房颤持续时间小于3年组的患者房颤终止率(57%)明显高于持续时间大于3年组(21%)。并且对于持续时间大于3年的长程持续性房颤患者,在消融过程中过度追求房颤终止可能会造成不必要的消融,并不能提高术后的成功率。长期持续的房颤导致心房重构不断进展,促进房颤本身的维持,即使通过努力最终实现房颤的终止,其潜在的心房重构或因消融过度而新形成的手术瘢痕可能会为房速的形成提供机会。因此,对于病程过长(大于3年)的持续性房颤患者,在选择射频消融治疗时应适可而止,不应过度追求通过消融终止房颤。
2.2 左房大小
左房重构与房颤的发生发展具有明显关系,而左房增大是左房重构的结构表现,持续性房颤患者在消融中难以终止表明左房重构严重,心律失常基质严重[6]。随着左房的扩大,心房细胞亚结构和胞外基质病理性改变也逐渐进展,导致心肌纤维化严重,降低心房内传导速度,促进折返的形成,使房颤不易终止[17,181]。
目前关于评估左房扩大的指标主要是左房前后径(left atrial diameter, LAD),LAD与持续性房颤的消融终点相关[16]。有学者在比较递进式消融房颤终止组与未终止组的LAD后发现,前者的LAD明显小于后者(44±7 vs. 47±8mm),并且多因素回归分析得出LAD是房颤终止的独立预测因子(OR = 0.92, P = 0.002)[15]。但是由于心房是近似椭圆球形,LAD并不能完全代表左房空间大小,尤其是在左房扩大时,LAD不能代表左房上下及左右方向的扩大,因此左房容积在预测左房终止方面可能会更加精确,但还需要临床试验进行进一步验证。
2.3 房颤周长(atrial fibrillation cycle length)AFCL
2.3.1 心腔内测量AFCL
在持续性房颤射频消融术中,AFCL在预测能否房颤终止方面具有十分重要的意义[19]。常用的获得AFCL的方法为在左心耳出测量10个或30个颤动周期后取平均值[2,5]。消融前于左心耳处测量AFCL,AFCL越长,房颤在术中终止的可能性越大[19]。Rostock等[5]发现AFCL每延长10ms,房颤终止的可能性较前增加72%。
Haissaguerre等[2]在行持续性房颤消融治疗的同时不断测量AFCL的变化,发现导管消融房颤未终止组患者AFCL基线水平是(130±14)ms,明显短于导管消融终止房颤组患者AFCL(156±23)ms,消融后房颤终止组患者AFCL延长值显著高于未终止组患者(延长值35±9 vs. 27±12ms)。O’Neill等[20]在左心耳测量导管消融房颤终止组和房颤未终止组的AFCL,同样发现终止组AFCL长于房颤未终止组,AFCL是预测导管消融房颤终止的独立预测因素,其根据AFCL将患者分组,AFCL越高的分组房颤终止率越高(图1)。
动物实验证明,慢性房颤模型心内膜细胞的有效不应期较急性房颤模型显著缩短,且AFCL较也更短,AFCL缩短是心房肌不应期缩短及房颤触发电活动增多的表现。AFCL越长,表明心房电重构越轻,故对于AFCL较短的持续性房颤患者,房颤在术中终止的可能性较小,反之AFCL越长,房颤终止可能性越大[15,21]。通过术中测量AFCL,术者可以对患者的心房电重构程度做出有效评估,为消融策略的制定提供参考。

图1. 不同基线AFCL组的持续性房颤患者在射频消融过程中房颤终止的比例,灰色条代表房颤终止,黑色条代表房颤未终止而需要转律治疗。可见AFCL越高,房颤终止率越高。(引自O’Neill et al, Eur Heart J 2009;30:1108)
2.3.2 体表心电图AFCL
虽然于左心耳测得的AFCL可以预测房颤的消融终点,但仅能术中对消融提供指导,不能为患者术前的筛选提供帮助。Mastsuo等[16]研究发现体表心电图可以用来评估AFCL,并可预测持续性房颤的消融终点。其对持续性房颤患者射频消融术前测量V1导联上10个明显的颤动波(最低电压>0.01mV,见图2)间期,并用平均值作为体表心电图AFCL,发现体表心电图AFCL与术中在左心耳测得的AFCL具有很强的相关性,且多因素分析后显示体表心电图AFCL是房颤终止的独立预测因子,对于体表心电图AFCL>142ms的患者,其预测术中房颤终止的阳性预测值是98.1%,阴性预测值是36.1%。
通过体表心电图V1导联进行的AFCL时频分析在预测房颤的转归、评估心房结构重构的程度上所起的作用越重要[22,23]。术前进行体表心电图AFCL的测量可以为患者进行电学方面的评估,为患者的治疗做出指导。但是此方法存在一定的缺陷,若心房颤动波较小(<0.01mV)则难以实现AFCL的测量,故并不适用于所有持续性房颤患者。

图2. 体表心电图AFCL,从V1导联测量10个未融合在QRS波群及ST段里的明显颤动波。(Mastsuo et al. J Am Coll Cardiol, 2009;54:789)
2.4 左心耳收缩速度
研究表明,心房结构及组织的重构同时会发生在左心耳[26]。通过经食道超声心动图脉冲多普勒测得的左心耳收缩速度,可以反映左心房整体的收缩功能,左心耳收缩力的减小引起左心耳收缩速度减慢,因此,左心耳收缩速度的减慢是左心房功能减退表现[25]。
Kumagai等[3]对持续性房颤患者导管射频消融术前应用经食道超声心动图测量房颤时左心耳收缩速度,发现房颤终止组的左心耳收缩速度明显快于房颤未终止组(0.42±0.23 vs. 0.24±0.11m/s, P<0.001),并且左心耳收缩速度是房颤终止的预测因子,其预测房颤终止的界值是0.27m/s(敏感度71.4%,特异度63%)。
3 结语
持续性房颤在导管射频消融治疗过程中,导管消融终止房颤和转复窦律是理想的消融终点。各类预测方法可以为持续性房颤在导管消融术前进行评估及术中治疗提供参考依据。针对目前存在的针对房颤终止可能性的多种预测方法,采取多种方法联合应用,可以更加准确的评估患者状态,如患者具有更长的AFCL、更短的房颤持续时间及更小的左房尺寸,则其导管消融终止房颤的可能性更大,此类患者更适合行导管消融治疗。有学者将房颤持续时间与体表心电图AFCL结合,如果持续性房颤患者的体表心电图AFCL大于142 ms并且其房颤持续时间小于21个月,那术前预测房颤通过射频消融终止的特异性可达到100%[16]。
持续性房颤的机制研究和治疗是心律失常领域的热点,随着研究的深入和技术的更新,导管射频消融在治疗持续性房颤方面已经取得了较为满意的效果。但是由于持续性房颤的机制复杂,患者个体差异大,导管射频消融术对患者的治疗效果也参差不齐。通过有效的评估,多方法联合预测其术中房颤终止方式(即消融终点)的可能性,权衡利弊,可以优化筛选适合导管消融的患者,选择合适的治疗方案,防止过度消融,减少并发症的发生率,达到良好的治疗效果。
参考文献
1. Calkins H, Brugada J, Packer DL, et al. HRS/EHRA/ECAS Expert consensus statementon catheter surgical ablation of atrial fibrillation: Recommendations for personnel, policy, procedures and follow-up. A Report of the Heart Rhythm Society (HRS) task force on catheter and surgical ablation of atrial fibrillation. Heart Rhythm. 2007; 4: 816-861.
2. Haissaguerre M, Sanders P, Hocini M, et al. Catheter ablation of long-lasting persistent atrial fibrillation: critical structures for termination. Cardiovasc Electrophysiol. 2005; 16: 1125-1137.
3. Kumagai K, Sakamoto T, Nakamura K, et al. Pre-procedural prediction of termination of persistent atrial fibrillation by catheter ablation as an indicator of reverse remodeling of the left atrium. Circulation journal: official journal of the Japanese Circulation Society, 2012, 77(6): 1416-1423.
4. 张劲林, 苏晞, 唐成, 等. 以终止持续性心房颤动为手术终点的递进式消融 200 例总结. 中国心脏起搏与心电生理杂志, 2012, 26(3): 221-224.
5. Rostock T, Salukhe TV, Steven D, et al. Long-term single and multiple procedure outcome and predictors of success after catheter ablation for persistent atrial fibrillation. Heart Rhythm. 2011;8:1391-1397.
6. Oral H, Pappone C, Chugh A, et al. Circumferential pulmonary-vein ablation for chronic atrial fibrillation. N Engl J Med. 2006;354: 934-941.
7. Schmitt C, Estner H, Hecher B, et al. Radiofrequency ablation of complex fractionated atrial electrograms (CFAE): Preferential sites of acute termination and regularization in paroxysmal and persistent atrial fibrillation. J Cardiovasc Electrophysiol. 2007;18:1039-1046.
8. Di Biase L, Santangeli P, Mohanty P, et al. Dose termination of atrial fibrillation during ablation of long standing persistent atrial fibrillation predict the outcome of at follow-up? Results from a prospective randomized study. J Am Coll Cardiol. 2013, 61(10):E355
9. Elayi CS, Di Biase L, Barrett C, et al. Atrial fibrillation termination as a procedural endpoint during ablation in long-standing persistent atrial fibrillation. Heart Rhythm. 2010;7:1216-1223.
10. Estner HL, Hessling G, Ndrepepa G, et al. Acute effects and long-term outcome of pulmonary vein isolation in combination with electrogram-guided substrate ablation for persistent atrial fibrillation. Am J Cardiol. 2008;101:332–337.
11. Oral H, Chugh A, Good E, et al. Randomized evaluation of right atrial ablation after left atrial ablation of complex fractionated atrial electrograms for long-lasting persistent atrial fibrillation. Circ Arrhythm Electrophysiol. 2008;1:6–13.
12. Yoshida K, Chugh A, Good E, et al. A critical decrease in dominant frequency and clinical outcome after catheter ablation of persistent atrial fibrillation. Heart Rhythm. 2010;7:295–302
13. Fiala M, Chovancík J, Nevralova R, et al. Termination of long-lasting persistent versus shortlasting persistent and paroxysmal atrial fibrillation by ablation. Pacing Clin Electrophysiol. 2008;31:985–997.
14. Komatsu Y, Taniguchi H, Miyazake S, et al. Impact of atrial fibrillation termination on clinical outcome after ablation in relation to the duration of persistent atrial fibrillation. PACE. 2012;35:1436–1443.
15. Heist E K, Chalhoub F, Barrett C, et al. Predictors of atrial fibrillation termination and clinical success of catheter ablation of persistent atrial fibrillation. Am JCardiol. 2012, 110(4): 545-551.
16. Matsuo S, Lellouche N, Wright M, et al. Clinical predictors of termination and clinical outcome of catheter ablation for persistent atrial fibrillation. J Am Coll Cardiol. 2009;54:788–795.
17. Allessie M, Ausuma J, Schotten U. Electrical, contractile and structural remodeling during atrial fibrillation. Cardiovasc Res 2002;54: 230–246.
18. Burstein B, Nattel S. Atrial fibrosis: mechanisms and clinical relevance in atrial fibrillation. J Am CollCardiol. 2008;51:802–809.
19. O’Neill MD, Jais P, Takahashi Y, et al. The stepwise ablation approach for chronic atrial fibrillation-evidence for a cumulative effect. J Interv Card Electrophysiol. 2006;16:153–167.
20. O'Neill MD, Wright M, Knecht S, et al. Long-term follow-up of persistent atrial fibrillation ablation using termination as a procedural endpoint. Eur Heart J. 2009 May.30:1105–1112.
21. Sih HJ, Zipes DP, Berbari EJ, et al. Differences in organization between acute and chronic atrial fibrillation in dogs. J Am Coll Cardiol. 2000;36:924–31.
22. Holm M, Pehrson S, Ingemansson M, et al. Non-invasive assessment of the atrial cycle length during atrial fibrillation in man: introducing, validating and illustrating a new ECG method. Cardiovasc Res. 1998;38:69–81
23. Holmqvist F, Stridh M, Waktare JE, et al. Atrial fibrillation signal organization predicts sinus rhythm maintenance in patients undergoing cardioversion of atrial fibrillation. Europace. 2006;8:559–65.
24. Antonielli E, Pizzuti A, Palinkas A, et al. Clinical value of left atrial appendage flow for prediction of long-term sinus rhythm maintenance in patients with nonvalvular atrial fibrillation. J Am Coll Cardiol. 2002; 39: 1443–1449.
25. Agmon Y, Khandheria BK, Meissner I, et al. Are left atrial appendage flow velocities adequate surrogates of global left atrial function? A population-based transthoracic and transesophageal echocardiographic study. J Am Soc Echocardiogr. 2002; 15: 433–440.