Bachmann氏束在房颤发生发展中的意义
2015-08-11 15:11
Bachmann氏束( Bachmann’s bundle, BB),即房间束,被认为是连接左右心房的一条肌肉束,是心房传导的主要通道。BB结构的破坏与心房间传导阻滞(IAB)发生具有相关关系。目前相关研究发现IAB与多种房性心动过速及左心房电机械紊乱存在着相关性。随着科技的进步,精确的标测技术及成像技术得以应用,增加了我们对BB这一特殊组织结构的认识,以及BB在缓慢及快速性房性心律失常中的作用。本综述概述了目前关于BB的组织结构及电生理特性的认识,以及BB在房颤触发及维持过程中所起的作用。
图1 BB的解剖位置
图2 BB的走行
图3 BB的血供
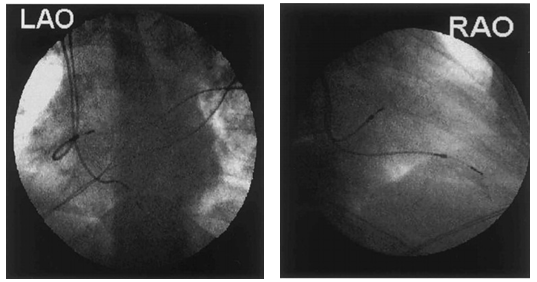
图7 BB区域起搏位置
注:左图为LAO体位的BB区域起搏位置;右图为RAO体位的BB区域起搏位置
图8 窦性、BB区域起搏、RAA起搏的P波宽度比较
阅读数: 4256
1 Bachmann氏束的解剖
James的研究[1]认为前结间束离开窦房结后向左前行走,弓状绕过上腔静脉和右心房前壁,后分为二束纤维,一束继续延入左心房体部和右心耳,成为BB。BB向左延伸穿过房间沟,进入左心耳(如图1、2所示)。目前对BB的组织构成仍存在着一些争议,但相关研究已经逐步否定了BB是由特殊组织构成的假设,认为BB仍为肌肉束,属性同界嵴相似。而BB作为心房间的优势传导目前已经被证实,其优势传导是由于房肌细胞各向异性排列所致。BB的血供主要来源于窦房结动脉,55%的BB受起源右冠状动脉的右窦房结动脉供血;40%的BB受起源回旋支的左窦房结动脉供血,5%收到上述两支血管的供血[2](如图3所示)。
James的研究[1]认为前结间束离开窦房结后向左前行走,弓状绕过上腔静脉和右心房前壁,后分为二束纤维,一束继续延入左心房体部和右心耳,成为BB。BB向左延伸穿过房间沟,进入左心耳(如图1、2所示)。目前对BB的组织构成仍存在着一些争议,但相关研究已经逐步否定了BB是由特殊组织构成的假设,认为BB仍为肌肉束,属性同界嵴相似。而BB作为心房间的优势传导目前已经被证实,其优势传导是由于房肌细胞各向异性排列所致。BB的血供主要来源于窦房结动脉,55%的BB受起源右冠状动脉的右窦房结动脉供血;40%的BB受起源回旋支的左窦房结动脉供血,5%收到上述两支血管的供血[2](如图3所示)。
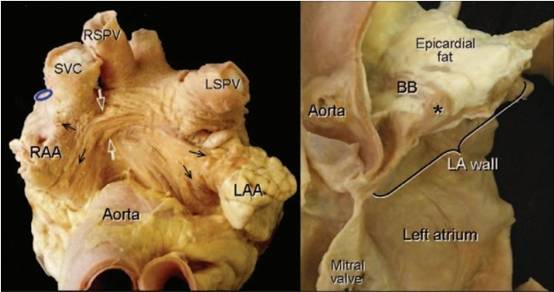
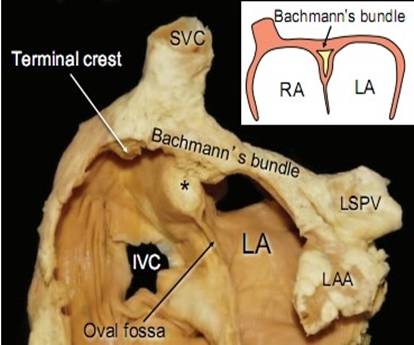
图2 BB的走行
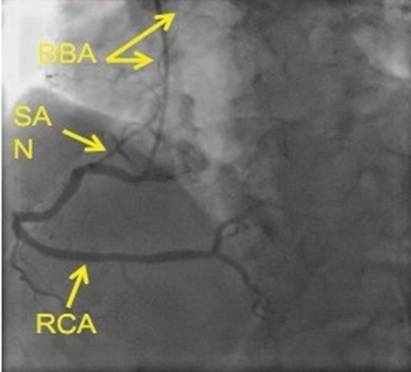
图3 BB的血供
2 BB的电生理学特点
Heriba等[3]对混血犬研究发现,在窦性心律时BB动作电位平均持续时间约345±40ms,而心房、心室肌细胞动作电位持续时间为200-300ms。与心房细细胞相比,BB动作电位图形具有更陡峭的动作电位上升支、更高尖的超射和更短的平台期(如图4)。相似的,Wagner等[4]的离体实验发现犬BB静息电位达-95mv,动作电位峰值最大上升速度(dv/dt)达630V/s,动作电位幅度达130mv,具有显著的超射和平台期。
图4 上为BB动作电位图;下为心房肌细胞动作电位图
Heriba等[3]对混血犬研究发现,在窦性心律时BB动作电位平均持续时间约345±40ms,而心房、心室肌细胞动作电位持续时间为200-300ms。与心房细细胞相比,BB动作电位图形具有更陡峭的动作电位上升支、更高尖的超射和更短的平台期(如图4)。相似的,Wagner等[4]的离体实验发现犬BB静息电位达-95mv,动作电位峰值最大上升速度(dv/dt)达630V/s,动作电位幅度达130mv,具有显著的超射和平台期。
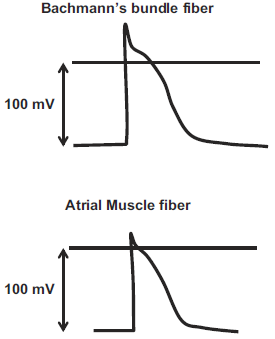
图4 上为BB动作电位图;下为心房肌细胞动作电位图
相关研究表明[5],BB的动作电位与普肯野纤维、心房肌细胞既存在相似之处,又有所区别。BB的动作电位图形具有明显的超射、呈凸形的复极期,而心房肌细胞和普肯野纤维细胞有相对较低的超射(心房肌细胞约30mv而BB约40mv)、呈凹形或直线形复极期。BB的平台期与普肯野纤维的2相平台期相似。与心房肌纤维相比,BB的跨膜动作电位具有更高的静息电位和更快的动作电位上升速度。与普肯野纤维不同的是,BB的动作电位持续时间可被乙酰胆碱大大缩短。有研究通过测试活体犬心脏模型心房传导速度发现,和普肯野纤维一样,BB传导冲动的速度(1.7m/sec)也明显快于周围心肌组织(0.4m/sec)。而且Wagner等[3]研究发现BB内部也有不同的传导速度,表层的传导速度1.3m/s,而深层的传导速度仅有0.9m/s,因此冲动向周围传导可能通过复杂的、相对独立的直线路径传导,而不是横向传导。而且最具特征的是和普肯野纤维一样,BB纤维的兴奋具有超长期。
总之,我们可以认为BB兼具普肯野纤维和心房肌纤维的心电生理学特性。
总之,我们可以认为BB兼具普肯野纤维和心房肌纤维的心电生理学特性。
2 BB阻滞
由于BB是心房间的优势传导,BB的结构破坏可引起心房间传导阻滞(IAB)。Waldo等[6]通过手术破坏犬左右心房的BB束区域,观察心电图(ECG)变化,结果发现P波的形态(包括宽度与极性)发生明显变化,发现BB的部分损伤即可造成部分IAB,完全损伤可造成更进一步的IAB。正常的心房间传导可反映在体表ECG上,P波时限应<110ms,而P波时限>110ms,被认为存在延长的心房间传导(见图5)。部分及完全的IAB均可使P波增宽,部分IAB的P波通常双峰型,因为左、右房间存在非同步的电活动。而完全IAB的P波呈±双向,因为窦放结发放的冲动先需穿过右房到达房室结,最后向上折返,进入左心房(见图6)[7]。目前研究认为心房的纤维化是形成IAB的潜在危险因素。纤维化包括缺血性心脏病及非缺血性心脏病两种原因[8,9],而非缺血性心脏病包括系统性硬化病、扩张型心肌病、肥厚型心肌病[10]、淋巴瘤[11]以及因为心脏瓣膜并引起的左房压力增大。
图5 IAB P波在体表心电图的表现
图6 部分和完全IAB P波变化示意图
组织学研究表明,IAB的病人可发现右心房组织的明显纤维化(包括BB组织),尽管并没有发现独立的BB纤维化。在小样本研究中发现,心房颤动可心房阻滞纤维化同时可合并BB纤维化[12]。而目前已有研究表明,心脏疾病由于心房压力的增加,都可以通过影响BB组织结构使房间传导时间延长[13]。
由于BB是心房间的优势传导,BB的结构破坏可引起心房间传导阻滞(IAB)。Waldo等[6]通过手术破坏犬左右心房的BB束区域,观察心电图(ECG)变化,结果发现P波的形态(包括宽度与极性)发生明显变化,发现BB的部分损伤即可造成部分IAB,完全损伤可造成更进一步的IAB。正常的心房间传导可反映在体表ECG上,P波时限应<110ms,而P波时限>110ms,被认为存在延长的心房间传导(见图5)。部分及完全的IAB均可使P波增宽,部分IAB的P波通常双峰型,因为左、右房间存在非同步的电活动。而完全IAB的P波呈±双向,因为窦放结发放的冲动先需穿过右房到达房室结,最后向上折返,进入左心房(见图6)[7]。目前研究认为心房的纤维化是形成IAB的潜在危险因素。纤维化包括缺血性心脏病及非缺血性心脏病两种原因[8,9],而非缺血性心脏病包括系统性硬化病、扩张型心肌病、肥厚型心肌病[10]、淋巴瘤[11]以及因为心脏瓣膜并引起的左房压力增大。
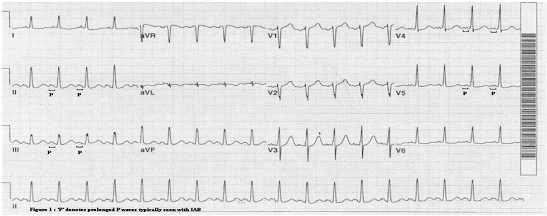
图5 IAB P波在体表心电图的表现
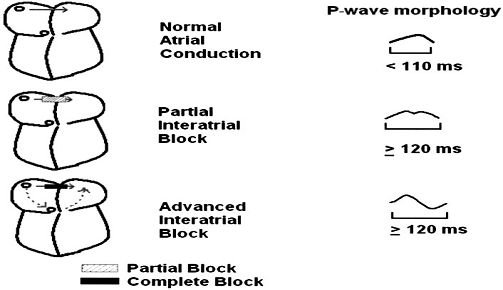
图6 部分和完全IAB P波变化示意图
组织学研究表明,IAB的病人可发现右心房组织的明显纤维化(包括BB组织),尽管并没有发现独立的BB纤维化。在小样本研究中发现,心房颤动可心房阻滞纤维化同时可合并BB纤维化[12]。而目前已有研究表明,心脏疾病由于心房压力的增加,都可以通过影响BB组织结构使房间传导时间延长[13]。
3 BB在AF病理方面的临床意义
一家综合医院的统计分析[14]显示,在AF患者中IAB的发生率为52%,相比较下,无AF患者IAB的发生率仅为18%,该项分析表明IAB与房颤的发展存在着一定的相关性。而一项前瞻性的研究[15]通过对16例存在IAB与22例无IAB的患者(两组患者的年龄、性别、心衰程度、左房大小、随访时间均不存在统计学差异),进行长达30个月的随访对比(30月内未予干预治疗),发现16例存在IAB中的患者中,有15例患者随着时间的进展,发生房性心律失常。其中7例进展为房颤,4例进展为房扑,4例同时存在房颤与房扑。而22例无IAB患者中,只有5例进展为房颤,1例进展为房扑。该研究两组患者同时存在器质性心脏病。最近一项更大型的研究[16]入选了118列患者,其中41例患者存在IAB,通过12个月的随访,有29%的患者进展成为AF。而44例没有IAB的患者中仅有9%进展为AF。其中75%进展为AF患者的心电图均记录到存在着IAB。此外Ariyarajah等[17]也报道了关于一例IAB的病人随时间进展为房扑的病例。Abe等[18]研究记录了122例患者经过26±2个月,从阵发性房颤进展为持续性房颤。在这项研究的初始,有23例患者记录到存在着异常的P波形态,其中10例患者进展为持续性房颤,与之形成对比的是,只有4名正常P波形态的患者进展成为持续性房颤。上述研究显示,IAB可反映BB发生阻滞,并可表现在心电图变化上,且提示着可能促使快速型的房性心律失常发生。
一家综合医院的统计分析[14]显示,在AF患者中IAB的发生率为52%,相比较下,无AF患者IAB的发生率仅为18%,该项分析表明IAB与房颤的发展存在着一定的相关性。而一项前瞻性的研究[15]通过对16例存在IAB与22例无IAB的患者(两组患者的年龄、性别、心衰程度、左房大小、随访时间均不存在统计学差异),进行长达30个月的随访对比(30月内未予干预治疗),发现16例存在IAB中的患者中,有15例患者随着时间的进展,发生房性心律失常。其中7例进展为房颤,4例进展为房扑,4例同时存在房颤与房扑。而22例无IAB患者中,只有5例进展为房颤,1例进展为房扑。该研究两组患者同时存在器质性心脏病。最近一项更大型的研究[16]入选了118列患者,其中41例患者存在IAB,通过12个月的随访,有29%的患者进展成为AF。而44例没有IAB的患者中仅有9%进展为AF。其中75%进展为AF患者的心电图均记录到存在着IAB。此外Ariyarajah等[17]也报道了关于一例IAB的病人随时间进展为房扑的病例。Abe等[18]研究记录了122例患者经过26±2个月,从阵发性房颤进展为持续性房颤。在这项研究的初始,有23例患者记录到存在着异常的P波形态,其中10例患者进展为持续性房颤,与之形成对比的是,只有4名正常P波形态的患者进展成为持续性房颤。上述研究显示,IAB可反映BB发生阻滞,并可表现在心电图变化上,且提示着可能促使快速型的房性心律失常发生。
4 BB在房颤发生和持续中的作用
折返是快速性房性心律失常发生的重要机制[19],但是BB是否在这个过程中发挥作用目前尚未得到确切证明。Ogawa等[20]发现在犬心脏中起源于高位左房的早搏可诱发折返,记录到早搏冲动缓慢传至右心房并且造成左房回波。Allessie等[18,21]也发现冲动传导经过BB时由于存在纵向分离可导致折返发生。因此,BB可能与阵发性室上性心动过速发生有关。此外,在对犬的无菌性心包炎模型进行诱发房颤的过程中进行心外膜和心内膜标测,发现环路长度较短的不稳定折返使得AF的持续发生。大量研究表明不稳定折返环将BB作为其折返路径上的一部分,基于上述研究,可以推测对BB进行损伤或许可以终止持续性AF。研究者们通过在一系列连续性研究[22],观察了在相同模型中观察BB导管消融对房颤的影响。该模型中AF(被定义为持续时间需>2分钟)由快速心房起搏诱发,通过导管消融对BB中部进行横断阻滞后,房颤终止。随后无法通过快速起搏来诱发房颤。2001年Goyal和Spodick等[23]推测BB传导阻滞与快速性房性心律失常有关,他们认为心房间传导阻滞作为左房失功能的标志,可能同时也是房颤的易患因素。有研究通过应用超声心动图技术,对左房功能参数进行比较,并根据心房大小进行匹配,发现心房间传导阻滞者较无组织者左房失功能更严重,并且与经BB传导延迟程度有关,但明确的因果关系目前尚不能得出。
折返是快速性房性心律失常发生的重要机制[19],但是BB是否在这个过程中发挥作用目前尚未得到确切证明。Ogawa等[20]发现在犬心脏中起源于高位左房的早搏可诱发折返,记录到早搏冲动缓慢传至右心房并且造成左房回波。Allessie等[18,21]也发现冲动传导经过BB时由于存在纵向分离可导致折返发生。因此,BB可能与阵发性室上性心动过速发生有关。此外,在对犬的无菌性心包炎模型进行诱发房颤的过程中进行心外膜和心内膜标测,发现环路长度较短的不稳定折返使得AF的持续发生。大量研究表明不稳定折返环将BB作为其折返路径上的一部分,基于上述研究,可以推测对BB进行损伤或许可以终止持续性AF。研究者们通过在一系列连续性研究[22],观察了在相同模型中观察BB导管消融对房颤的影响。该模型中AF(被定义为持续时间需>2分钟)由快速心房起搏诱发,通过导管消融对BB中部进行横断阻滞后,房颤终止。随后无法通过快速起搏来诱发房颤。2001年Goyal和Spodick等[23]推测BB传导阻滞与快速性房性心律失常有关,他们认为心房间传导阻滞作为左房失功能的标志,可能同时也是房颤的易患因素。有研究通过应用超声心动图技术,对左房功能参数进行比较,并根据心房大小进行匹配,发现心房间传导阻滞者较无组织者左房失功能更严重,并且与经BB传导延迟程度有关,但明确的因果关系目前尚不能得出。
5 BB起搏在预防房颤中的作用
大量研究数据已证实BB在快速性房性心律失常的起始及持续具有重要作用,因此人们探讨能否通过BB起搏预防房颤。2000年Yu等[24] 最先对心房不同位点起搏预防房颤的疗效进行对比,该研究对15例阵发性房颤患者的6种不同位点起搏,包括右心耳(RAA)、BB、右后房间隔(RPS)、冠状窦远端(CSd)、同时刺激右心耳+右后房间隔(DSA)、右心耳+冠状窦远端(BiA)的P波宽度进行测量,发现右心耳起搏的P波宽度最长,并按以下顺序依次缩短RAA,Csd,包含间隔部分的起搏如BB、RPS或DSA,最后为BiA起搏,结果表明右房间隔起搏可明显缩短总心房激动时间。相似的,Lewicka-Nowak 等[25]对57名心电图P波增宽、房颤反复发作的病窦患者进行研究,所有病人冠状窦放置一根电极,通过另一根电极放置的位置不同将其分为两组,右心耳+CS组(另一根电极放在右心耳)和BB+CS组(另一根电极放在BB),并应用组织多普勒记录心房壁的电机械延搁(EMD)和心房收缩同步化情况,该研究显示:BB电极替代RAA电极不但不会影响心脏射血功能,而且会使LA提前收缩,改变右-左房收缩顺序,提高LA收缩的同步化。 随后的研究[26] 也发现BB起搏也可以缩短心房激动时间。在缩短P波宽度方面,BB、冠状窦和右后房间隔起搏明显优于右心耳+右后房间隔及右心耳+冠状窦远端起搏,而且BB、右后房间隔或冠状窦起搏联合右心耳额外刺激进行诱发房颤失败,而右心耳、右心耳+右后房间隔或右心耳+冠状窦远端起搏联合右心耳额外刺激可成功诱发房颤。因此,该研究显示,BB、冠状窦和右后房间隔起搏可成功预防房颤发生。Duyschaever等[27] 研究发现BB中部起搏是预防心房折返的最佳位点。
2002年Gozolits等[26]对接受射频消融治疗之后的15例无器质性心脏病且未应用过抗心律失常药物治疗的室上性心动过速患者进行单位点和双位点起搏,比较发现BB起搏在所有单位点起搏中心房激动时间最短(81±15ms)且其P波宽度最短(96±12ms)。另外,多项研究也表明,BB起搏可明显缩短P波宽度。Bailin等[28]对未应用抗心律失常药物的复发性阵发性房颤患者分为右心耳起搏(n=57)和右房前上间隔起搏(BB范围;n=63)两组,并进行比较,结果表明BB组P波宽度明显短于窦性心律时的P波宽度(BB,123±23 VS. 132±21ms;p<0.05),且植入起搏1年后, BB组持续性房颤发病率(25%)明显低于右心耳起搏组(53%)(见图7、8)。虽有个案报道[29],CRT治疗合并BB起搏,可改善心衰合并房颤的心功能及心衰、房颤相关症状。但Nigro等[30]对30例1型肌强直性营养不良(MD1)合并阵发性房颤并已植入起搏的患者经行了12个月的随访(其中16列选择右心耳起搏,14例选择BB起搏)。该随访结果显示,两组起搏均不能减少阵发性房颤的持续时间和房颤相关症状的次数。因此BB起搏是否可以预防或者减少房颤的发生,仍需要大规模的临床研究证实。
大量研究数据已证实BB在快速性房性心律失常的起始及持续具有重要作用,因此人们探讨能否通过BB起搏预防房颤。2000年Yu等[24] 最先对心房不同位点起搏预防房颤的疗效进行对比,该研究对15例阵发性房颤患者的6种不同位点起搏,包括右心耳(RAA)、BB、右后房间隔(RPS)、冠状窦远端(CSd)、同时刺激右心耳+右后房间隔(DSA)、右心耳+冠状窦远端(BiA)的P波宽度进行测量,发现右心耳起搏的P波宽度最长,并按以下顺序依次缩短RAA,Csd,包含间隔部分的起搏如BB、RPS或DSA,最后为BiA起搏,结果表明右房间隔起搏可明显缩短总心房激动时间。相似的,Lewicka-Nowak 等[25]对57名心电图P波增宽、房颤反复发作的病窦患者进行研究,所有病人冠状窦放置一根电极,通过另一根电极放置的位置不同将其分为两组,右心耳+CS组(另一根电极放在右心耳)和BB+CS组(另一根电极放在BB),并应用组织多普勒记录心房壁的电机械延搁(EMD)和心房收缩同步化情况,该研究显示:BB电极替代RAA电极不但不会影响心脏射血功能,而且会使LA提前收缩,改变右-左房收缩顺序,提高LA收缩的同步化。 随后的研究[26] 也发现BB起搏也可以缩短心房激动时间。在缩短P波宽度方面,BB、冠状窦和右后房间隔起搏明显优于右心耳+右后房间隔及右心耳+冠状窦远端起搏,而且BB、右后房间隔或冠状窦起搏联合右心耳额外刺激进行诱发房颤失败,而右心耳、右心耳+右后房间隔或右心耳+冠状窦远端起搏联合右心耳额外刺激可成功诱发房颤。因此,该研究显示,BB、冠状窦和右后房间隔起搏可成功预防房颤发生。Duyschaever等[27] 研究发现BB中部起搏是预防心房折返的最佳位点。
2002年Gozolits等[26]对接受射频消融治疗之后的15例无器质性心脏病且未应用过抗心律失常药物治疗的室上性心动过速患者进行单位点和双位点起搏,比较发现BB起搏在所有单位点起搏中心房激动时间最短(81±15ms)且其P波宽度最短(96±12ms)。另外,多项研究也表明,BB起搏可明显缩短P波宽度。Bailin等[28]对未应用抗心律失常药物的复发性阵发性房颤患者分为右心耳起搏(n=57)和右房前上间隔起搏(BB范围;n=63)两组,并进行比较,结果表明BB组P波宽度明显短于窦性心律时的P波宽度(BB,123±23 VS. 132±21ms;p<0.05),且植入起搏1年后, BB组持续性房颤发病率(25%)明显低于右心耳起搏组(53%)(见图7、8)。虽有个案报道[29],CRT治疗合并BB起搏,可改善心衰合并房颤的心功能及心衰、房颤相关症状。但Nigro等[30]对30例1型肌强直性营养不良(MD1)合并阵发性房颤并已植入起搏的患者经行了12个月的随访(其中16列选择右心耳起搏,14例选择BB起搏)。该随访结果显示,两组起搏均不能减少阵发性房颤的持续时间和房颤相关症状的次数。因此BB起搏是否可以预防或者减少房颤的发生,仍需要大规模的临床研究证实。

图7 BB区域起搏位置
注:左图为LAO体位的BB区域起搏位置;右图为RAO体位的BB区域起搏位置
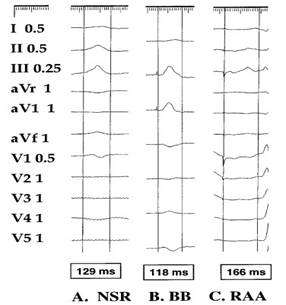
图8 窦性、BB区域起搏、RAA起搏的P波宽度比较
综上所述,BB作为心房间的优势传导,其结构改变可引起相应肌纤维传导的纵向分离,从而引起折返以及促进房颤的发生。相关临床研究数据显示,BB的病理电活动改变与房颤的发展存在着相关性。但是传导阻滞并不仅仅只与BB阻滞相关。BB传导阻滞也许仅仅反映心房中常见的病理电活动改变。目前仍需进一步研究去明确BB在AF的触发及维持中的作用,从而明确以BB为靶点的治疗是否可用于防止房颤的进展。
参考文献
1. James TN. The connecting pathways between the sinus node and a-v node and between the right and the left atrium in the human heart. Am Heart J. 1963;66:498-508.
2. Khaja A, Flaker G. Bachmann’s bundle: does it play a role in atrial fibrillation? Pacing Clin Electrophysiol. 2005;28:855-863.
3. Horiba M. Stimulus conduction in atria studied by means of intracellular microelectrode. I. That in bachmann’s bundle. Japanese Heart Journal.1963;185:333–345.
4. Wagner ML, Lazzara R, Weiss RM, et al. Specialized conducting fibers in the interatrial band. Circ Res. 1966;18:502-518.
5. Weidmann S. Effects of calcium ions and local anesthetics on electrical properties of Purkinje fibres. J Physiol. 1955;129:568-582.
6. Waldo AL, Bush HL Jr, Gelband H, et al. Effects on the canine P wave of discrete lesions in the specialized atrial tracts. Circ Res. 1971;29:452-467.
7. Ariyarajah V, Asad N, Tandar A, et al. Interatrial block: pandemic prevalence, significance, and diagnosis. Chest. 2005;128:970-975.
8. Scherlag BJ, Helfant RH, Haft JI, et al. Electrophysiology underlying ventricular arrhythmias due to coronary ligation. Am J Physiol. 1970;219:1665-1671.
9. Mizuno R, Fujimoto S, Nakano H, Nakajima T, Kimura A, Nakagawa Y, Dohi K. Atrial conduction abnormalities in patients with systemic progressive sclerosis. Eur Heart J. 1997;18:1995-2001.
10. Ohtani K, Yutani C, Nagata S, et al. High prevalence of atrial fibrosis in patients with dilated cardiomyopathy. J Am Coll Cardiol. 1995;25:1162-1169.
11. Engelen MA, Juergens KU, Breithardt G, et al. Interatrial conduction delay and atrioventricular block due to primary cardiac lymphoma. J Cardiovasc Electrophysiol. 2005;16:926.
12. Omichi C, Kawasaki A, Kasai A.Synergistic effects of cardiac resynchronization therapy and Bachmann's bundle pacing on heart failure with atrial tachyarrhythmias. Cardiol J, 2009;16(4):358-61.
13. Ariyarajah V, Spodick DH. The Bachmann Bundle and interatrial conduction. Cardiol Rev. 2006;14:194-199.
14. Agarwal YK, Aronow WS, Levy JA, et al. Association of interatrial block with development of atrial fibrillation. Am J Cardiol. 2003;91:882.
15. Bayes de Luna A, Cladellas M, Oter R, et al. Interatrial conduction block and retrograde activation of the left atrium and paroxysmal supraventricular tachyarrhythmia. Eur Heart J. 1988;9:1112-1118.
16. Ariyarajah V, Fernandes J, Kranis M, et al. Prospective evaluation of atrial tachyarrhythmias in patients with interatrial block. Int J Cardiol. 2007;118:332-337.
17. Ariyarajah V, Spodick DH. Progression of advanced interatrial block to atrial flutter: a prospectively-followed case. Cardiology. 2006;106:161-163.
18. Abe Y, Fukunami M, Yamada T, Ohmori M, et al. Prediction of transition to chronic atrial fibrillation in patients with paroxysmal atrial fibrillation by signal-averaged electrocardiography: a prospective study. Circulation. 1997;96:2612-2616.
19. Allessie MA, Bonke FI, Schopman FJ. Circus movement in rabbit atrial muscle as a mechanism of trachycardia. Circ Res. 1973;33:54-62.
20. Ogawa S, Dreifus LS, Osmick MJ. Longitudinal dissociation of Bachmann’s bundle as a mechanism of paroxysmal supraventricular tachycardia. Am J Cardiol. 1977;40:915-922.
21. Llessie MA, Bonke FI, Schopman FJ. Circus movement in rabbit atrial muscle as a mechanism of tachycardia. II. The role of nonuniform recovery of excitability in the occurrence of unidirectional block, as studied with multiple microelectrodes. Circ Res. 1976;39:168-177.
22. Kumagai K, Uno K, Khrestian C, Waldo AL. Single site radiofrequency catheter ablation of atrial fibrillation: studies guided by simultaneous multisite mapping in the canine sterile pericarditis model. J Am Coll Cardiol. 2000;36:917-923.
23. Goyal SB, Spodick DH. Electromechanical dysfunction of the left atrium associated with interatrial block. Am Heart J. 2001;142:823-827.
24. Yu WC, Tsai CF, Hsieh MH, et al. Prevention of the initiation of atrial fibrillation: mechanism and efficacy of different atrial pacing modes. Pacing Clin Electrophysiol 2000;23:373-379.
25. Lewicka-Nowak E, Dabrowska-Kugacka A, Rucinski P, et al. Atrial function during different multisite atrial pacing modalities in patients with bradycardia--tachycardia syndrome. Circ J, 2009, 73(11): 2029-2035.
26. Gozolits S, Fischer G, Berger T, et al. Global P wave duration on th65-lead ECG: single-site and dual-site pacing in the structurally norma human atrium. J Cardiovasc Electrophysiol. 2002;13:1240-1245.
27. Duytschaever M, Danse P, Eysbouts S, et al. Is there an optimal pacing site to prevent atrial fibrillation? An experimental study in the chronically instrumented goat. J Cardiovasc Electrophysiol. 2002;13:1264-1271.
28. Bailin SJ, Adler S, Giuduci M. Prevention of chronic atrial fibrillation by pacing in the region of bachmann's bundle: results of a multicenter randomized trial. J Cardiovasc Electrophysiology. 2001;12:912-917.
29. Omichi C, Kawasaki A, Kasai A.Synergistic effects of cardiac resynchronization therapy and Bachmann's bundle pacing on heart failure with atrial tachyarrhythmias. Cardiol J, 2009;16(4):358-361.
30. Nigro G, Russo V, Politano L,et al. Does Bachmann's bundle pacing prevent atrial fibrillation in myotonic dystrophy type 1 patients? A 12 months follow-up study. Europace. 2010, 12(9):1219-1223.
1. James TN. The connecting pathways between the sinus node and a-v node and between the right and the left atrium in the human heart. Am Heart J. 1963;66:498-508.
2. Khaja A, Flaker G. Bachmann’s bundle: does it play a role in atrial fibrillation? Pacing Clin Electrophysiol. 2005;28:855-863.
3. Horiba M. Stimulus conduction in atria studied by means of intracellular microelectrode. I. That in bachmann’s bundle. Japanese Heart Journal.1963;185:333–345.
4. Wagner ML, Lazzara R, Weiss RM, et al. Specialized conducting fibers in the interatrial band. Circ Res. 1966;18:502-518.
5. Weidmann S. Effects of calcium ions and local anesthetics on electrical properties of Purkinje fibres. J Physiol. 1955;129:568-582.
6. Waldo AL, Bush HL Jr, Gelband H, et al. Effects on the canine P wave of discrete lesions in the specialized atrial tracts. Circ Res. 1971;29:452-467.
7. Ariyarajah V, Asad N, Tandar A, et al. Interatrial block: pandemic prevalence, significance, and diagnosis. Chest. 2005;128:970-975.
8. Scherlag BJ, Helfant RH, Haft JI, et al. Electrophysiology underlying ventricular arrhythmias due to coronary ligation. Am J Physiol. 1970;219:1665-1671.
9. Mizuno R, Fujimoto S, Nakano H, Nakajima T, Kimura A, Nakagawa Y, Dohi K. Atrial conduction abnormalities in patients with systemic progressive sclerosis. Eur Heart J. 1997;18:1995-2001.
10. Ohtani K, Yutani C, Nagata S, et al. High prevalence of atrial fibrosis in patients with dilated cardiomyopathy. J Am Coll Cardiol. 1995;25:1162-1169.
11. Engelen MA, Juergens KU, Breithardt G, et al. Interatrial conduction delay and atrioventricular block due to primary cardiac lymphoma. J Cardiovasc Electrophysiol. 2005;16:926.
12. Omichi C, Kawasaki A, Kasai A.Synergistic effects of cardiac resynchronization therapy and Bachmann's bundle pacing on heart failure with atrial tachyarrhythmias. Cardiol J, 2009;16(4):358-61.
13. Ariyarajah V, Spodick DH. The Bachmann Bundle and interatrial conduction. Cardiol Rev. 2006;14:194-199.
14. Agarwal YK, Aronow WS, Levy JA, et al. Association of interatrial block with development of atrial fibrillation. Am J Cardiol. 2003;91:882.
15. Bayes de Luna A, Cladellas M, Oter R, et al. Interatrial conduction block and retrograde activation of the left atrium and paroxysmal supraventricular tachyarrhythmia. Eur Heart J. 1988;9:1112-1118.
16. Ariyarajah V, Fernandes J, Kranis M, et al. Prospective evaluation of atrial tachyarrhythmias in patients with interatrial block. Int J Cardiol. 2007;118:332-337.
17. Ariyarajah V, Spodick DH. Progression of advanced interatrial block to atrial flutter: a prospectively-followed case. Cardiology. 2006;106:161-163.
18. Abe Y, Fukunami M, Yamada T, Ohmori M, et al. Prediction of transition to chronic atrial fibrillation in patients with paroxysmal atrial fibrillation by signal-averaged electrocardiography: a prospective study. Circulation. 1997;96:2612-2616.
19. Allessie MA, Bonke FI, Schopman FJ. Circus movement in rabbit atrial muscle as a mechanism of trachycardia. Circ Res. 1973;33:54-62.
20. Ogawa S, Dreifus LS, Osmick MJ. Longitudinal dissociation of Bachmann’s bundle as a mechanism of paroxysmal supraventricular tachycardia. Am J Cardiol. 1977;40:915-922.
21. Llessie MA, Bonke FI, Schopman FJ. Circus movement in rabbit atrial muscle as a mechanism of tachycardia. II. The role of nonuniform recovery of excitability in the occurrence of unidirectional block, as studied with multiple microelectrodes. Circ Res. 1976;39:168-177.
22. Kumagai K, Uno K, Khrestian C, Waldo AL. Single site radiofrequency catheter ablation of atrial fibrillation: studies guided by simultaneous multisite mapping in the canine sterile pericarditis model. J Am Coll Cardiol. 2000;36:917-923.
23. Goyal SB, Spodick DH. Electromechanical dysfunction of the left atrium associated with interatrial block. Am Heart J. 2001;142:823-827.
24. Yu WC, Tsai CF, Hsieh MH, et al. Prevention of the initiation of atrial fibrillation: mechanism and efficacy of different atrial pacing modes. Pacing Clin Electrophysiol 2000;23:373-379.
25. Lewicka-Nowak E, Dabrowska-Kugacka A, Rucinski P, et al. Atrial function during different multisite atrial pacing modalities in patients with bradycardia--tachycardia syndrome. Circ J, 2009, 73(11): 2029-2035.
26. Gozolits S, Fischer G, Berger T, et al. Global P wave duration on th65-lead ECG: single-site and dual-site pacing in the structurally norma human atrium. J Cardiovasc Electrophysiol. 2002;13:1240-1245.
27. Duytschaever M, Danse P, Eysbouts S, et al. Is there an optimal pacing site to prevent atrial fibrillation? An experimental study in the chronically instrumented goat. J Cardiovasc Electrophysiol. 2002;13:1264-1271.
28. Bailin SJ, Adler S, Giuduci M. Prevention of chronic atrial fibrillation by pacing in the region of bachmann's bundle: results of a multicenter randomized trial. J Cardiovasc Electrophysiology. 2001;12:912-917.
29. Omichi C, Kawasaki A, Kasai A.Synergistic effects of cardiac resynchronization therapy and Bachmann's bundle pacing on heart failure with atrial tachyarrhythmias. Cardiol J, 2009;16(4):358-361.
30. Nigro G, Russo V, Politano L,et al. Does Bachmann's bundle pacing prevent atrial fibrillation in myotonic dystrophy type 1 patients? A 12 months follow-up study. Europace. 2010, 12(9):1219-1223.