心房颤动抗栓治疗的出血风险评估
2015-08-11 15:10
心房颤动(简称房颤)患者的缺血性卒中风险是普通人的5倍,且卒中风险因个体差异而不同,因此对于确诊房颤的患者,卒中风险的评估及个体化抗栓治疗尤为重要。研究表明,在房颤人群中,接受抗栓治疗者较未抗栓者缺血性卒中的发生率可降低64%,全因死亡率可降低26%[1]。
房颤的抗栓治疗包括抗血小板和抗凝,而在最新房颤指南中,抗血小板在房颤的抗栓治疗中地位有所下降。目前抗栓治疗策略的选择基于缺血性卒中风险的评估,关于房颤缺血性卒中的危险分层,2012 年ESC房颤指南和2014年AHA/ACC/HRS房颤指南均推荐CHA2DS2-VASc评分取代CHADS2评分(I,B),CHA2DS2-VASc评分涵盖范围广,可更好的评估缺血性卒中风险,尤其对低危人群,有利于筛选缺血性卒中风险相对较高的患者。对于CHA2DS2-VASc评分为0分的非瓣膜病房颤患者不需要抗栓治疗,对于CHA2DS2-VASc评分为1分的非瓣膜病房颤患者可不需要抗栓治疗或口服抗凝药物治疗亦或口服阿司匹林抗血小板治疗,对于CHA2DS2-VASc评分≥2分的非瓣膜病房颤患者,推荐口服抗凝药治疗。
作为传统口服抗凝药,维生素K拮抗剂——华法林在房颤的抗栓治疗中效果显著、证据充分。同时,新型抗凝药物的循证医学证据也越来越多,RE-LY研究(达比加群)、ROCKET-AF研究(利伐沙班)、ARISTOTLE研究(阿哌沙班)均显示新型抗凝药物在复律后抗凝作用同华法林相似[2-4],达比加群、利伐沙班、阿哌沙班已成为房颤抗栓治疗的I类推荐(证据水平B级)。目前服用华法林的房颤患者出血事件发生率为1.3-7.2%/年,其中,颅内出血发生率为0.1%-2.5%[5]。在严格监测抗凝强度情况下,口服华法林者颅内出血风险较对照组升高0.2%[6]。对于新型抗凝药而言,主要出血事件发生率低于或与华法林相近。RE-LY试验中低剂量达比加群(110mg bid)年出血发生率低于华法林(2.71% vs. 3.36%, P=0.003),颅内出血发生率分别为0.12%和0.38%(P<0.001),两种药物的抗栓效果等同。但是高剂量达比加群(150mg bid)出血发生率(3.11%)与华法林无统计学差异(P=0.31),但颅内出血发生率(0.10%)低于华法林[7](图1A)。Rocket-AF研究中,利伐沙班(20mg qd)和华法林的主要出血事件无差异(3.6% vs. 3.4%),但利伐沙班颅内出血(0.5% vs. 0.7%, P=0.02)和致命出血事件(0.2% vs. 0.5%, P=0.003)发生率均低于华法林(图1B)[8]。ARISTOTLE试验中,阿哌沙班(5mg bid)主要出血事件(2.13% vs. 3.09%, P<0.001)和颅内出血发生率(0.24% vs. 0.47%, P<0.001)均低于华法林(图1C)[9]。图2显示了抗栓治疗主要出血事件的相对风险。
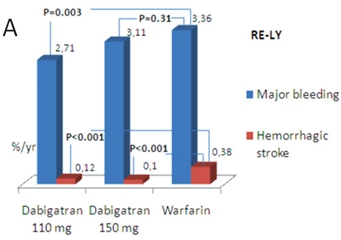
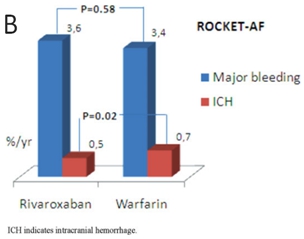
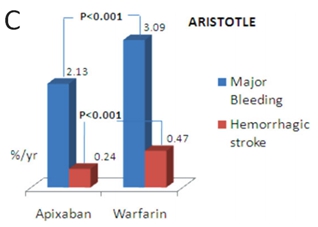
图1. A. RE-LY试验中达比加群与华法林出血事件发生率;B. 利伐沙班与华法林出血事件发生率;C. 阿哌沙班与华法林出血事件发生率。(Larsen TB, et al. Europace. 2014, 16: 698– 702)
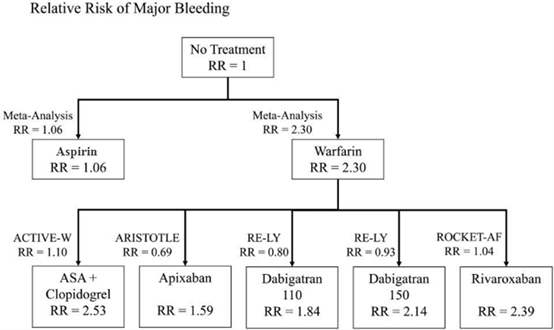
图2. 抗栓治疗主要出血事件的相对风险(relative risk,RR)。箭头旁RR代表相关研究报道子框内抗栓方案与目框内方案相比,子框内的出血事件RR;框内RR代表框内抗栓方案与未抗栓治疗相比的出血事件RR。(LaHaye SA, et al. Eur Heart J. 2012, 33(17):2163-2171)
然而抗栓治疗是一把双刃剑,在房颤抗栓的同时,也伴随出血风险的增加。加拿大1997--2008年抗凝治疗的年龄≥66岁房颤患者125195人,出血发生率为3.8%/患者年,入院患者中1/5在院内或出院不久死亡[10]。因此,抗栓治疗应全面衡量缺血性卒中和出血的风险而制定具体方案。
2005年国际血栓与止血学会定义出血事件为血红蛋白下降2g/dL或出血24-48小时内需输血2个及2个以上单位,及重要器官(颅内、脊柱内、眼内、腹膜后、关节内、心包、合并骨筋膜室综合征的肌肉内出血)的出血。出血风险受多种因素影响,包括治疗方面和患者自身因素,患者自身因素包括年龄、伴随疾病、个体遗传因素,治疗因素包括抗凝强度、抗凝时间及联合用药[11-12]。
出血风险的评估具有重要意义,在抗栓之前和抗栓过程中,临床医生可权衡卒中与出血风险以选择最佳治疗方案。目前关于房颤患者出血风险的分层评分主要包括HEMORR2HAGES评分[13]、HAS-BLED评分[14]和ATRIA评分[15]等。大规模临床研究比较发现, HAS-BLED评分对颅内出血具有更高的预测价值,优于另外两种评分[16]。2012年ESC房颤指南、2014NICE房颤指南和2014年AHA/ACC/HRS房颤指南等均推荐应用HAS-BLED评分用于房颤患者出血风险的评估,该评分中每项危险因素均可通过病史或常规检查获得,实用性强。LaHaye等[17]对丹麦73538例未抗凝治疗的非瓣膜房颤患者进行HAS-BLED评分并随访,得出了该评分与主要出血事件(定义为出血发生后需要住院和/或引起血红蛋白下降大于2g/L和/或需要输血治疗)发生风险的关系,见图3。HAS-BLED评分将出血风险分为三层:0-1分为低位,2分为中危,≥3分为高位。大于3分时,无论是否应用抗栓药物及何种抗栓药物,其出血风险均较高[11],无论接受口服抗凝药物还是阿司匹林治疗均需谨慎,并在开始抗凝治疗后加强监测。
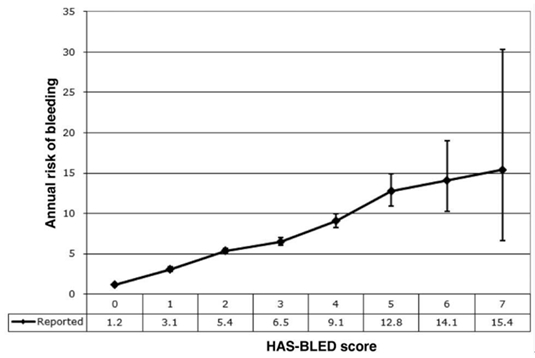
图3. HAS-BLED评分与年出血事件发生风险。(LaHaye SA, et al. Eur Heart J. 2012, 33(17):2163-2171)
研究表明,出血风险的危险因素与缺血性卒中的危险因素具有部分的重叠,CHA2DS2-VASc评分和HAS-BLED评分中都有高龄、高血压、卒中史,这些既是房颤患者发生血栓栓塞事件的危险因素,又是抗凝治疗出血的危险因素,因而部分情况下抗栓治疗可能相对棘手,需针对患者个体化情况确定治疗方案[18]。对于房颤患者,抗凝治疗可明显减少缺血性卒中发生率,相比严重出血事件发生率而言,利大于弊[19]。虽然出血风险增高者发生血栓栓塞事件的风险往往也增高,但这些患者接受抗栓治疗的净获益可能更大,故不应将HAS-BLED评分增高视为抗凝治疗禁忌证,而应评分后对高分患者的加强抗栓强度的监测(如减少华法林起始剂量和增加监测频度),并及时纠正增加出血风险的可逆性因素。
在房颤的抗栓治疗过程中,不可随意决策,更不能因噎废食,需同时评估缺血性卒中风险与出血风险,权衡利弊从而选择最合适的抗栓策略,以实现患者的最大净获益。
参考文献
1. Hart RG, Pearce LA, Aguilar MI. Meta-analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med2007;146 :857-867.
2. Nagarakanti R, Ezekowitz MD, Oldgren J, et al. Dabigatran versus warfarin in patients with atrial fibrillation: an analysis of patients undergoing cardioversion. Circulation 2011,123:131-136.
3. Piccini JP, Stevens SR, Lokhnygina Y, et al. Outcomes Following Cardioversion and Atrial Fibrillation Ablation in Patients Treated with Rivaroxaban and Warfarin in the ROCKET AF Trial. J Am Coll Cardiol. 2013;61:1998-2006.
4. Flaker G, Lopes RD, Al-Khatib SM, et al. Efficacy and Safety of Apixaban in Patients Following Cardioversion for Atrial Fibrillation: Insights from the ARISTOTLE trial. J Am Coll Cardiol. 2013
5. Lip GYH, Andreotti F, Fauchier L, et al. Bleeding risk assessment, management in atrialfibrillation patients. Executive summary of a position documentfrom the European Heart Rhythm Association [EHRA], endorsedby the European Society ofCardiology [ESC] Working Group onThrombosis. Europace 2011; 13:723–746.
6. Schulman S, Beyth RJ, Kearon C, Levine MN; American Collegeof Chest Physicians. Hemorrhagic complications of anticoagulantand thrombolytic treatment: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th ed). Chest 2008;133(6 Suppl):257S–298S.
7. Connolly SJ, Ezekowitz MD, Yusuf S, et al. Dabigatran versus warfarin in patients with atrialfibrillation. N Engl J Med 2009; 361:1139–1151
8. Patel MR, Mahaffey KW, Garg J, et al. Rivaroxaban versus warfarin innonvalvular atrial fibrillation. N Engl J Med 2011; 365:883–891.
9. Granger CB, Alexander JH, McMurray JJV, et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011; 365:981–992.
10. Gomes T, Mamdani MM, Holbrook AM, et al. Rates of hemorrhage during warfarin therapy for atrial fibrillation. CMAJ. 2013 Feb 5;185(2):E121-127.
11. Friberg L, Rosenqvist M, Lip GY. Evaluation of risk stratification schemes for ischaemic stroke and bleeding in 182 678 patients withatrial fibrillation: The Swedish Atrial Fibrillation cohort study. EurHeart J. 2012; 33:1500–1510.
12. Palareti G, Cosmi B. Bleeding with anticoagulation therapy - Who is at risk, and how best to identify such patients. Thromb Haemost2009; 102:268–278.
13. Gage BF, Yan Y, Milligan PE, Waterman AD, et al. Clinical classification schemes for predicting hemorrhage: Results from the National Registry of Atrial Fibrillation(NRAF). Am Heart J 2006; 151:713–719.
14. Pisters R, Lane DA, Nieuwlaat R, et al. A novel user-friendly score (HAS-BLED) to assess 1-year riskof major bleeding in patients with atrial fibrillation: The Euro HeartSurvey. Chest 2010; 138:1093–1100
15. Fang MC, Go AS, Chang Y, Borowsky LH, et al. A new risk scheme to predict warfarin-associated hemorrhage: The ATRIA (Anticoagulation and Risk Factors in Atrial Fibrillation) study. JAmColl Cardiol 2011; 58:395–401.
16. Apostolakis S, Lane DA, Guo Y, et al. Performanceof the HEMORR2HAGES, ATRIA, and HAS-BLED bleeding risk-prediction scores in patients with atrial fibrillation undergoing anticoagulation. J Am Coll Cardiol 2012; 60:861–867.
17. LaHaye SA, Gibbens SL, Ball DG, et al. A clinical decision aid for the selection of tithrombotic therapy for the prevention of stroke due to atrial fibrillation. Eur Heart J. 2012, 3(17): 2163- 2171.
18. Nieuwlaat R, Capucci A, Lip GY, et al. Euro Heart Survey Investigators. Anti-thrombotic treat- ment in real-life atrial fibrillation patients: a report from the Euro Heart Survey on Atrial Fibrillation . Eur Heart J. 2006 ; 27 ( 24 ): 3018-3026.
19. Friberg L, Rosenqvist M, Lip GYH. Net clinical benefit of warfarin in patients with atrial fibrillation: A report from the Swedish Atrial Fibrillation Cohort Study. Circulation 2012; 125:2298-2307.
阅读数: 2145
房颤的抗栓治疗包括抗血小板和抗凝,而在最新房颤指南中,抗血小板在房颤的抗栓治疗中地位有所下降。目前抗栓治疗策略的选择基于缺血性卒中风险的评估,关于房颤缺血性卒中的危险分层,2012 年ESC房颤指南和2014年AHA/ACC/HRS房颤指南均推荐CHA2DS2-VASc评分取代CHADS2评分(I,B),CHA2DS2-VASc评分涵盖范围广,可更好的评估缺血性卒中风险,尤其对低危人群,有利于筛选缺血性卒中风险相对较高的患者。对于CHA2DS2-VASc评分为0分的非瓣膜病房颤患者不需要抗栓治疗,对于CHA2DS2-VASc评分为1分的非瓣膜病房颤患者可不需要抗栓治疗或口服抗凝药物治疗亦或口服阿司匹林抗血小板治疗,对于CHA2DS2-VASc评分≥2分的非瓣膜病房颤患者,推荐口服抗凝药治疗。
作为传统口服抗凝药,维生素K拮抗剂——华法林在房颤的抗栓治疗中效果显著、证据充分。同时,新型抗凝药物的循证医学证据也越来越多,RE-LY研究(达比加群)、ROCKET-AF研究(利伐沙班)、ARISTOTLE研究(阿哌沙班)均显示新型抗凝药物在复律后抗凝作用同华法林相似[2-4],达比加群、利伐沙班、阿哌沙班已成为房颤抗栓治疗的I类推荐(证据水平B级)。目前服用华法林的房颤患者出血事件发生率为1.3-7.2%/年,其中,颅内出血发生率为0.1%-2.5%[5]。在严格监测抗凝强度情况下,口服华法林者颅内出血风险较对照组升高0.2%[6]。对于新型抗凝药而言,主要出血事件发生率低于或与华法林相近。RE-LY试验中低剂量达比加群(110mg bid)年出血发生率低于华法林(2.71% vs. 3.36%, P=0.003),颅内出血发生率分别为0.12%和0.38%(P<0.001),两种药物的抗栓效果等同。但是高剂量达比加群(150mg bid)出血发生率(3.11%)与华法林无统计学差异(P=0.31),但颅内出血发生率(0.10%)低于华法林[7](图1A)。Rocket-AF研究中,利伐沙班(20mg qd)和华法林的主要出血事件无差异(3.6% vs. 3.4%),但利伐沙班颅内出血(0.5% vs. 0.7%, P=0.02)和致命出血事件(0.2% vs. 0.5%, P=0.003)发生率均低于华法林(图1B)[8]。ARISTOTLE试验中,阿哌沙班(5mg bid)主要出血事件(2.13% vs. 3.09%, P<0.001)和颅内出血发生率(0.24% vs. 0.47%, P<0.001)均低于华法林(图1C)[9]。图2显示了抗栓治疗主要出血事件的相对风险。



图1. A. RE-LY试验中达比加群与华法林出血事件发生率;B. 利伐沙班与华法林出血事件发生率;C. 阿哌沙班与华法林出血事件发生率。(Larsen TB, et al. Europace. 2014, 16: 698– 702)

图2. 抗栓治疗主要出血事件的相对风险(relative risk,RR)。箭头旁RR代表相关研究报道子框内抗栓方案与目框内方案相比,子框内的出血事件RR;框内RR代表框内抗栓方案与未抗栓治疗相比的出血事件RR。(LaHaye SA, et al. Eur Heart J. 2012, 33(17):2163-2171)
然而抗栓治疗是一把双刃剑,在房颤抗栓的同时,也伴随出血风险的增加。加拿大1997--2008年抗凝治疗的年龄≥66岁房颤患者125195人,出血发生率为3.8%/患者年,入院患者中1/5在院内或出院不久死亡[10]。因此,抗栓治疗应全面衡量缺血性卒中和出血的风险而制定具体方案。
2005年国际血栓与止血学会定义出血事件为血红蛋白下降2g/dL或出血24-48小时内需输血2个及2个以上单位,及重要器官(颅内、脊柱内、眼内、腹膜后、关节内、心包、合并骨筋膜室综合征的肌肉内出血)的出血。出血风险受多种因素影响,包括治疗方面和患者自身因素,患者自身因素包括年龄、伴随疾病、个体遗传因素,治疗因素包括抗凝强度、抗凝时间及联合用药[11-12]。
出血风险的评估具有重要意义,在抗栓之前和抗栓过程中,临床医生可权衡卒中与出血风险以选择最佳治疗方案。目前关于房颤患者出血风险的分层评分主要包括HEMORR2HAGES评分[13]、HAS-BLED评分[14]和ATRIA评分[15]等。大规模临床研究比较发现, HAS-BLED评分对颅内出血具有更高的预测价值,优于另外两种评分[16]。2012年ESC房颤指南、2014NICE房颤指南和2014年AHA/ACC/HRS房颤指南等均推荐应用HAS-BLED评分用于房颤患者出血风险的评估,该评分中每项危险因素均可通过病史或常规检查获得,实用性强。LaHaye等[17]对丹麦73538例未抗凝治疗的非瓣膜房颤患者进行HAS-BLED评分并随访,得出了该评分与主要出血事件(定义为出血发生后需要住院和/或引起血红蛋白下降大于2g/L和/或需要输血治疗)发生风险的关系,见图3。HAS-BLED评分将出血风险分为三层:0-1分为低位,2分为中危,≥3分为高位。大于3分时,无论是否应用抗栓药物及何种抗栓药物,其出血风险均较高[11],无论接受口服抗凝药物还是阿司匹林治疗均需谨慎,并在开始抗凝治疗后加强监测。

图3. HAS-BLED评分与年出血事件发生风险。(LaHaye SA, et al. Eur Heart J. 2012, 33(17):2163-2171)
研究表明,出血风险的危险因素与缺血性卒中的危险因素具有部分的重叠,CHA2DS2-VASc评分和HAS-BLED评分中都有高龄、高血压、卒中史,这些既是房颤患者发生血栓栓塞事件的危险因素,又是抗凝治疗出血的危险因素,因而部分情况下抗栓治疗可能相对棘手,需针对患者个体化情况确定治疗方案[18]。对于房颤患者,抗凝治疗可明显减少缺血性卒中发生率,相比严重出血事件发生率而言,利大于弊[19]。虽然出血风险增高者发生血栓栓塞事件的风险往往也增高,但这些患者接受抗栓治疗的净获益可能更大,故不应将HAS-BLED评分增高视为抗凝治疗禁忌证,而应评分后对高分患者的加强抗栓强度的监测(如减少华法林起始剂量和增加监测频度),并及时纠正增加出血风险的可逆性因素。
在房颤的抗栓治疗过程中,不可随意决策,更不能因噎废食,需同时评估缺血性卒中风险与出血风险,权衡利弊从而选择最合适的抗栓策略,以实现患者的最大净获益。
参考文献
1. Hart RG, Pearce LA, Aguilar MI. Meta-analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med2007;146 :857-867.
2. Nagarakanti R, Ezekowitz MD, Oldgren J, et al. Dabigatran versus warfarin in patients with atrial fibrillation: an analysis of patients undergoing cardioversion. Circulation 2011,123:131-136.
3. Piccini JP, Stevens SR, Lokhnygina Y, et al. Outcomes Following Cardioversion and Atrial Fibrillation Ablation in Patients Treated with Rivaroxaban and Warfarin in the ROCKET AF Trial. J Am Coll Cardiol. 2013;61:1998-2006.
4. Flaker G, Lopes RD, Al-Khatib SM, et al. Efficacy and Safety of Apixaban in Patients Following Cardioversion for Atrial Fibrillation: Insights from the ARISTOTLE trial. J Am Coll Cardiol. 2013
5. Lip GYH, Andreotti F, Fauchier L, et al. Bleeding risk assessment, management in atrialfibrillation patients. Executive summary of a position documentfrom the European Heart Rhythm Association [EHRA], endorsedby the European Society ofCardiology [ESC] Working Group onThrombosis. Europace 2011; 13:723–746.
6. Schulman S, Beyth RJ, Kearon C, Levine MN; American Collegeof Chest Physicians. Hemorrhagic complications of anticoagulantand thrombolytic treatment: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th ed). Chest 2008;133(6 Suppl):257S–298S.
7. Connolly SJ, Ezekowitz MD, Yusuf S, et al. Dabigatran versus warfarin in patients with atrialfibrillation. N Engl J Med 2009; 361:1139–1151
8. Patel MR, Mahaffey KW, Garg J, et al. Rivaroxaban versus warfarin innonvalvular atrial fibrillation. N Engl J Med 2011; 365:883–891.
9. Granger CB, Alexander JH, McMurray JJV, et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011; 365:981–992.
10. Gomes T, Mamdani MM, Holbrook AM, et al. Rates of hemorrhage during warfarin therapy for atrial fibrillation. CMAJ. 2013 Feb 5;185(2):E121-127.
11. Friberg L, Rosenqvist M, Lip GY. Evaluation of risk stratification schemes for ischaemic stroke and bleeding in 182 678 patients withatrial fibrillation: The Swedish Atrial Fibrillation cohort study. EurHeart J. 2012; 33:1500–1510.
12. Palareti G, Cosmi B. Bleeding with anticoagulation therapy - Who is at risk, and how best to identify such patients. Thromb Haemost2009; 102:268–278.
13. Gage BF, Yan Y, Milligan PE, Waterman AD, et al. Clinical classification schemes for predicting hemorrhage: Results from the National Registry of Atrial Fibrillation(NRAF). Am Heart J 2006; 151:713–719.
14. Pisters R, Lane DA, Nieuwlaat R, et al. A novel user-friendly score (HAS-BLED) to assess 1-year riskof major bleeding in patients with atrial fibrillation: The Euro HeartSurvey. Chest 2010; 138:1093–1100
15. Fang MC, Go AS, Chang Y, Borowsky LH, et al. A new risk scheme to predict warfarin-associated hemorrhage: The ATRIA (Anticoagulation and Risk Factors in Atrial Fibrillation) study. JAmColl Cardiol 2011; 58:395–401.
16. Apostolakis S, Lane DA, Guo Y, et al. Performanceof the HEMORR2HAGES, ATRIA, and HAS-BLED bleeding risk-prediction scores in patients with atrial fibrillation undergoing anticoagulation. J Am Coll Cardiol 2012; 60:861–867.
17. LaHaye SA, Gibbens SL, Ball DG, et al. A clinical decision aid for the selection of tithrombotic therapy for the prevention of stroke due to atrial fibrillation. Eur Heart J. 2012, 3(17): 2163- 2171.
18. Nieuwlaat R, Capucci A, Lip GY, et al. Euro Heart Survey Investigators. Anti-thrombotic treat- ment in real-life atrial fibrillation patients: a report from the Euro Heart Survey on Atrial Fibrillation . Eur Heart J. 2006 ; 27 ( 24 ): 3018-3026.
19. Friberg L, Rosenqvist M, Lip GYH. Net clinical benefit of warfarin in patients with atrial fibrillation: A report from the Swedish Atrial Fibrillation Cohort Study. Circulation 2012; 125:2298-2307.