自主神经干预治疗心房颤动
2015-07-21 13:41
心房颤动(简称房颤)是临床上最常见的心律失常之一。尽管目前房颤的治疗已取得了很大的进展,但房颤的发生机制仍存在较大争议。近年来研究表明自主神经系统异常是房颤发生和维持过程中的一个重要机制。通过神经消融或刺激达到直接破坏或间接调控自主神经可以有效的治疗房颤。本文将从心脏自主神经系统解剖,自主神经系统参与房颤的证据和机制,以及自主神经干预治疗房颤这三个方面做一概述。
1 心脏自主神经系统解剖概述
心脏自主神经系统(CANS)主要由外源性CANS和内源性CANS所构成。连接大脑与心脏表面神经丛(GP)之间的神经纤维构成外源性CANS;而位于心房表面、大血管附近的GP以及连接这些GP的神经纤维构成了内源性CANS。
1.1 外源性CANS
外源性CANS由交感成分和副交感成分组成(图1A)。交感神经起源于下丘脑后外侧,发出节前纤维并终止于颈上、颈胸(星状)、和胸神经节。副交感神经起源于延髓内测,由迷走神经干、迷走神经丛和迷走神经节后神经元组成。大部分迷走神经纤维都会在上腔静脉和主动脉之间的脂肪垫(即第三脂肪垫)聚集,支配窦房结和房室结1。
1.2 内源性CANS
双侧心脏自主神经在支配心房前,常会在心房表面一定位置聚集,形成GP。Armour等2发现心脏有多个主要的GP,分布于心脏和大血管附近,组成了一个复杂的神经网络。Scherlag等3按照解剖位置总结了4个主要GP(图1B):(1)右前GP,位于右上肺静脉与右心房连接处,主要支配窦房结及周围心房的活动;(2)右下GP,位于下腔静脉与心房的连接处,主要支配房室结及周围心房的活动;(3)左上GP,位于左上肺静脉与左房连接处;(4)左下GP,位于左下肺静脉与左房的连接处。
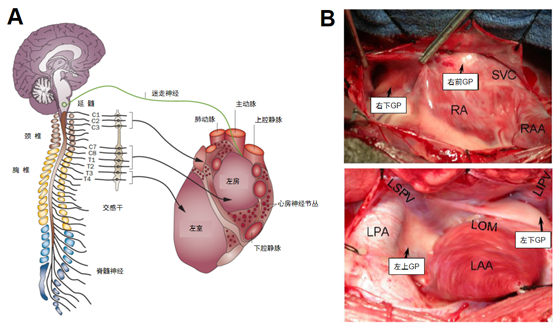
图1 心脏自主神经系统(CANS)解剖概述A:外源性CANS(源于Shen et al. Nat Rev Cardiol. 2011, 9(1): 30-9);B:内源性CANS。SVC:上腔静脉;RA:右心房;RAA:右心耳;LSPV:左上肺静脉; LIPV:左下肺静脉;LOM:Marshall韧带;LAA:左心耳。
2 自主神经系统与房颤
早在1978年,Coumel等4就提出自主神经系统激活在阵发性房颤的发生中起着重要的作用。他们发现心脏结构正常的年轻房颤患者主要伴有迷走神经激活的表现,而合并器质性心脏病的房颤患者主要伴有交感神经激活的表现。这一发现后来通过分析心率变异性得到进一步证实。随后,在体神经活性记录被广泛用于房颤的机制研究,为自主神经激活参与房颤提供了直接证据。
2.2 自主神经激活参与房颤的间接证据——心率变异性分析
上世纪末,大量的临床研究对房颤患者进行了心率变异性分析。研究发现手术后出现阵发性房颤的患者在房颤发生前常会伴有交感活性的增加或者迷走活性的降低5;孤立性和夜间发生房颤的年轻患者主要表现为迷走活性的增加6。然而,进一步研究6-9提示房颤的发生不是单独迷走激活或者单独交感激活所致,而是与迷走交感的失衡有关。一项源于欧洲心脏调查的研究10共纳入1500例阵发性房颤患者,该研究根据房颤触发因素将其分为交感性、迷走性和混合性(兼有迷走和交感)房颤。
然而,这些研究大多是对患者的长程心电图进行心率变异性分析所得出的结论,不能直接的反应自主神经活性。再者,心率变异性分析需要完好的窦房结来协调心脏对自主神经活性的反应。慢性心力衰竭(简称心衰)多伴有窦房结功能障碍,心率变异性分析的结果就无法准确的评估交感神经活性。同样,对于伴有窦房结功能障碍的房颤患者,心率变异性分析的应用也受到限制。因此,直接神经活性记录对房颤自主神经机制研究显得十分重要。
2.2 自主神经激活参与房颤的直接证据——神经活性记录
为了证明自主神经激活是房颤的一个触发因素,Tan等11对犬心房进行间断快速起搏并在每次起搏停止后利用无线发射装置同时记录体表心电图、左侧星状神经节(LSG)和左侧迷走神经的神经活性,实验持续数周。该研究发现交感、迷走的同时放电是阵发性房速/房颤最常见的触发因素(图2A)。后来,Choi等12用同样的方法同时记录了包括LSG、左侧迷走神经以及内源性自主神经(左上GP和Marshall韧带)的活性。结果显示左上GP和Marshall韧带是阵发性房速/房颤最常见的触发因素(图2B)。Po教授研究小组通过对右前GP和左上GP高频电刺激诱发内源性CANS高活性状态,结果显著缩短了心房有效不应期(ERP),增加了ERP的离散度,提示内源性CANS激活能够导致心房电重构,增加心房的易颤性13。他们还在快速心房起搏(RAP)14和睡眠呼吸暂停15相关的急性房颤模型中进一步证实GP高活性是房颤主要的触发因素。这些研究共同为自主神经激活参与房颤的发生和维持提供了直接证据。
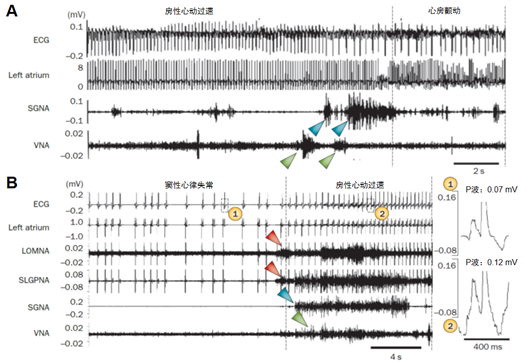
图2自主神经激活触发房性心律失常 A:交感(蓝色箭头)、迷走(绿色箭头)同时激活触发房性心动过速转为房颤(源于Tan et al. Circulation. 2008, 118: 918-925);B:在一次房性心动过速发生前,内源性心脏自主神经(左上GP和Marshall韧带,红色箭头)激活先于外源性心脏自主神经(星状神经节和迷走神经)激活,提示内源性自主神经激活是房速的主要触发因素(源于Choi et al. Circulation. 2010, 121:2615-2623)。右下角放大图显示窦性心律失常(1)和房性心律失常(2)时P波形态不同。Left atrium:左房;LOMNA:Marshall韧带活性;SLGPNA:左上GP活性;SGNA:星状神经节活性;VNA:迷走神经活性。
2.3 自主神经激活参与房颤的机制
自主神经激活通过复杂的机制参与房颤的发生和维持。最近,Linz等16将自主神经激活参与房颤的机制总结成三个环路:电环路、触发环路和结构环路(见图3)。交感神经激活引起交感神经元末梢释放去甲肾上腺素,作用于β肾上腺素能受体,激活心肌膜上的钙通通,使钙离子内流增加,细胞内肌浆网释放的钙离子也增加,导致心房异位(触发环路)。迷走神经激活诱发心肌膜上离子电流的变化,缩短心房ERP和动作电位时程,促进折返电路形成(电环路)。充血性心衰,高血压或睡眠呼吸暂停等引起心房牵张,激活众多纤维化通路,导致心房结构改变和传导异常,同样促进折返电路形成(结构环路)。三个环路互相促进,形成正反馈加强这些病理生理变化,最终促进房颤的发生和维持。
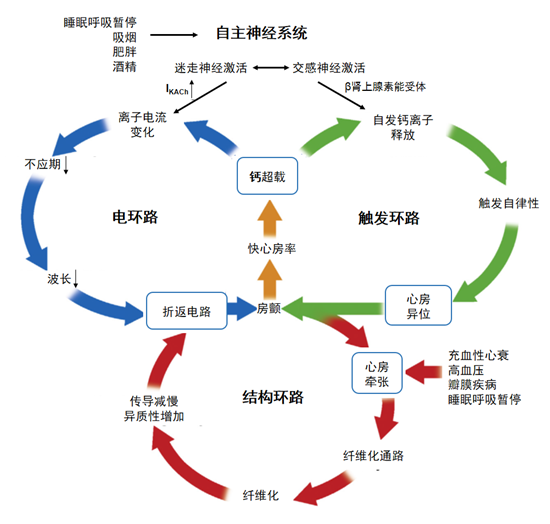
图3 自主神经激活参与房颤的机制(源于Linz et al. J Am CollCardiol. 2014, 63:215-24)
2.4 “心-心反射”与房颤
传统的观点认为,心房表面GP不过是中枢神经系统通向心脏的中继站。然而,近来Lu等17-19研究发现GP不仅仅是上传下达的中继站,还是心脏局部反射网络中的核心。当心脏局部的自主神经末梢兴奋时,刺激信号经传入纤维激活GP,GP兴奋后又通过传出纤维释放大量的神经递质(乙酰胆碱和去甲肾上腺素)到邻近的肺静脉、心房和远端的心耳,后三者再将兴奋信号传回GP,这种快速的神经传导最终导致GP充分激活,临近的肺静脉在GP的驱使成为触发和驱动房颤最活跃的因素。因此,心脏局部神经兴奋能在短时间内通过快速的神经传导使GP充分激活,这种神经传导模式被称为“心-心反射”(cardio-cardiac reflex,图4)。Lu等19和Scherlag等20通过一系列的实验研究发现心-心反射在房颤的发生和维持机制中起着重要的作用。
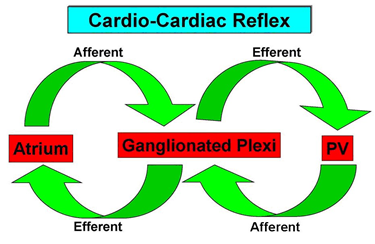
图4 心-心反射(Cardio-Cardiac Reflex)示意图(源于鲁志兵,江洪.中华心律失常学杂志.2011,15:70-3) Afferent:传入神经;Efferent:传出神经;Atrium:心房;GanglionatedPlexi:心房自主神经节;PV:肺静脉。
3 自主神经干预治疗房颤
1998年,Haissaguerre等首次提出用肺静脉电隔离治疗房颤,大量临床研究已经证实这一术式对大部分房颤有效,然而部分患者需要进行2~3次甚至更多次消融,增加肺静脉狭窄的风险。近年来,越来越多的基础和临床研究发现可以通过自主神经干预(消融或刺激)达到治疗房颤的效果。
3.1 神经消融
3.1.1 GP消融
如上所述,心房表面GP不仅是中枢神经系统通向心脏的中继站,还可以通过“心-心反射”机制在房颤的发生和维持过程中发挥着重要的作用。Po等通过大体动物研究发现GP消融可以抑制心房和肺静脉的局灶快速电激动(rapid firing)19,减少或消除心房碎裂电位18,逆转和阻止快速起搏诱发的心房急性电重构17,从而达到抑制房颤的效果。他们还发现消融肺静脉与主动脉之间的第三脂肪垫可以显著抑制上腔静脉起源的rapid firing21,而且能够改善与睡眠呼吸暂停相关的房颤15。随后Po等22通过高频刺激在房颤患者心内膜标记出四个主要的GP(图5)。临床研究23, 24发现单独GP消融术或联合肺静脉电隔离(PVI)能够成功的治疗房颤患者,尤其是对阵发性房颤患者的成功率更高。Katritsis等23在一个随机对照试验中比较了GP消融联合PVI术式与单独PVI术式治疗房颤的效果,结果显示与单独PVI相比联合GP消融能够显著提高手术的成功率。尽管GP消融能够降低房颤术后的复发率,但近来He等25报道的一项研究结果显示与正常心脏相比,对急性心梗犬行GP消融会显著增加室性心律失常的风险。因此,将来的研究需要评估GP消融潜在的致室性心律失常的风险。
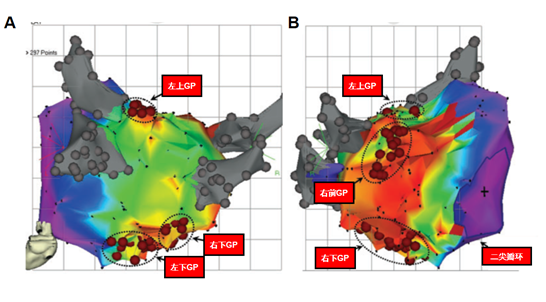
图5 在一例阵发性房颤患者心内膜标记的4个主要GP(源于Po et al. J CardiovascElectrophysiol. 2009, 20:1186-1189)
3.1.2 LSG消融
LSG消融已被证实可以减少长QT综合征患者室速的发生,然而还未有临床研究报道LSG消融对房性心律失常的影响。Tan等11在间断RAP的房颤模型中发现,LSG和迷走神经心支消融可以有效的抑制阵发性房速/房颤的发生。他们还发现同样的术式在起搏诱发的心衰模型上也有类似的抗房性心律失常的效果26。这些发现提示消融外源性CANS可能是治疗房颤的另一个选择。
3.1.3 肾交感神经消融
近几年出现的经皮导管去肾交感神经(renal sympathetic denervation,RDN)治疗顽固性高血压受到国内外同行的重视。SymplicityHTN1-3和其他临床研究初步证明了RDN的有效性和安全性。近来,也有基础和临床研究开始关注RDN对房性心律失常的影响。Linz等27在睡眠呼吸暂停的动物模型中发现,与β受体阻滞剂相比RDN能够更有效的抑制心房ERP的缩短,提示RDN有着更优越的抗房性心律失常的效果。而在快速起搏诱发的房颤动物模型中他们发现RDN可以降低心室率,抑制房颤的发生,但对房颤导致的心房电重构没有改善作用28。Hou等29通过LSG刺激和RAP建立高交感活性的房颤模型,发现RDN可以逆转该模型诱发的心房电生理性质改变,抑制心房的易颤性。一个小样本的临床研究30发现与单独PVI相比,联合RDN可以显著降低房颤患者的血压。而且随访一年结果显示PVI联合RDN的房颤复发率仅为31%,而单独PVI的复发率高达71%。另一个病例报告31发现单独RDN同样可以降低患者血压和阵发性房颤的发作。RDN的这种潜在的抗房性心律失常的机制可能非常复杂。目前的研究提示RDN抗房性心律失常的作用可能与调节心房自主神经活性以及心房的结构重构有关。
3.2 神经刺激
3.2.1 低强度迷走神经刺激
早期研究表明,刺激迷走神经可以引起显著的心脏电生理变化,诱发房颤。然而,近年来的研究13, 14, 32-34显示低于阈电压强度(能引起心率减慢或房室传导阻滞的最低刺激电压)的迷走神经刺激(LL-VNS)能够有效的抑制或逆转房颤的发生。神经活性记录证据13, 14, 33, 34显示LL-VNS的抗房颤作用机制可能与抑制内源性(GP)或外源性(LSG)CANS活性有关(图6)。Yu等经上腔静脉途径32或采用无创的方法刺激迷走神经耳支14同样可以达到LL-VNS。最近的一项临床小样本研究证实低强度耳缘迷走神经刺激在阵发性房颤患者中具有降低炎症因子水平和抗房颤的作用35。这种微创或无创的方法为LL-VNS进一步的临床应用提供了新思路。
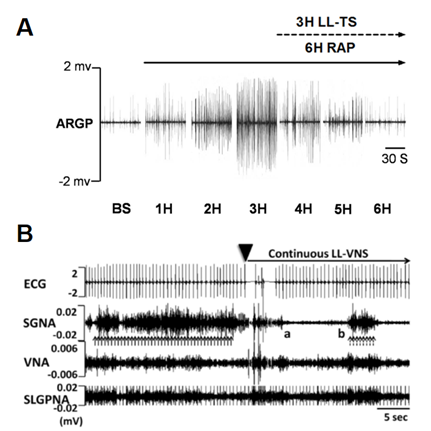
图6 低强度迷走神经刺激(LL-VNS)抑制心脏自主神经活性 A:对迷走神经耳支低强度刺激(LL-TS)能够逆转快速心房起搏(RAP)诱发的右前GP(ARGP)高活性状态(源于Yu et al. Heart Rhythm. 2013, 10:428-435);B:LL-VNS显著抑制星状神经节活性(SGNA)(源于Shen et al. Circulation. 2011, 123:2204-2212)。其他简写同图2。
3.2.2 脊髓神经刺激
脊髓神经刺激(spinal cord stimulation, SCS)目前在临床主要用于治疗各种慢性顽固性疼痛。在心血管领域,临床研究显示T1-T4节段SCS能够缓解顽固性心绞痛的临床症状;动物研究36发现SCS能够稳定心室缺血区局部的电活动,减少心梗后的梗死面积和室性心律失常,改善慢性心梗和心衰的心功能。然而,SCS的这些保护作用的具体机制尚不清楚,但已有证据表明SCS能够降低交感神经活性,而且具有一定的迷走神经样效应(降低心室率,延长房室结传导时间等)37。这些研究提示SCS这种调节自主神经活性的作用对房颤的治疗可能亦有利。我们研究小组近年发现1小时SCS可以显著抑制GP活性,抑制快速电刺激心房或肺静脉所诱发的房颤38。亦有动物研究发现慢性SCS可以延长心房ERP,对快速心房起搏诱发的房颤具有抑制作用39。将来的临床研究可以关注SCS对房性心律失常的影响。
3.2.3 低强度颈动脉窦压力感受器刺激(CBS)
既往研究表明CBS可以调控自主神经活性,而且可以有效的治疗顽固性高血压和心力衰竭。Dai等40研究发现不引起血压和心率变化的低强度CBS(LL-CBS)可以延长心房肌的有效不应期和动作电位时程,抑制快速心房起搏所导致的心房急性电重构。我们研究小组近来也发现LL-CBS可以抑制GP活性,降低AF的诱导性41。
3.2.4 针灸
针灸用于治疗高血压、冠脉疾病、心律失常以及心梗等疾病已有数千年的历史。针灸具有调节自主神经的效应42。比如针刺前臂(内关穴)具有类似迷走神经刺激效应和抗交感效应43。Li等44发现刺激正中传入神经(与内关穴对应)可以改善交感激活引起的心肌缺血。他们推测针灸的治疗作用可能与其抗交感效应以及增强迷走效应有关。近来,一个小范围的临床研究45评估了房颤患者电转复后经针灸治疗的疗效。结果显示与假针灸治疗组或未治疗对照组相比,针灸组房颤复发率明显较低,与胺碘酮治疗组相似。尽管如此,针灸用于临床治疗房颤还需要进一步的机制研究。
4 小结
尽管目前房颤的发生机制仍未完全清楚,但早期研究通过心律变异性分析已经发现交感迷走失衡是房颤一个重要的触发因素,而近几年的自主神经活性记录为自主神经激活参与房颤的发生和维持更是提供了直接证据。通过神经消融或刺激来直接损坏或间接调控自主神经在将来可能成为治疗房颤的一种有效的手段。
参考文献
1. Chiou CW, Eble JN, Zipes DP. Efferent vagal innervation of the canine atria and sinus and atrioventricular nodes. The third fat pad. Circulation. 1997;95:2573-2584
2. Armour JA, Murphy DA, Yuan BX, Macdonald S, Hopkins DA. Gross and microscopic anatomy of the human intrinsic cardiac nervous system. The Anatomical record. 1997;247:289-298
3.Scherlag BJ, Nakagawa H, Jackman WM, Yamanashi WS, Patterson E, Po S, Lazzara R. Electrical stimulation to identify neural elements on the heart: Their role in atrial fibrillation. J Interv Card Electrophysiol. 2005;13 Suppl 1:37-42
4. Coumel P, Attuel P, Lavallee J, Flammang D, Leclercq JF, Slama R. [the atrial arrhythmia syndrome of vagal origin]. Archives des maladies du coeur et des vaisseaux. 1978;71:645-656
5. Dimmer C, Tavernier R, Gjorgov N, Van Nooten G, Clement DL, Jordaens L. Variations of autonomic tone preceding onset of atrial fibrillation after coronary artery bypass grafting. Am J Cardiol. 1998;82:22-25
6. Herweg B, Dalal P, Nagy B, Schweitzer P. Power spectral analysis of heart period variability of preceding sinus rhythm before initiation of paroxysmal atrial fibrillation. Am J Cardiol. 1998;82:869-874
7. Tomita T, Takei M, Saikawa Y, Hanaoka T, Uchikawa S, Tsutsui H, Aruga M, Miyashita T, Yazaki Y, Imamura H, Kinoshita O, Owa M, Kubo K. Role of autonomic tone in the initiation and termination of paroxysmal atrial fibrillation in patients without structural heart disease. J Cardiovasc Electrophysiol. 2003;14:559-564
8. Bettoni M, Zimmermann M. Autonomic tone variations before the onset of paroxysmal atrial fibrillation. Circulation. 2002;105:2753-2759
9. Amar D, Zhang H, Miodownik S, Kadish AH. Competing autonomic mechanisms precede the onset of postoperative atrial fibrillation. JAmCollCardiol. 2003;42:1262-1268
10. de Vos CB, Nieuwlaat R, Crijns HJ, Camm AJ, LeHeuzey JY, Kirchhof CJ, Capucci A, Breithardt G, Vardas PE, Pisters R, Tieleman RG. Autonomic trigger patterns and anti-arrhythmic treatment of paroxysmal atrial fibrillation: Data from the euro heart survey. Euro Heart J. 2008;29:632-639
11. Tan AY, Zhou S, Ogawa M, Song J, Chu M, Li H, Fishbein MC, Lin SF, Chen LS, Chen PS. Neural mechanisms of paroxysmal atrial fibrillation and paroxysmal atrial tachycardia in ambulatory canines. Circulation. 2008;118:916-925
12. Choi EK, Shen MJ, Han S, Kim D, Hwang S, Sayfo S, Piccirillo G, Frick K, Fishbein MC, Hwang C, Lin SF, Chen PS. Intrinsic cardiac nerve activity and paroxysmal atrial tachyarrhythmia in ambulatory dogs. Circulation. 2010;121:2615-2623
13. Yu L, Scherlag BJ, Li S, Sheng X, Lu Z, Nakagawa H, Zhang Y, Jackman WM, Lazzara R, Jiang H, Po SS. Low-level vagosympathetic nerve stimulation inhibits atrial fibrillation inducibility: Direct evidence by neural recordings from intrinsic cardiac ganglia. J Cardiovasc Electrophysiol. 2011;22:455-463
14. Yu L, Scherlag BJ, Li S, Fan Y, Dyer J, Male S, Varma V, Sha Y, Stavrakis S, Po SS. Low-level transcutaneous electrical stimulation of the auricular branch of the vagus nerve: A noninvasive approach to treat the initial phase of atrial fibrillation. Heart Rhythm. 2013;10:428-435
15. Ghias M, Scherlag BJ, Lu Z, Niu G, Moers A, Jackman WM, Lazzara R, Po SS. The role of ganglionated plexi in apnea-related atrial fibrillation. JAmCollCardiol. 2009;54:2075-2083
16. Linz D, Ukena C, Mahfoud F, Neuberger HR, Bohm M. Atrial autonomic innervation: A target for interventional antiarrhythmic therapy? JAmCollCardiol. 2014;63:215-224
17. Lu Z, Scherlag BJ, Lin J, Niu G, Fung KM, Zhao L, Ghias M, Jackman WM, Lazzara R, Jiang H, Po SS. Atrial fibrillation begets atrial fibrillation: Autonomic mechanism for atrial electrical remodeling induced by short-term rapid atrial pacing. Circulation. Arrhythm Electrophysiol. 2008;1:184-192
18. Lu Z, Scherlag BJ, Lin J, Niu G, Ghias M, Jackman WM, Lazzara R, Jiang H, Po SS. Autonomic mechanism for complex fractionated atrial electrograms: Evidence by fast fourier transform analysis. J Cardiovasc Electrophysiol. 2008;19:835-842
19. Lu Z, Scherlag BJ, Lin J, Yu L, Guo JH, Niu G, Jackman WM, Lazzara R, Jiang H, Po SS. Autonomic mechanism for initiation of rapid firing from atria and pulmonary veins: Evidence by ablation of ganglionated plexi. Cardiovasc Res. 2009;84:245-252
20. Scherlag BJ, Hou YL, Lin J, Lu Z, Zacharias S, Dasari T, Niu G, Ghias M, Patterson E, Jackman WM, Lazzara R, Po SS. An acute model for atrial fibrillation arising from a peripheral atrial site: Evidence for primary and secondary triggers. J Cardiovasc Electrophysiol. 2008;19:519-527
21. Lu Z, Scherlag BJ, Niu G, Lin J, Fung KM, Zhao L, Yu L, Jackman WM, Lazzara R, Jiang H, Po SS. Functional properties of the superior vena cava (svc)-aorta ganglionated plexus: Evidence suggesting an autonomic basis for rapid svc firing. J Cardiovasc Electrophysiol. 2010;21:1392-1399
22. Po SS, Nakagawa H, Jackman WM. Localization of left atrial ganglionated plexi in patients with atrial fibrillation. J Cardiovasc Electrophysiol. 2009;20:1186-1189
23. Katritsis DG, Giazitzoglou E, Zografos T, Pokushalov E, Po SS, Camm AJ. Rapid pulmonary vein isolation combined with autonomic ganglia modification: A randomized study. Heart Rhythm. 2011;8:672-678
24. Pokushalov E, Romanov A, Shugayev P, Artyomenko S, Shirokova N, Turov A, Katritsis DG. Selective ganglionated plexi ablation for paroxysmal atrial fibrillation. Heart Rhythm. 2009;6:1257-1264
25. He B, Lu Z, He W, Wu L, Cui B, Hu X, Yu L, Huang C, Jiang H. Effects of ganglionated plexi ablation on ventricular electrophysiological properties in normal hearts and after acute myocardial ischemia. Int J Cardiol. 2013;168:86-93
26. Ogawa M, Tan AY, Song J, Kobayashi K, Fishbein MC, Lin SF, Chen LS, Chen PS. Cryoablation of stellate ganglia and atrial arrhythmia in ambulatory dogs with pacing-induced heart failure. Heart Rhythm. 2009;6:1772-1779
27. Linz D, Mahfoud F, Schotten U, Ukena C, Neuberger HR, Wirth K, Bohm M. Renal sympathetic denervation suppresses postapneic blood pressure rises and atrial fibrillation in a model for sleep apnea. Hypertension. 2012;60:172-178
28. Linz D, Mahfoud F, Schotten U, Ukena C, Hohl M, Neuberger HR, Wirth K, Bohm M. Renal sympathetic denervation provides ventricular rate control but does not prevent atrial electrical remodeling during atrial fibrillation. Hypertension. 2013;61:225-231
29. Hou Y, Hu J, Po SS, Wang H, Zhang L, Zhang F, Wang K, Zhou Q. Catheter-based renal sympathetic denervation significantly inhibits atrial fibrillation induced by electrical stimulation of the left stellate ganglion and rapid atrial pacing. PloS one. 2013;8:e78218
30. Pokushalov E, Romanov A, Corbucci G, Artyomenko S, Baranova V, Turov A, Shirokova N, Karaskov A, Mittal S, Steinberg JS. A randomized comparison of pulmonary vein isolation with versus without concomitant renal artery denervation in patients with refractory symptomatic atrial fibrillation and resistant hypertension. JAmColl Cardiol. 2012;60:1163-1170
31. Vollmann D, Sossalla S, Schroeter MR, Zabel M. Renal artery ablation instead of pulmonary vein ablation in a hypertensive patient with symptomatic, drug-resistant, persistent atrial fibrillation. Clin Res Cardiol. 2013;102:315-318
32. Yu L, Scherlag BJ, Sha Y, Li S, Sharma T, Nakagawa H, Jackman WM, Lazzara R, Jiang H, Po SS. Interactions between atrial electrical remodeling and autonomic remodeling: How to break the vicious cycle. Heart Rhythm. 2012;9:804-809
33. Sha Y, Scherlag BJ, Yu L, Sheng X, Jackman WM, Lazzara R, Po SS. Low-level right vagal stimulation: Anticholinergic and antiadrenergic effects. J Cardiovasc Electrophysiol. 2011;22:1147-1153
34. Shen MJ, Shinohara T, Park HW, Frick K, Ice DS, Choi EK, Han S, Maruyama M, Sharma R, Shen C, Fishbein MC, Chen LS, Lopshire JC, Zipes DP, Lin SF, Chen PS. Continuous low-level vagus nerve stimulation reduces stellate ganglion nerve activity and paroxysmal atrial tachyarrhythmias in ambulatory canines. Circulation. 2011;123:2204-2212
35. Stavrakis S, Humphrey M, Scherlag B, Hu Y, Jackman W, Nakagawa H, Lockwood D, Lazzara R, Po SS. Low-level transcutaneous electrical vagus nerve stimulation suppresses atrial fibrillation. J Am Coll Cardiol. 2015;65:867-75.
36. Lopshire JC, Zhou X, Dusa C, Ueyama T, Rosenberger J, Courtney N, Ujhelyi M, Mullen T, Das M, Zipes DP. Spinal cord stimulation improves ventricular function and reduces ventricular arrhythmias in a canine postinfarction heart failure model. Circulation. 2009;120:286-294
37. Olgin JE, Takahashi T, Wilson E, Vereckei A, Steinberg H, Zipes DP. Effects of thoracic spinal cord stimulation on cardiac autonomic regulation of the sinus and atrioventricular nodes. J Cardiovasc Electrophysiol. 2002;13:475-481
38. Yu L, Huang B, He W, Wang S, Liao K, Zhou X, He B, Lu Z, Jiang H. Spinal cord stimulation suppresses focal rapid firing-induced atrial fibrillation by inhibiting atrial ganglionated plexus activity. J Cardiovasc Pharmacol. 2015;64:554-9
39. Bernstein SA, Wong B, Vasquez C, Rosenberg SP, Rooke R, Kuznekoff LM, Lader JM, Mahoney VM, Budylin T, Alvstrand M, Rakowski-Anderson T, Bharmi R, Shah R, Fowler S, Holmes D, Farazi TG, Chinitz LA, Morley GE. Spinal cord stimulation protects against atrial fibrillation induced by tachypacing. Heart Rhythm. 2012;9:1426-1433 e1423
40. Dai M, Bao M, Liao J, Yu L, Tang Y, Huang H, Wang X, Huang C. Effects of low-level carotid baroreflex stimulation on atrial electrophysiology. J Interv Card Electrophysiol. 2015
41. Liao K, Yu L, Zhou X, Saren G, Wang S, Wang Z, Huang B, Yang K, Jiang H. Low-level baroreceptor stimulation suppresses atrial fibrillation by inhibiting ganglionated plexus activity. Can J Cardiol. 2015;31:767-74
42. Carpenter RJ, Dillard J, Zion AS, Gates GJ, Bartels MN, Downey JA, De Meersman RE. The acute effects of acupuncture upon autonomic balance in healthy subjects. Am J Chin Med. 2010;38:839-847
43. Huang ST, Chen GY, Lo HM, Lin JG, Lee YS, Kuo CD. Increase in the vagal modulation by acupuncture at neiguan point in the healthy subjects. Am J Chin Med. 2005;33:157-164
44. Li P, Pitsillides KF, Rendig SV, Pan HL, Longhurst JC. Reversal of reflex-induced myocardial ischemia by median nerve stimulation: A feline model of electroacupuncture. Circulation. 1998;97:1186-1194
45. Lomuscio A, Belletti S, Battezzati PM, Lombardi F. Efficacy of acupuncture in preventing atrial fibrillation recurrences after electrical cardioversion. J Cardiovasc Electrophysiol. 2011;22:241-247
阅读数: 3576
1 心脏自主神经系统解剖概述
心脏自主神经系统(CANS)主要由外源性CANS和内源性CANS所构成。连接大脑与心脏表面神经丛(GP)之间的神经纤维构成外源性CANS;而位于心房表面、大血管附近的GP以及连接这些GP的神经纤维构成了内源性CANS。
1.1 外源性CANS
外源性CANS由交感成分和副交感成分组成(图1A)。交感神经起源于下丘脑后外侧,发出节前纤维并终止于颈上、颈胸(星状)、和胸神经节。副交感神经起源于延髓内测,由迷走神经干、迷走神经丛和迷走神经节后神经元组成。大部分迷走神经纤维都会在上腔静脉和主动脉之间的脂肪垫(即第三脂肪垫)聚集,支配窦房结和房室结1。
1.2 内源性CANS
双侧心脏自主神经在支配心房前,常会在心房表面一定位置聚集,形成GP。Armour等2发现心脏有多个主要的GP,分布于心脏和大血管附近,组成了一个复杂的神经网络。Scherlag等3按照解剖位置总结了4个主要GP(图1B):(1)右前GP,位于右上肺静脉与右心房连接处,主要支配窦房结及周围心房的活动;(2)右下GP,位于下腔静脉与心房的连接处,主要支配房室结及周围心房的活动;(3)左上GP,位于左上肺静脉与左房连接处;(4)左下GP,位于左下肺静脉与左房的连接处。

图1 心脏自主神经系统(CANS)解剖概述A:外源性CANS(源于Shen et al. Nat Rev Cardiol. 2011, 9(1): 30-9);B:内源性CANS。SVC:上腔静脉;RA:右心房;RAA:右心耳;LSPV:左上肺静脉; LIPV:左下肺静脉;LOM:Marshall韧带;LAA:左心耳。
2 自主神经系统与房颤
早在1978年,Coumel等4就提出自主神经系统激活在阵发性房颤的发生中起着重要的作用。他们发现心脏结构正常的年轻房颤患者主要伴有迷走神经激活的表现,而合并器质性心脏病的房颤患者主要伴有交感神经激活的表现。这一发现后来通过分析心率变异性得到进一步证实。随后,在体神经活性记录被广泛用于房颤的机制研究,为自主神经激活参与房颤提供了直接证据。
2.2 自主神经激活参与房颤的间接证据——心率变异性分析
上世纪末,大量的临床研究对房颤患者进行了心率变异性分析。研究发现手术后出现阵发性房颤的患者在房颤发生前常会伴有交感活性的增加或者迷走活性的降低5;孤立性和夜间发生房颤的年轻患者主要表现为迷走活性的增加6。然而,进一步研究6-9提示房颤的发生不是单独迷走激活或者单独交感激活所致,而是与迷走交感的失衡有关。一项源于欧洲心脏调查的研究10共纳入1500例阵发性房颤患者,该研究根据房颤触发因素将其分为交感性、迷走性和混合性(兼有迷走和交感)房颤。
然而,这些研究大多是对患者的长程心电图进行心率变异性分析所得出的结论,不能直接的反应自主神经活性。再者,心率变异性分析需要完好的窦房结来协调心脏对自主神经活性的反应。慢性心力衰竭(简称心衰)多伴有窦房结功能障碍,心率变异性分析的结果就无法准确的评估交感神经活性。同样,对于伴有窦房结功能障碍的房颤患者,心率变异性分析的应用也受到限制。因此,直接神经活性记录对房颤自主神经机制研究显得十分重要。
2.2 自主神经激活参与房颤的直接证据——神经活性记录
为了证明自主神经激活是房颤的一个触发因素,Tan等11对犬心房进行间断快速起搏并在每次起搏停止后利用无线发射装置同时记录体表心电图、左侧星状神经节(LSG)和左侧迷走神经的神经活性,实验持续数周。该研究发现交感、迷走的同时放电是阵发性房速/房颤最常见的触发因素(图2A)。后来,Choi等12用同样的方法同时记录了包括LSG、左侧迷走神经以及内源性自主神经(左上GP和Marshall韧带)的活性。结果显示左上GP和Marshall韧带是阵发性房速/房颤最常见的触发因素(图2B)。Po教授研究小组通过对右前GP和左上GP高频电刺激诱发内源性CANS高活性状态,结果显著缩短了心房有效不应期(ERP),增加了ERP的离散度,提示内源性CANS激活能够导致心房电重构,增加心房的易颤性13。他们还在快速心房起搏(RAP)14和睡眠呼吸暂停15相关的急性房颤模型中进一步证实GP高活性是房颤主要的触发因素。这些研究共同为自主神经激活参与房颤的发生和维持提供了直接证据。

图2自主神经激活触发房性心律失常 A:交感(蓝色箭头)、迷走(绿色箭头)同时激活触发房性心动过速转为房颤(源于Tan et al. Circulation. 2008, 118: 918-925);B:在一次房性心动过速发生前,内源性心脏自主神经(左上GP和Marshall韧带,红色箭头)激活先于外源性心脏自主神经(星状神经节和迷走神经)激活,提示内源性自主神经激活是房速的主要触发因素(源于Choi et al. Circulation. 2010, 121:2615-2623)。右下角放大图显示窦性心律失常(1)和房性心律失常(2)时P波形态不同。Left atrium:左房;LOMNA:Marshall韧带活性;SLGPNA:左上GP活性;SGNA:星状神经节活性;VNA:迷走神经活性。
2.3 自主神经激活参与房颤的机制
自主神经激活通过复杂的机制参与房颤的发生和维持。最近,Linz等16将自主神经激活参与房颤的机制总结成三个环路:电环路、触发环路和结构环路(见图3)。交感神经激活引起交感神经元末梢释放去甲肾上腺素,作用于β肾上腺素能受体,激活心肌膜上的钙通通,使钙离子内流增加,细胞内肌浆网释放的钙离子也增加,导致心房异位(触发环路)。迷走神经激活诱发心肌膜上离子电流的变化,缩短心房ERP和动作电位时程,促进折返电路形成(电环路)。充血性心衰,高血压或睡眠呼吸暂停等引起心房牵张,激活众多纤维化通路,导致心房结构改变和传导异常,同样促进折返电路形成(结构环路)。三个环路互相促进,形成正反馈加强这些病理生理变化,最终促进房颤的发生和维持。

图3 自主神经激活参与房颤的机制(源于Linz et al. J Am CollCardiol. 2014, 63:215-24)
2.4 “心-心反射”与房颤
传统的观点认为,心房表面GP不过是中枢神经系统通向心脏的中继站。然而,近来Lu等17-19研究发现GP不仅仅是上传下达的中继站,还是心脏局部反射网络中的核心。当心脏局部的自主神经末梢兴奋时,刺激信号经传入纤维激活GP,GP兴奋后又通过传出纤维释放大量的神经递质(乙酰胆碱和去甲肾上腺素)到邻近的肺静脉、心房和远端的心耳,后三者再将兴奋信号传回GP,这种快速的神经传导最终导致GP充分激活,临近的肺静脉在GP的驱使成为触发和驱动房颤最活跃的因素。因此,心脏局部神经兴奋能在短时间内通过快速的神经传导使GP充分激活,这种神经传导模式被称为“心-心反射”(cardio-cardiac reflex,图4)。Lu等19和Scherlag等20通过一系列的实验研究发现心-心反射在房颤的发生和维持机制中起着重要的作用。

图4 心-心反射(Cardio-Cardiac Reflex)示意图(源于鲁志兵,江洪.中华心律失常学杂志.2011,15:70-3) Afferent:传入神经;Efferent:传出神经;Atrium:心房;GanglionatedPlexi:心房自主神经节;PV:肺静脉。
3 自主神经干预治疗房颤
1998年,Haissaguerre等首次提出用肺静脉电隔离治疗房颤,大量临床研究已经证实这一术式对大部分房颤有效,然而部分患者需要进行2~3次甚至更多次消融,增加肺静脉狭窄的风险。近年来,越来越多的基础和临床研究发现可以通过自主神经干预(消融或刺激)达到治疗房颤的效果。
3.1 神经消融
3.1.1 GP消融
如上所述,心房表面GP不仅是中枢神经系统通向心脏的中继站,还可以通过“心-心反射”机制在房颤的发生和维持过程中发挥着重要的作用。Po等通过大体动物研究发现GP消融可以抑制心房和肺静脉的局灶快速电激动(rapid firing)19,减少或消除心房碎裂电位18,逆转和阻止快速起搏诱发的心房急性电重构17,从而达到抑制房颤的效果。他们还发现消融肺静脉与主动脉之间的第三脂肪垫可以显著抑制上腔静脉起源的rapid firing21,而且能够改善与睡眠呼吸暂停相关的房颤15。随后Po等22通过高频刺激在房颤患者心内膜标记出四个主要的GP(图5)。临床研究23, 24发现单独GP消融术或联合肺静脉电隔离(PVI)能够成功的治疗房颤患者,尤其是对阵发性房颤患者的成功率更高。Katritsis等23在一个随机对照试验中比较了GP消融联合PVI术式与单独PVI术式治疗房颤的效果,结果显示与单独PVI相比联合GP消融能够显著提高手术的成功率。尽管GP消融能够降低房颤术后的复发率,但近来He等25报道的一项研究结果显示与正常心脏相比,对急性心梗犬行GP消融会显著增加室性心律失常的风险。因此,将来的研究需要评估GP消融潜在的致室性心律失常的风险。

图5 在一例阵发性房颤患者心内膜标记的4个主要GP(源于Po et al. J CardiovascElectrophysiol. 2009, 20:1186-1189)
3.1.2 LSG消融
LSG消融已被证实可以减少长QT综合征患者室速的发生,然而还未有临床研究报道LSG消融对房性心律失常的影响。Tan等11在间断RAP的房颤模型中发现,LSG和迷走神经心支消融可以有效的抑制阵发性房速/房颤的发生。他们还发现同样的术式在起搏诱发的心衰模型上也有类似的抗房性心律失常的效果26。这些发现提示消融外源性CANS可能是治疗房颤的另一个选择。
3.1.3 肾交感神经消融
近几年出现的经皮导管去肾交感神经(renal sympathetic denervation,RDN)治疗顽固性高血压受到国内外同行的重视。SymplicityHTN1-3和其他临床研究初步证明了RDN的有效性和安全性。近来,也有基础和临床研究开始关注RDN对房性心律失常的影响。Linz等27在睡眠呼吸暂停的动物模型中发现,与β受体阻滞剂相比RDN能够更有效的抑制心房ERP的缩短,提示RDN有着更优越的抗房性心律失常的效果。而在快速起搏诱发的房颤动物模型中他们发现RDN可以降低心室率,抑制房颤的发生,但对房颤导致的心房电重构没有改善作用28。Hou等29通过LSG刺激和RAP建立高交感活性的房颤模型,发现RDN可以逆转该模型诱发的心房电生理性质改变,抑制心房的易颤性。一个小样本的临床研究30发现与单独PVI相比,联合RDN可以显著降低房颤患者的血压。而且随访一年结果显示PVI联合RDN的房颤复发率仅为31%,而单独PVI的复发率高达71%。另一个病例报告31发现单独RDN同样可以降低患者血压和阵发性房颤的发作。RDN的这种潜在的抗房性心律失常的机制可能非常复杂。目前的研究提示RDN抗房性心律失常的作用可能与调节心房自主神经活性以及心房的结构重构有关。
3.2 神经刺激
3.2.1 低强度迷走神经刺激
早期研究表明,刺激迷走神经可以引起显著的心脏电生理变化,诱发房颤。然而,近年来的研究13, 14, 32-34显示低于阈电压强度(能引起心率减慢或房室传导阻滞的最低刺激电压)的迷走神经刺激(LL-VNS)能够有效的抑制或逆转房颤的发生。神经活性记录证据13, 14, 33, 34显示LL-VNS的抗房颤作用机制可能与抑制内源性(GP)或外源性(LSG)CANS活性有关(图6)。Yu等经上腔静脉途径32或采用无创的方法刺激迷走神经耳支14同样可以达到LL-VNS。最近的一项临床小样本研究证实低强度耳缘迷走神经刺激在阵发性房颤患者中具有降低炎症因子水平和抗房颤的作用35。这种微创或无创的方法为LL-VNS进一步的临床应用提供了新思路。

图6 低强度迷走神经刺激(LL-VNS)抑制心脏自主神经活性 A:对迷走神经耳支低强度刺激(LL-TS)能够逆转快速心房起搏(RAP)诱发的右前GP(ARGP)高活性状态(源于Yu et al. Heart Rhythm. 2013, 10:428-435);B:LL-VNS显著抑制星状神经节活性(SGNA)(源于Shen et al. Circulation. 2011, 123:2204-2212)。其他简写同图2。
3.2.2 脊髓神经刺激
脊髓神经刺激(spinal cord stimulation, SCS)目前在临床主要用于治疗各种慢性顽固性疼痛。在心血管领域,临床研究显示T1-T4节段SCS能够缓解顽固性心绞痛的临床症状;动物研究36发现SCS能够稳定心室缺血区局部的电活动,减少心梗后的梗死面积和室性心律失常,改善慢性心梗和心衰的心功能。然而,SCS的这些保护作用的具体机制尚不清楚,但已有证据表明SCS能够降低交感神经活性,而且具有一定的迷走神经样效应(降低心室率,延长房室结传导时间等)37。这些研究提示SCS这种调节自主神经活性的作用对房颤的治疗可能亦有利。我们研究小组近年发现1小时SCS可以显著抑制GP活性,抑制快速电刺激心房或肺静脉所诱发的房颤38。亦有动物研究发现慢性SCS可以延长心房ERP,对快速心房起搏诱发的房颤具有抑制作用39。将来的临床研究可以关注SCS对房性心律失常的影响。
3.2.3 低强度颈动脉窦压力感受器刺激(CBS)
既往研究表明CBS可以调控自主神经活性,而且可以有效的治疗顽固性高血压和心力衰竭。Dai等40研究发现不引起血压和心率变化的低强度CBS(LL-CBS)可以延长心房肌的有效不应期和动作电位时程,抑制快速心房起搏所导致的心房急性电重构。我们研究小组近来也发现LL-CBS可以抑制GP活性,降低AF的诱导性41。
3.2.4 针灸
针灸用于治疗高血压、冠脉疾病、心律失常以及心梗等疾病已有数千年的历史。针灸具有调节自主神经的效应42。比如针刺前臂(内关穴)具有类似迷走神经刺激效应和抗交感效应43。Li等44发现刺激正中传入神经(与内关穴对应)可以改善交感激活引起的心肌缺血。他们推测针灸的治疗作用可能与其抗交感效应以及增强迷走效应有关。近来,一个小范围的临床研究45评估了房颤患者电转复后经针灸治疗的疗效。结果显示与假针灸治疗组或未治疗对照组相比,针灸组房颤复发率明显较低,与胺碘酮治疗组相似。尽管如此,针灸用于临床治疗房颤还需要进一步的机制研究。
4 小结
尽管目前房颤的发生机制仍未完全清楚,但早期研究通过心律变异性分析已经发现交感迷走失衡是房颤一个重要的触发因素,而近几年的自主神经活性记录为自主神经激活参与房颤的发生和维持更是提供了直接证据。通过神经消融或刺激来直接损坏或间接调控自主神经在将来可能成为治疗房颤的一种有效的手段。
参考文献
1. Chiou CW, Eble JN, Zipes DP. Efferent vagal innervation of the canine atria and sinus and atrioventricular nodes. The third fat pad. Circulation. 1997;95:2573-2584
2. Armour JA, Murphy DA, Yuan BX, Macdonald S, Hopkins DA. Gross and microscopic anatomy of the human intrinsic cardiac nervous system. The Anatomical record. 1997;247:289-298
3.Scherlag BJ, Nakagawa H, Jackman WM, Yamanashi WS, Patterson E, Po S, Lazzara R. Electrical stimulation to identify neural elements on the heart: Their role in atrial fibrillation. J Interv Card Electrophysiol. 2005;13 Suppl 1:37-42
4. Coumel P, Attuel P, Lavallee J, Flammang D, Leclercq JF, Slama R. [the atrial arrhythmia syndrome of vagal origin]. Archives des maladies du coeur et des vaisseaux. 1978;71:645-656
5. Dimmer C, Tavernier R, Gjorgov N, Van Nooten G, Clement DL, Jordaens L. Variations of autonomic tone preceding onset of atrial fibrillation after coronary artery bypass grafting. Am J Cardiol. 1998;82:22-25
6. Herweg B, Dalal P, Nagy B, Schweitzer P. Power spectral analysis of heart period variability of preceding sinus rhythm before initiation of paroxysmal atrial fibrillation. Am J Cardiol. 1998;82:869-874
7. Tomita T, Takei M, Saikawa Y, Hanaoka T, Uchikawa S, Tsutsui H, Aruga M, Miyashita T, Yazaki Y, Imamura H, Kinoshita O, Owa M, Kubo K. Role of autonomic tone in the initiation and termination of paroxysmal atrial fibrillation in patients without structural heart disease. J Cardiovasc Electrophysiol. 2003;14:559-564
8. Bettoni M, Zimmermann M. Autonomic tone variations before the onset of paroxysmal atrial fibrillation. Circulation. 2002;105:2753-2759
9. Amar D, Zhang H, Miodownik S, Kadish AH. Competing autonomic mechanisms precede the onset of postoperative atrial fibrillation. JAmCollCardiol. 2003;42:1262-1268
10. de Vos CB, Nieuwlaat R, Crijns HJ, Camm AJ, LeHeuzey JY, Kirchhof CJ, Capucci A, Breithardt G, Vardas PE, Pisters R, Tieleman RG. Autonomic trigger patterns and anti-arrhythmic treatment of paroxysmal atrial fibrillation: Data from the euro heart survey. Euro Heart J. 2008;29:632-639
11. Tan AY, Zhou S, Ogawa M, Song J, Chu M, Li H, Fishbein MC, Lin SF, Chen LS, Chen PS. Neural mechanisms of paroxysmal atrial fibrillation and paroxysmal atrial tachycardia in ambulatory canines. Circulation. 2008;118:916-925
12. Choi EK, Shen MJ, Han S, Kim D, Hwang S, Sayfo S, Piccirillo G, Frick K, Fishbein MC, Hwang C, Lin SF, Chen PS. Intrinsic cardiac nerve activity and paroxysmal atrial tachyarrhythmia in ambulatory dogs. Circulation. 2010;121:2615-2623
13. Yu L, Scherlag BJ, Li S, Sheng X, Lu Z, Nakagawa H, Zhang Y, Jackman WM, Lazzara R, Jiang H, Po SS. Low-level vagosympathetic nerve stimulation inhibits atrial fibrillation inducibility: Direct evidence by neural recordings from intrinsic cardiac ganglia. J Cardiovasc Electrophysiol. 2011;22:455-463
14. Yu L, Scherlag BJ, Li S, Fan Y, Dyer J, Male S, Varma V, Sha Y, Stavrakis S, Po SS. Low-level transcutaneous electrical stimulation of the auricular branch of the vagus nerve: A noninvasive approach to treat the initial phase of atrial fibrillation. Heart Rhythm. 2013;10:428-435
15. Ghias M, Scherlag BJ, Lu Z, Niu G, Moers A, Jackman WM, Lazzara R, Po SS. The role of ganglionated plexi in apnea-related atrial fibrillation. JAmCollCardiol. 2009;54:2075-2083
16. Linz D, Ukena C, Mahfoud F, Neuberger HR, Bohm M. Atrial autonomic innervation: A target for interventional antiarrhythmic therapy? JAmCollCardiol. 2014;63:215-224
17. Lu Z, Scherlag BJ, Lin J, Niu G, Fung KM, Zhao L, Ghias M, Jackman WM, Lazzara R, Jiang H, Po SS. Atrial fibrillation begets atrial fibrillation: Autonomic mechanism for atrial electrical remodeling induced by short-term rapid atrial pacing. Circulation. Arrhythm Electrophysiol. 2008;1:184-192
18. Lu Z, Scherlag BJ, Lin J, Niu G, Ghias M, Jackman WM, Lazzara R, Jiang H, Po SS. Autonomic mechanism for complex fractionated atrial electrograms: Evidence by fast fourier transform analysis. J Cardiovasc Electrophysiol. 2008;19:835-842
19. Lu Z, Scherlag BJ, Lin J, Yu L, Guo JH, Niu G, Jackman WM, Lazzara R, Jiang H, Po SS. Autonomic mechanism for initiation of rapid firing from atria and pulmonary veins: Evidence by ablation of ganglionated plexi. Cardiovasc Res. 2009;84:245-252
20. Scherlag BJ, Hou YL, Lin J, Lu Z, Zacharias S, Dasari T, Niu G, Ghias M, Patterson E, Jackman WM, Lazzara R, Po SS. An acute model for atrial fibrillation arising from a peripheral atrial site: Evidence for primary and secondary triggers. J Cardiovasc Electrophysiol. 2008;19:519-527
21. Lu Z, Scherlag BJ, Niu G, Lin J, Fung KM, Zhao L, Yu L, Jackman WM, Lazzara R, Jiang H, Po SS. Functional properties of the superior vena cava (svc)-aorta ganglionated plexus: Evidence suggesting an autonomic basis for rapid svc firing. J Cardiovasc Electrophysiol. 2010;21:1392-1399
22. Po SS, Nakagawa H, Jackman WM. Localization of left atrial ganglionated plexi in patients with atrial fibrillation. J Cardiovasc Electrophysiol. 2009;20:1186-1189
23. Katritsis DG, Giazitzoglou E, Zografos T, Pokushalov E, Po SS, Camm AJ. Rapid pulmonary vein isolation combined with autonomic ganglia modification: A randomized study. Heart Rhythm. 2011;8:672-678
24. Pokushalov E, Romanov A, Shugayev P, Artyomenko S, Shirokova N, Turov A, Katritsis DG. Selective ganglionated plexi ablation for paroxysmal atrial fibrillation. Heart Rhythm. 2009;6:1257-1264
25. He B, Lu Z, He W, Wu L, Cui B, Hu X, Yu L, Huang C, Jiang H. Effects of ganglionated plexi ablation on ventricular electrophysiological properties in normal hearts and after acute myocardial ischemia. Int J Cardiol. 2013;168:86-93
26. Ogawa M, Tan AY, Song J, Kobayashi K, Fishbein MC, Lin SF, Chen LS, Chen PS. Cryoablation of stellate ganglia and atrial arrhythmia in ambulatory dogs with pacing-induced heart failure. Heart Rhythm. 2009;6:1772-1779
27. Linz D, Mahfoud F, Schotten U, Ukena C, Neuberger HR, Wirth K, Bohm M. Renal sympathetic denervation suppresses postapneic blood pressure rises and atrial fibrillation in a model for sleep apnea. Hypertension. 2012;60:172-178
28. Linz D, Mahfoud F, Schotten U, Ukena C, Hohl M, Neuberger HR, Wirth K, Bohm M. Renal sympathetic denervation provides ventricular rate control but does not prevent atrial electrical remodeling during atrial fibrillation. Hypertension. 2013;61:225-231
29. Hou Y, Hu J, Po SS, Wang H, Zhang L, Zhang F, Wang K, Zhou Q. Catheter-based renal sympathetic denervation significantly inhibits atrial fibrillation induced by electrical stimulation of the left stellate ganglion and rapid atrial pacing. PloS one. 2013;8:e78218
30. Pokushalov E, Romanov A, Corbucci G, Artyomenko S, Baranova V, Turov A, Shirokova N, Karaskov A, Mittal S, Steinberg JS. A randomized comparison of pulmonary vein isolation with versus without concomitant renal artery denervation in patients with refractory symptomatic atrial fibrillation and resistant hypertension. JAmColl Cardiol. 2012;60:1163-1170
31. Vollmann D, Sossalla S, Schroeter MR, Zabel M. Renal artery ablation instead of pulmonary vein ablation in a hypertensive patient with symptomatic, drug-resistant, persistent atrial fibrillation. Clin Res Cardiol. 2013;102:315-318
32. Yu L, Scherlag BJ, Sha Y, Li S, Sharma T, Nakagawa H, Jackman WM, Lazzara R, Jiang H, Po SS. Interactions between atrial electrical remodeling and autonomic remodeling: How to break the vicious cycle. Heart Rhythm. 2012;9:804-809
33. Sha Y, Scherlag BJ, Yu L, Sheng X, Jackman WM, Lazzara R, Po SS. Low-level right vagal stimulation: Anticholinergic and antiadrenergic effects. J Cardiovasc Electrophysiol. 2011;22:1147-1153
34. Shen MJ, Shinohara T, Park HW, Frick K, Ice DS, Choi EK, Han S, Maruyama M, Sharma R, Shen C, Fishbein MC, Chen LS, Lopshire JC, Zipes DP, Lin SF, Chen PS. Continuous low-level vagus nerve stimulation reduces stellate ganglion nerve activity and paroxysmal atrial tachyarrhythmias in ambulatory canines. Circulation. 2011;123:2204-2212
35. Stavrakis S, Humphrey M, Scherlag B, Hu Y, Jackman W, Nakagawa H, Lockwood D, Lazzara R, Po SS. Low-level transcutaneous electrical vagus nerve stimulation suppresses atrial fibrillation. J Am Coll Cardiol. 2015;65:867-75.
36. Lopshire JC, Zhou X, Dusa C, Ueyama T, Rosenberger J, Courtney N, Ujhelyi M, Mullen T, Das M, Zipes DP. Spinal cord stimulation improves ventricular function and reduces ventricular arrhythmias in a canine postinfarction heart failure model. Circulation. 2009;120:286-294
37. Olgin JE, Takahashi T, Wilson E, Vereckei A, Steinberg H, Zipes DP. Effects of thoracic spinal cord stimulation on cardiac autonomic regulation of the sinus and atrioventricular nodes. J Cardiovasc Electrophysiol. 2002;13:475-481
38. Yu L, Huang B, He W, Wang S, Liao K, Zhou X, He B, Lu Z, Jiang H. Spinal cord stimulation suppresses focal rapid firing-induced atrial fibrillation by inhibiting atrial ganglionated plexus activity. J Cardiovasc Pharmacol. 2015;64:554-9
39. Bernstein SA, Wong B, Vasquez C, Rosenberg SP, Rooke R, Kuznekoff LM, Lader JM, Mahoney VM, Budylin T, Alvstrand M, Rakowski-Anderson T, Bharmi R, Shah R, Fowler S, Holmes D, Farazi TG, Chinitz LA, Morley GE. Spinal cord stimulation protects against atrial fibrillation induced by tachypacing. Heart Rhythm. 2012;9:1426-1433 e1423
40. Dai M, Bao M, Liao J, Yu L, Tang Y, Huang H, Wang X, Huang C. Effects of low-level carotid baroreflex stimulation on atrial electrophysiology. J Interv Card Electrophysiol. 2015
41. Liao K, Yu L, Zhou X, Saren G, Wang S, Wang Z, Huang B, Yang K, Jiang H. Low-level baroreceptor stimulation suppresses atrial fibrillation by inhibiting ganglionated plexus activity. Can J Cardiol. 2015;31:767-74
42. Carpenter RJ, Dillard J, Zion AS, Gates GJ, Bartels MN, Downey JA, De Meersman RE. The acute effects of acupuncture upon autonomic balance in healthy subjects. Am J Chin Med. 2010;38:839-847
43. Huang ST, Chen GY, Lo HM, Lin JG, Lee YS, Kuo CD. Increase in the vagal modulation by acupuncture at neiguan point in the healthy subjects. Am J Chin Med. 2005;33:157-164
44. Li P, Pitsillides KF, Rendig SV, Pan HL, Longhurst JC. Reversal of reflex-induced myocardial ischemia by median nerve stimulation: A feline model of electroacupuncture. Circulation. 1998;97:1186-1194
45. Lomuscio A, Belletti S, Battezzati PM, Lombardi F. Efficacy of acupuncture in preventing atrial fibrillation recurrences after electrical cardioversion. J Cardiovasc Electrophysiol. 2011;22:241-247