心脏收缩调节器(Cardiac contractility modulation,CCM)是由植入上胸部的CCM刺激仪(Optimizer III,Impulse Dynamics,NY,USA)通过精确的计时间期于心肌细胞的绝对不应期发放高能电信号,它不能引发动作电位,但却能够使心肌细胞的收缩力增强,主要适用于LVEF<35%而不适合植入CRT或CRT术后无反应的慢性中重度心力衰竭患者。迄今为止,全球大约已有1500例患者植入了CCM,已有的临床研究初步证明了CCM的安全性及有效性[1-5],且已在部分欧洲国家用于心衰的临床治疗。本中心最近完成了国内首例CRT-D术后无反应者及首例ICD术后患者中植入CCM,现将其围手术期程控及如何避免器械间的相互干扰详述如下。
1. 病例简介:
病例一:患者,男性,45岁,因“胸闷、心慌7年,加重伴气促3年,CRT-D术后2年”入院,诊断为扩张型心肌病,CRT-D术后,心功能NYHA III级。CRT-D术前心超:左室舒张末内径74 mm,左室收缩末内径67 mm, LVEF 24%,CRT-D术后2年心超:左室舒张末内径77 mm,左室收缩末内径69 mm, LVEF 16%,NT-proBNP 3787 pg/ml。因CRT无反应,本次植入CCM。术前关闭CRT-D除颤功能。术中测试CCM心房电极导线感知4.0 mV,阈值1.0 V,阻抗550欧,心室电极导线RV感知10 mV,阈值1.0 V,阻抗560欧,心室电极导线LS感知8 mV,阈值1.0 V,阻抗480 欧。设置CCM工作的AV间期为105-255ms(患者自身AV间期为180ms),LS感知灵敏度为2.5mV,LS警觉开始为-10ms,警觉宽度为37ms,LS后不应期为40ms。调试时给予100ms延迟、7.5V刺激测试,患者出现明显心悸,减为45ms延迟、5.0V刺激后逐渐耐受。同时CRT-D程控发现心房远场感知了CCM信号,从而启动自动模式转换(AMS)(图1)。将心室后心房空白期(PVAB)由原来的100ms调整为200ms后,CCM信号不再被心房感知(图2)。术后胸片示电极位置良好,无气胸等并发症(图3)。第3天再次予以程控,设置LS感知灵敏度为2.5mV,LS警觉开始为-4ms,警觉宽度为34ms,LS后不应期为40ms。CRT-D和CCM工作正常,未发现相互干扰,患者好转出院。
病例二:患者,男性,35岁,因“活动后胸闷、气促1年余,ICD术后半年”入院,诊断为扩张型心肌病,阵发性室速,ICD术后,心功能NYHA III级。心超示左室舒张末内径60 mm,左室收缩末内径52 mm, LVEF 26%,NT-proBNP 1066 pg/ml。本次入院行CCM植入术。术前关闭ICD除颤功能。术中测试CCM心房电极导线感知3.0 mV,阈值0.8 V,阻抗580欧,心室电极导线RV感知9 mV,阈值0.9 V,阻抗540欧,心室电极导线LS感知8.5 mV,阈值1.0 V,阻抗620欧。设置CCM工作的AV间期为75-225ms(患者自身AV间期为150ms),LS感知灵敏度为0.7mV,LS警觉开始为0ms,警觉宽度为32ms,LS后不应期为40ms。调试时给予CCM序列100ms延迟、7.5V刺激测试,患者出现明显心悸,减为40ms延迟、5.0V刺激后逐渐耐受。同时ICD程控发现CCM序列延迟为100ms时,腔内心电图与原窦性心律模板匹配度为0(图4)。当调整延迟为40ms时,腔内心电图与原窦性心律模板匹配度为100%(图5)。术后胸片示电极位置良好,无气胸等并发症(图6)。术后第3天再次予以程控,设置LS感知灵敏度为1.7mV,LS警觉开始为6ms,警觉宽度为28ms,LS后不应期为40ms。ICD和CCM工作正常,未发现相互干扰,患者好转出院。
图1 PVAB为100ms时CRT-D误将CCM信号感知为心房信号,从而启动自动模式转换(AMS),导致双室起搏(BP)比例下降,出现了较多的自身心律(VS)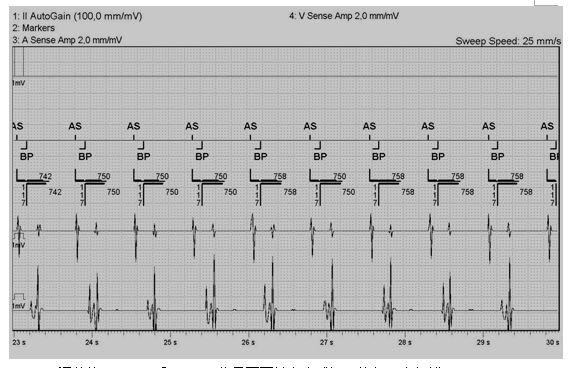
图2 PVAB调整为200ms后,CCM信号不再被心房感知,恢复双室起搏(BP)。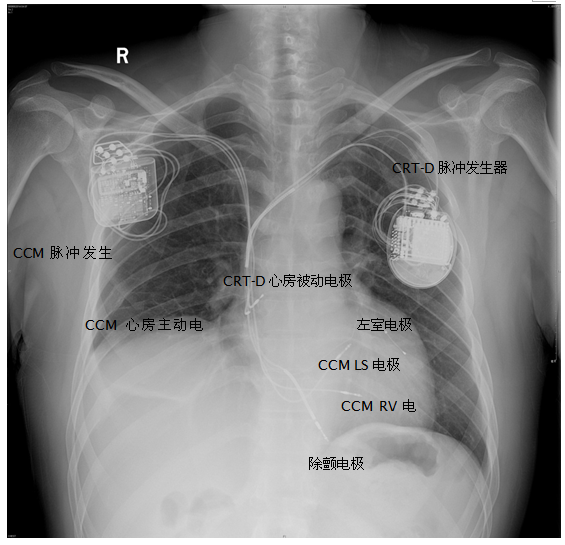
图3 CRT-D及CCM植入患者术后胸片

图4 发放CCM序列刺激脉冲的延迟为100ms时,腔内心电图与原窦性心律模板匹配度为0
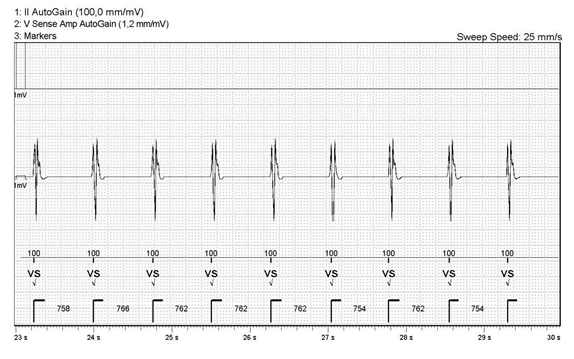
图5 发放CCM序列刺激脉冲的延迟为40ms时,腔内心电图与原窦性心律模板匹配度为100%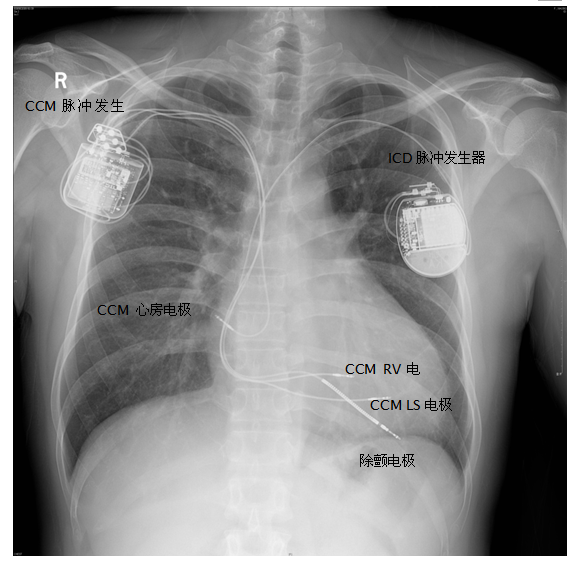
图6 ICD及CCM植入患者术后胸片
讨论:
CCM两根右室间隔部电极的设定:
CCM右室间隔部两根电极导线,一根称为RV,另一根称为LS(local sense),可术中根据测试结果确定哪一根为RV或LS。一般来说,若非起搏依赖,将相对高位的一根电极设为RV,相对低位的设为LS(图6),因为CCM工作时将RV感知到电信号的时间点设为0ms,其后才开始LS感知信号和一系列的计时周期。而起搏依赖或需要心室起搏治疗(如CRT-P/CRT-D)时,由于激动顺序的不同,可将相对低位的电极设为RV,另一根相对高位的设为LS(图3)。
CCM工作的几个重要参数:
CCM工作的AV间期设定:
CCM植入一根心房电极导线和两根心室电极导线(后者要求放置在右室间隔部)。可根据患者的AV间期来设定CCM工作的AV间期,确保在心室的绝对不应期发放CCM脉冲。一般设定CCM工作的AV间期为患者自身AV间期±75ms,当发生心房颤动时,由于此时自身AV间期无法判断,故此时CCM不工作,以防止CCM脉冲落在心室绝对不应期之外而造成不良后果。
LS感知灵敏度、LS警觉宽度、LS后不应期的设定:
将RV感知到电信号的时间点设为0ms,其后开始LS感知信号和一系列的计时周期。主要包括LS警觉开始(-100-+100ms)、LS警觉宽度(3-40ms)、LS后不应期(15-250ms)。具体设定时,应先测试不同的LS感知灵敏度数值,选择LS感知信号均匀且没有分裂、LS宽度>20ms的感知灵敏度数值(图7),LS警觉期开始于LS信号前15ms左右,LS警觉宽度(alert width)至LS感知信号中间左右,LS后不应期必须长于LS信号宽度。此一系列间期的设定均是为了保证CCM高能量脉冲落在心室绝对不应期内。
CCM脉冲的相关参数:
CCM脉冲延迟(CCM delay):即在LS感知后延迟多久发放CCM脉冲,一般术中测试时可用100ms来测试,而常规设定为40ms(图8)。
CCM序列宽度(CCM duration):为5.14ms/脉冲,RV和LS电极各发放2个正负双相的脉冲,因此总的序列宽度为20.56ms(图8)。
CCM输出(CCM amplitude):最大为±7.5V,可根据病人的耐受情况调整,如能耐受,建议调整至最大输出。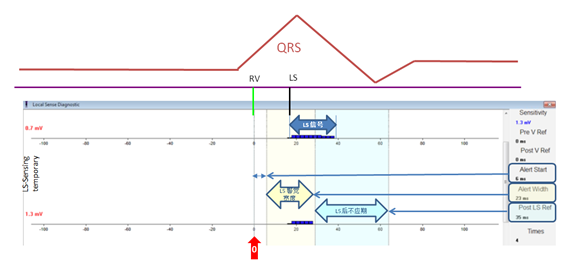
图7 LS感知灵敏度数值、LS警觉宽度、LS后不应期的设定示意图
当LS感知灵敏度设为0.7mV(第一行)时,LS感知信号(深蓝色部分)均匀且没有分裂、持续>20ms;而当LS感知灵敏度设为1.3mV(第二行)时,LS感知信号(深蓝色部分)持续时间短,为10ms左右。此时,应选择LS感知灵敏度为0.7mV。
以RV感知到电信号的时间点设为0ms,LS警觉期开始于LS信号前15ms左右,LS警觉宽度(alert width)至LS感知信号中间左右,LS后不应期必须长于LS信号宽度
2.3 避免CCM与CRT-D或ICD间的互相干扰
对于CCM来说,通过个体化设置每个病人的心房感知及严格的计时周期,从而在心律失常时抑制CCM工作,保证CCM工作的安全性,即仅在心室收缩的绝对不应期发放脉冲。对于ICD来说,术中实时测试腔内心电图和标记通道来确保CCM工作时不造成ICD过感知,这一点非常重要,否则会引起ICD脉冲发生器先后记数正常除极波和后续的CCM脉冲从而导致ICD误判为室速或室颤而发生误治疗。心房或心室远场感知CCM信号可通过调整感知灵敏度或延长不应期来避免[6,7]。而对心动过缓起搏或CRT来说,则需确保CCM不引起对起搏的抑制。本报道中的CRT-D术后患者,因心房电极远场感知了CCM信号,从而造成双倍计数并由此启动了模式转换,这可能与CCM其中一根右室电极位置较高(中位间隔,图3)(靠近ICD的心房电极)且CCM刺激能量较大(2个脉冲,每个脉冲能量相当于普通起搏能量的100倍左右)有关。CRT-D一旦启动AMS,转换后的起搏模式决定了心室将不会再跟踪心房自身除极波,从而导致CRT不能正常工作,应避免。我们通过延长心室后心房空白期(PVAB),远场感知消失。而另一个ICD术后患者,术中调试发放CCM脉冲的延迟为100ms时,腔内心电图与原窦性心律模板匹配度为0,而调整为40ms时,腔内心电图与原窦性心律模板匹配度为100%,提示过度延迟发放CCM信号可能会部分落在心室绝对不应期后的相对不应期内(因CCM刺激脉宽为20ms左右)(图8),尤其是对窄QRS波的ICD植入患者,从而可能造成ICD误判。此时,若调整CCM序列延迟时间仍不能解决,则可相应调整ICD的心室后空白期(PVB)(图8)。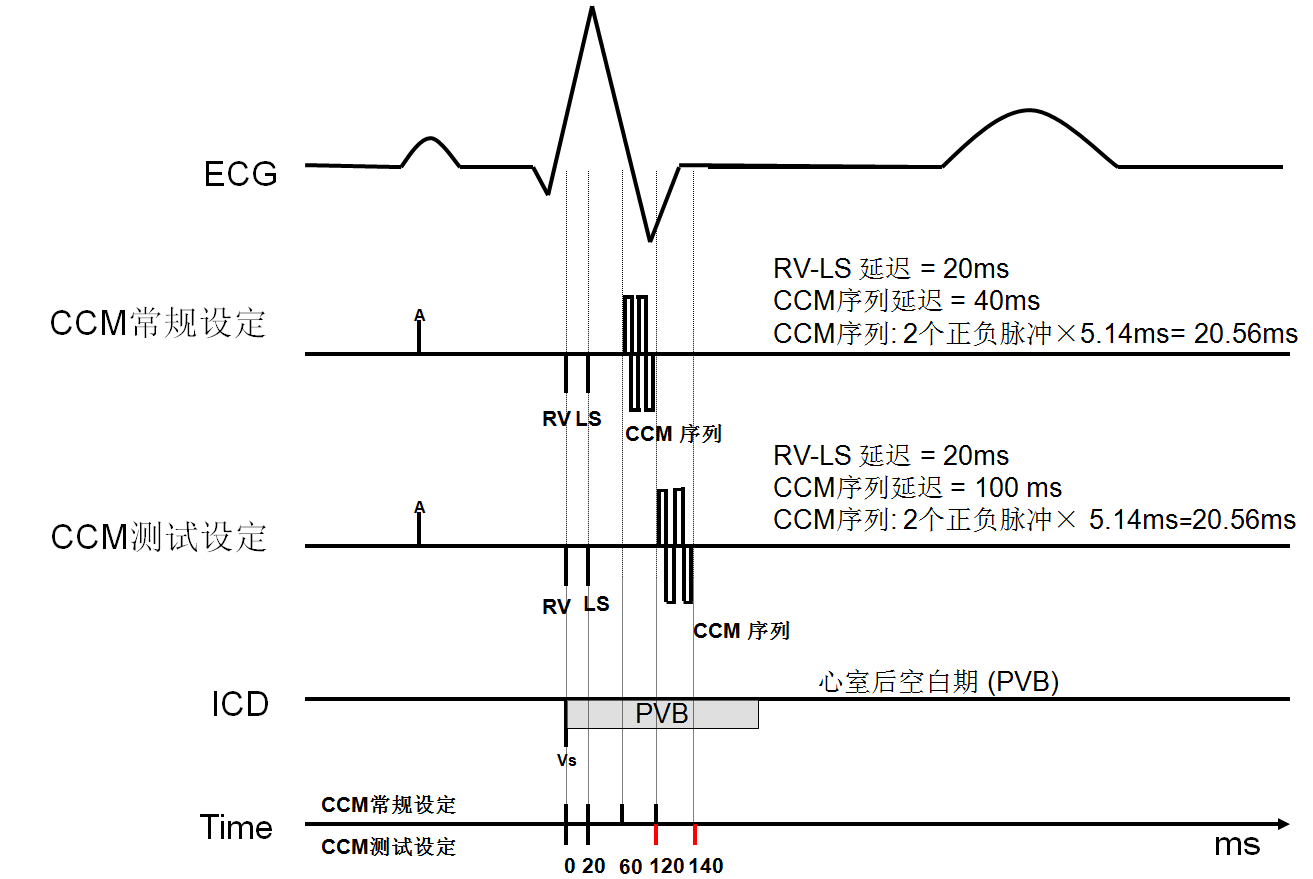
图8 设定不同的CCM序列延迟与ICD之间的影响示意图
以RV感知到电信号的时间点设为0ms,不同的CCM序列延迟将会导致CCM序列发放在QRS波的不同部位,这可能对ICD的工作造成干扰。此时可通过调整CCM序列延迟或延长ICD的心室后空白期(PVB)来避免。
CCM常规设定:CCM序列延迟为40ms时, RV-LS延迟为20ms,CCM序列为RV和LS电极各发放2个正负脉冲×5.14ms=20.56ms,CCM序列在RV感知后60ms发放,80ms结束;
CCM测试设定: CCM序列延迟为100ms时, RV-LS延迟为20ms,CCM序列为RV和LS电极各发放2个正负脉冲×5.14ms=20.56ms,CCM序列在RV感知后120ms发放,140ms结束。
参考文献:
[1] Kuschyk J, Roeger S, Schneider R, Streitner F, Stach K, Rudic B, Weiß C, Schimpf R, Papavasilliu T, Rousso B, Burkhoff D, Borggrefe M. Efficacy and survival in patients with cardiac contractility modulation: Long-term single center experience in 81 patients.
Int J Cardiol. 2015;183:76-81.
[2] Giallauria F, Vigorito C, Piepoli MF, Stewart Coats AJ. Effect of cardiac contractility modulation by non-excitatory electrical stimulation on exercise capacity and quality of life: an individual patient's data meta-analysis of randomized controlled trials. Int J Cardiol. 2014;175(2):352-7.
[3] Kwong JS, Sanderson JE, Yu CM. Cardiac contractility modulation for heart failure: a meta- analysis of randomized controlled trials. Pacing Clin Electrophysiol. 2012;35(9): 1111-8.
[4] Abraham WT, Nademanee K, Volosin K, Krueger S, Neelagaru S, Raval N, Obel O, Weiner S, Wish M, Carson P, Ellenbogen K, Bourge R, Parides M, Chiacchierini RP, Goldsmith R, Goldstein S, Mika Y, Burkhoff D, Kadish A; FIX-HF-5 Investigators and Coordinators. Subgroup analysis of a randomized controlled trial evaluating the safety and efficacy of cardiac contractility modulation in advanced heart failure. J Card Fail. 2011; 17(9):710-7.
[5] Schau T, Seifert M, Meyhöfer J, Neuss M, Butter C. Long-term outcome of cardiac contractility modulation in patients with severe congestiveheart failure. Europace. 2011; 13(10):1436-44.
[6] Nägele H, Behrens S, Eisermann C. Cardiac contractility modulation in non-responders to cardiac resynchronization therapy. Europace. 2008;10(12):1375-80.
[7] Butter C, Meyhöfer J, Seifert M, Neuss M, Minden HH. First use of cardiac contractility
modulation (CCM) in a patient failing CRT therapy: clinical and technical aspects of combined therapies. Eur J Heart Fail. 2007;9(9):955-8.
宿燕岗:围手术期避免CCM与CRT-D/IC的相互干扰
2015-06-16 13:58
