朱鲜阳:复杂先心病矫治术后经皮肺动脉瓣植入术应用和进展
2015-06-16 13:25
随着科学技术的发展,经导管瓣膜技术的问世为介入心脏病学翻开新的篇章。2000年10月,Bonhoeffer团队首次将自行设计的肺动脉带瓣支架应用于一名12岁接受法洛四联症(tetralogy of Fallot,TOF)根治术后出现肺动脉狭窄和返流的患者,获得成功。此后,经皮肺动脉瓣植入术(percutaneous pulmonary valve implantation,PPVI)被日趋增多的先天性心脏病患者所使用,目前全球已有近5000余例的患者接受PPVI。
一、 复杂先心病右心室流出道矫治术后的疑难问题
右心室流出道(right ventricular outflow tract,RVOT)跨肺动脉瓣补片修复术或带瓣管道重建是复杂先心病外科治疗的经典术式,如TOF和肺动脉闭锁根治术,永存动脉干Ross手术,大动脉转位、右室双出口Rastelli手术等,术后数年其人工或生物带瓣管道出现钙化、变形,导致狭窄和关闭不全,造成右心室扩大,收缩排血功能减低,患者运动耐量明显下降,致命性室性心动过速和猝死的风险增加。再次外科手术更换管道和瓣膜,可改善心功能、提高运动耐量、减少心律失常的发生率,但再次(二次以上)手术的风险大,并发症和死亡率明显増高。特别是婴幼儿时期进行手术的患者,一生需进行多次手术,必然导致并发症与死亡率上升。
多年以来,肺动脉瓣关闭不全(pulmonary valve incompetence,PR)对心室功能不全的影响一直被忽视。约30%患者因长期严重PR而于30-40岁出现症状。TOF修复术中,其RVOT、肺动脉瓣环与PA分支解剖差异巨大,不同术式对PR严重程度、右心室(right ventricle,RV)扩张程度和症状进展存在显著影响。肺动脉瓣返流量取决于肺动脉和RV舒张期压差,随着时间的推移,显著PR将导致RV扩张。压力-容量血流动力学检测显示,RV容量增加可致左心室(left ventricle,LV)容量降低,心输出量下降。RV扩张和舒张期室间隔突向LV导致LV充盈不足,心室之间机械-电活动不同步使两个心室功能和效率减低,还可致心肌电活动不同步,传导速度缓慢,诱发室性和室上性心律失常。长期PR和RV扩张可致呼吸困难、疲乏、活动后心悸、晕厥、水肿、运动耐量下降而出现右心衰竭、三尖瓣返流,心源性肝硬化和心源性猝死等临床症状。因此,实施肺动脉瓣置换手术是非常重要的。PPVI技术能治疗肺动脉瓣梗阻性和返流性病变,改善肺循环与右心室的功能,避免了再次开胸手术的风险,延长了植入管道患者的寿命。
二、PPVI适应证选择
2010年,ESC推荐的外科肺动脉瓣替换术指征如下:a.有症状的重度PR患者(证据级别:I C)。b.无症状的重度PR患者如出现以下情况仍考虑换瓣(证据级别:IIa C):⑴客观证据提示的活动耐量下降;⑵进行性RV扩大;⑶进行性RV收缩功能不全;⑷进行性三尖瓣返流(至少中度以上);⑸RV流出道狭窄,RV收缩压>80 mmHg(三尖瓣返流速度>4.3 m/s);⑹持续性房性/室性心动过速。目前,无论是狭窄还是返流为主的病变,对于RVOT/肺动脉主干功能不良患者何时进行PPVI并无明确指南。治疗时机的选择在狭窄患者中较为简单,患者伴有明显狭窄时出现症状较早。针对PR,多数医疗中心对经导管或外科治疗的适应证,多采用MRI综合评估RV舒张末期容积和收缩功能,心肺运动试验(作为患者症状的客观评价指标)和出现室性心律失常。PPVI的临床主要标准尚未完全明确,参照2010 ESC推荐PVR指征,有研究认为应该包括临床和解剖形态学两个方面(见表1),在选择患者前需常规进行超声心动图、心电图、心脏MRI等影像学检查,评估RV功能和RV流出道的解剖学特征。
表1. PPVI 临床与形态学适应证

对于膜性肺动脉瓣狭窄(pulmonary Valve Stenosis,PS),临床普遍接受的标准是,如有症状,RV压力应大于体循环压力2/3,如无症状,则应大于3/4,方考虑手术。如有中、重度PR且症状进行性加重,同时合并运动耐量下降,心律失常,RV扩张和RV功能不全等,应行PV置换术或植入术。术前仔细选择患者至关重要,应由多学科团队进行综合评估。虽然尚无通用方案进行严格筛选,但仍需全面检查以明确诊断,确定其解剖学结构是否适于行PPVI。常规检查:1)超声心动图:测量流出道压力阶差,观察是否存在肺动脉瓣下、瓣上和分支狭窄;2)心脏MRI:计算返流程度,对RVOT,肺动脉瓣环和肺动脉进行三维重建,并对RV大小和功能进行量化评估;3)心肺运动功能测试:客观评价其功能储备,获取运动时间,最大摄氧量(VO2峰值),无氧阈值和每分钟通气量/二氧化碳产生率(VE/VCO2)等参数;4)诊断性心导管术:对血流动力学进行评估,证实可以通过RVOT的校准后瓣膜适合于介入治疗; 5)冠状动脉造影:球囊扩张RVOT时是否累及冠状动脉。
三、经皮肺动脉瓣植入术现状
目前临床上获批准应用的PPVI器械系统有两种:Medtronic公司生产的MelodyTM瓣膜系统和Edwards公司生产的SAPIENTM瓣膜,均已经通过欧洲CE以及美国FDA批准应用于PPVI手术。
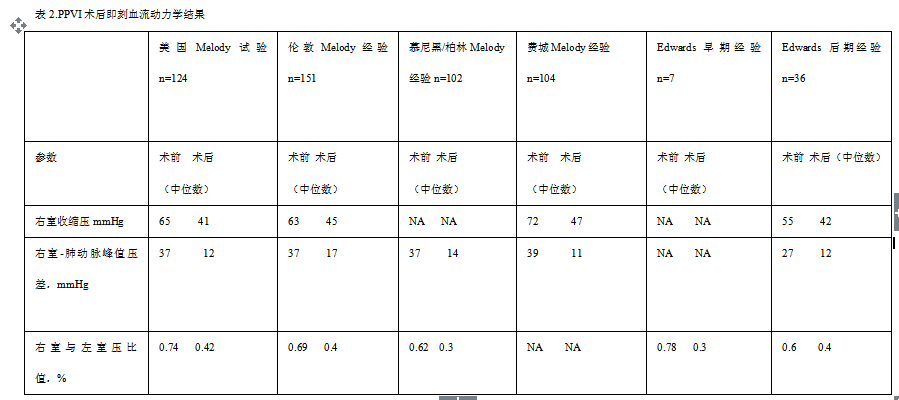
表2显示关于应用MELODYTM瓣膜以及SAPIENTM瓣膜进行 PPVI的几项主要研究结果。几项单中心和多中心临床试验一致报道应用MELODYTM进行PPVI围手术期并发症发生率低至6%。“MELODYTM瓣膜注册研究”数据分析显示1003例PPVI患者的主要手术并发症(例如植入瓣膜破裂,分支肺动脉穿孔,导丝损伤,三尖瓣损伤,人工瓣膜移位,冠状动脉压迫或肺动脉梗阻)发生率为2.7%-11.9%。SAPIENTM瓣膜的“早期阶段的国际多中心临床试验”报道36例PPVI患者97%成功植入人工肺动脉瓣,7例(20.5%)发生不良事件,主要并发症为人工瓣膜移位,没有植入瓣膜发生破裂。
所有准备接受PPVI的患者大约5%-6%有发生冠状动脉阻塞的风险。已有几项报道这种潜在的致命性并发症与早期手术死亡率相关。排除这种并发症的风险是PPVI术前准备最困难步骤之一。如果怀疑存在冠状动脉压迫风险,建议放弃植入任何类型肺动脉瓣,包括MELODYTM或SAPIENTM瓣膜。虽然应用MELODYTM瓣膜进行PPVI的数据较SAPIENTM瓣膜多,但是两者的短中期随访结果相似,长期的随访结果仍不清楚。随访期间PPVI的全因死亡率为0-5%,似乎与瓣膜本身无关。无论是MELODYTM瓣膜或SAPIENTM瓣膜植入失败都可能与支架或者瓣叶缝合障碍有关。Nordmeyer最新报道11%的患者瓣膜支架断裂是导致再次干预的最常见原因。
总体上,来源四个主要短期和中期的观察性研究中450例患者1-5年随访结果显示:1年随访期间大约94%患者免于瓣膜功能障碍或再次干预。为期一年的随访中,不需要再次干预的患者一直保持轻度或无PR。超声心动图1年随访时跨RV流出道平均峰速度为1.9-2.7 m/s。Nordmeyer报道MELODYTM瓣膜注册研究的初步结果, 92.5% -94.2%的1年随访患者未发生PPVI相关不良事件。
关于SAPIENTM瓣膜功能的数据有限,主要来源于不到100例的短中期观察性研究。COMPASSION临床试验中,34例中有33例成功植入瓣膜,97%患者在6个月随访中免于再次介入治疗。Haas等研究表明,PPVI术后跨RV流出道至肺动脉压差显著降低,RV收缩压下降,肺动脉舒张压从6.3 mmHg升高至14.5 mmHg,作为免于再次干预的PR显著减轻的标志。
PPVI适应证的扩展和展望
PPVI适应证仍缺乏统一的标准,是否应在疾病早期(即RV舒张末期容积较小时)实施PPVI,而不是等到需行外科瓣膜替换时才进行,因为介入手术围手术期风险比外科开胸手术小。有关外科肺动脉瓣替换术和PPVI效果比较,目前尚无报道。两种手术患者构成并不相同,这包括合并症、外科手术风险、技术难度和是否需行其它修复术等,使得两类人群不具备可比性。此外,关键问题是导管植入的瓣膜长期使用的寿命。再过几年,有望从已发表的队列研究和其它实际工作经验中获得更长时间的随访数据。按照FDA的批准条件,美敦力公司尚需对Melody瓣膜进行两项后续研究,即医师操作专业化培训和长期风险与获益的研究,将继续报道150例参与者介入治疗结果,直至5年随访期满。第二个研究重新纳入100例新患者以评估PPVI培训项目是否足够以及项目的安全性。同样,随着参与者的不断增多和随访时间的不断延长,以Edwards SAPIEN PV为研究对象的COMPASSION试验也在稳步推进。随着患者数量的增加和随访时间的延长,关注SAPIEN瓣膜是否仍可将支架断裂发生率保持在低水平状态。支架断裂事件发生率降低是否会引起临床效果差异也在拭目以待。还有其它几种经皮或杂交PV系统正在进行体外实验、动物实验或临床前期研究。
未来的PPVI技术难题在于如何在扩张的流出道植入瓣膜,主要见于TOF修复术后。在初步探索Melody和SAPIEN瓣膜植入RV-PA管道的可行性之后,开始探索如何将瓣膜植入曾行跨瓣环补片修补术的RVOT,如瓣环直径≤22mm可植入Melody瓣膜,≤26mm则植入SAPIEN瓣膜。有报道显示,如RVOT显著扩张,也可采用杂交手术进行修复,即在心脏不停跳状态下先行外科环缩术将RVOT缩小然后再行PPVI。如果患者生物瓣环直径较大,可将用于主动脉瓣植入术的29mm SAPIEN瓣膜用于PPVI。将来,可能更广泛使用三维模型,评估患者是否适合PPVI并制定更加周密的手术方案,根据患者特点定制更加符合其解剖形态的瓣膜支架,重塑后可使其与患者独特形态更加吻合。
从目前实施PPVI的总体来看,是安全、可行、有效的。但与经导管主动脉瓣植入术相比,PPVI的病例相对较少。PPVI的器械仍处于研发改进中,适应证也在不断拓展,所以相关技术和材料方面仍存在着很大的提升空间。这些研究均是单中心的观察性研究,PPVI长期益处还需更多的研究尤其是随机对照研究来证实,相信不久的将来,PPVI将会成为复杂先心病患者矫治术后残余PS与PR的首选常规治疗手段。
阅读数: 2462
一、 复杂先心病右心室流出道矫治术后的疑难问题
右心室流出道(right ventricular outflow tract,RVOT)跨肺动脉瓣补片修复术或带瓣管道重建是复杂先心病外科治疗的经典术式,如TOF和肺动脉闭锁根治术,永存动脉干Ross手术,大动脉转位、右室双出口Rastelli手术等,术后数年其人工或生物带瓣管道出现钙化、变形,导致狭窄和关闭不全,造成右心室扩大,收缩排血功能减低,患者运动耐量明显下降,致命性室性心动过速和猝死的风险增加。再次外科手术更换管道和瓣膜,可改善心功能、提高运动耐量、减少心律失常的发生率,但再次(二次以上)手术的风险大,并发症和死亡率明显増高。特别是婴幼儿时期进行手术的患者,一生需进行多次手术,必然导致并发症与死亡率上升。
多年以来,肺动脉瓣关闭不全(pulmonary valve incompetence,PR)对心室功能不全的影响一直被忽视。约30%患者因长期严重PR而于30-40岁出现症状。TOF修复术中,其RVOT、肺动脉瓣环与PA分支解剖差异巨大,不同术式对PR严重程度、右心室(right ventricle,RV)扩张程度和症状进展存在显著影响。肺动脉瓣返流量取决于肺动脉和RV舒张期压差,随着时间的推移,显著PR将导致RV扩张。压力-容量血流动力学检测显示,RV容量增加可致左心室(left ventricle,LV)容量降低,心输出量下降。RV扩张和舒张期室间隔突向LV导致LV充盈不足,心室之间机械-电活动不同步使两个心室功能和效率减低,还可致心肌电活动不同步,传导速度缓慢,诱发室性和室上性心律失常。长期PR和RV扩张可致呼吸困难、疲乏、活动后心悸、晕厥、水肿、运动耐量下降而出现右心衰竭、三尖瓣返流,心源性肝硬化和心源性猝死等临床症状。因此,实施肺动脉瓣置换手术是非常重要的。PPVI技术能治疗肺动脉瓣梗阻性和返流性病变,改善肺循环与右心室的功能,避免了再次开胸手术的风险,延长了植入管道患者的寿命。
二、PPVI适应证选择
2010年,ESC推荐的外科肺动脉瓣替换术指征如下:a.有症状的重度PR患者(证据级别:I C)。b.无症状的重度PR患者如出现以下情况仍考虑换瓣(证据级别:IIa C):⑴客观证据提示的活动耐量下降;⑵进行性RV扩大;⑶进行性RV收缩功能不全;⑷进行性三尖瓣返流(至少中度以上);⑸RV流出道狭窄,RV收缩压>80 mmHg(三尖瓣返流速度>4.3 m/s);⑹持续性房性/室性心动过速。目前,无论是狭窄还是返流为主的病变,对于RVOT/肺动脉主干功能不良患者何时进行PPVI并无明确指南。治疗时机的选择在狭窄患者中较为简单,患者伴有明显狭窄时出现症状较早。针对PR,多数医疗中心对经导管或外科治疗的适应证,多采用MRI综合评估RV舒张末期容积和收缩功能,心肺运动试验(作为患者症状的客观评价指标)和出现室性心律失常。PPVI的临床主要标准尚未完全明确,参照2010 ESC推荐PVR指征,有研究认为应该包括临床和解剖形态学两个方面(见表1),在选择患者前需常规进行超声心动图、心电图、心脏MRI等影像学检查,评估RV功能和RV流出道的解剖学特征。
表1. PPVI 临床与形态学适应证

对于膜性肺动脉瓣狭窄(pulmonary Valve Stenosis,PS),临床普遍接受的标准是,如有症状,RV压力应大于体循环压力2/3,如无症状,则应大于3/4,方考虑手术。如有中、重度PR且症状进行性加重,同时合并运动耐量下降,心律失常,RV扩张和RV功能不全等,应行PV置换术或植入术。术前仔细选择患者至关重要,应由多学科团队进行综合评估。虽然尚无通用方案进行严格筛选,但仍需全面检查以明确诊断,确定其解剖学结构是否适于行PPVI。常规检查:1)超声心动图:测量流出道压力阶差,观察是否存在肺动脉瓣下、瓣上和分支狭窄;2)心脏MRI:计算返流程度,对RVOT,肺动脉瓣环和肺动脉进行三维重建,并对RV大小和功能进行量化评估;3)心肺运动功能测试:客观评价其功能储备,获取运动时间,最大摄氧量(VO2峰值),无氧阈值和每分钟通气量/二氧化碳产生率(VE/VCO2)等参数;4)诊断性心导管术:对血流动力学进行评估,证实可以通过RVOT的校准后瓣膜适合于介入治疗; 5)冠状动脉造影:球囊扩张RVOT时是否累及冠状动脉。
三、经皮肺动脉瓣植入术现状
目前临床上获批准应用的PPVI器械系统有两种:Medtronic公司生产的MelodyTM瓣膜系统和Edwards公司生产的SAPIENTM瓣膜,均已经通过欧洲CE以及美国FDA批准应用于PPVI手术。
表2显示关于应用MELODYTM瓣膜以及SAPIENTM瓣膜进行 PPVI的几项主要研究结果。几项单中心和多中心临床试验一致报道应用MELODYTM进行PPVI围手术期并发症发生率低至6%。“MELODYTM瓣膜注册研究”数据分析显示1003例PPVI患者的主要手术并发症(例如植入瓣膜破裂,分支肺动脉穿孔,导丝损伤,三尖瓣损伤,人工瓣膜移位,冠状动脉压迫或肺动脉梗阻)发生率为2.7%-11.9%。SAPIENTM瓣膜的“早期阶段的国际多中心临床试验”报道36例PPVI患者97%成功植入人工肺动脉瓣,7例(20.5%)发生不良事件,主要并发症为人工瓣膜移位,没有植入瓣膜发生破裂。

所有准备接受PPVI的患者大约5%-6%有发生冠状动脉阻塞的风险。已有几项报道这种潜在的致命性并发症与早期手术死亡率相关。排除这种并发症的风险是PPVI术前准备最困难步骤之一。如果怀疑存在冠状动脉压迫风险,建议放弃植入任何类型肺动脉瓣,包括MELODYTM或SAPIENTM瓣膜。虽然应用MELODYTM瓣膜进行PPVI的数据较SAPIENTM瓣膜多,但是两者的短中期随访结果相似,长期的随访结果仍不清楚。随访期间PPVI的全因死亡率为0-5%,似乎与瓣膜本身无关。无论是MELODYTM瓣膜或SAPIENTM瓣膜植入失败都可能与支架或者瓣叶缝合障碍有关。Nordmeyer最新报道11%的患者瓣膜支架断裂是导致再次干预的最常见原因。
总体上,来源四个主要短期和中期的观察性研究中450例患者1-5年随访结果显示:1年随访期间大约94%患者免于瓣膜功能障碍或再次干预。为期一年的随访中,不需要再次干预的患者一直保持轻度或无PR。超声心动图1年随访时跨RV流出道平均峰速度为1.9-2.7 m/s。Nordmeyer报道MELODYTM瓣膜注册研究的初步结果, 92.5% -94.2%的1年随访患者未发生PPVI相关不良事件。
关于SAPIENTM瓣膜功能的数据有限,主要来源于不到100例的短中期观察性研究。COMPASSION临床试验中,34例中有33例成功植入瓣膜,97%患者在6个月随访中免于再次介入治疗。Haas等研究表明,PPVI术后跨RV流出道至肺动脉压差显著降低,RV收缩压下降,肺动脉舒张压从6.3 mmHg升高至14.5 mmHg,作为免于再次干预的PR显著减轻的标志。
PPVI适应证的扩展和展望
PPVI适应证仍缺乏统一的标准,是否应在疾病早期(即RV舒张末期容积较小时)实施PPVI,而不是等到需行外科瓣膜替换时才进行,因为介入手术围手术期风险比外科开胸手术小。有关外科肺动脉瓣替换术和PPVI效果比较,目前尚无报道。两种手术患者构成并不相同,这包括合并症、外科手术风险、技术难度和是否需行其它修复术等,使得两类人群不具备可比性。此外,关键问题是导管植入的瓣膜长期使用的寿命。再过几年,有望从已发表的队列研究和其它实际工作经验中获得更长时间的随访数据。按照FDA的批准条件,美敦力公司尚需对Melody瓣膜进行两项后续研究,即医师操作专业化培训和长期风险与获益的研究,将继续报道150例参与者介入治疗结果,直至5年随访期满。第二个研究重新纳入100例新患者以评估PPVI培训项目是否足够以及项目的安全性。同样,随着参与者的不断增多和随访时间的不断延长,以Edwards SAPIEN PV为研究对象的COMPASSION试验也在稳步推进。随着患者数量的增加和随访时间的延长,关注SAPIEN瓣膜是否仍可将支架断裂发生率保持在低水平状态。支架断裂事件发生率降低是否会引起临床效果差异也在拭目以待。还有其它几种经皮或杂交PV系统正在进行体外实验、动物实验或临床前期研究。
未来的PPVI技术难题在于如何在扩张的流出道植入瓣膜,主要见于TOF修复术后。在初步探索Melody和SAPIEN瓣膜植入RV-PA管道的可行性之后,开始探索如何将瓣膜植入曾行跨瓣环补片修补术的RVOT,如瓣环直径≤22mm可植入Melody瓣膜,≤26mm则植入SAPIEN瓣膜。有报道显示,如RVOT显著扩张,也可采用杂交手术进行修复,即在心脏不停跳状态下先行外科环缩术将RVOT缩小然后再行PPVI。如果患者生物瓣环直径较大,可将用于主动脉瓣植入术的29mm SAPIEN瓣膜用于PPVI。将来,可能更广泛使用三维模型,评估患者是否适合PPVI并制定更加周密的手术方案,根据患者特点定制更加符合其解剖形态的瓣膜支架,重塑后可使其与患者独特形态更加吻合。
从目前实施PPVI的总体来看,是安全、可行、有效的。但与经导管主动脉瓣植入术相比,PPVI的病例相对较少。PPVI的器械仍处于研发改进中,适应证也在不断拓展,所以相关技术和材料方面仍存在着很大的提升空间。这些研究均是单中心的观察性研究,PPVI长期益处还需更多的研究尤其是随机对照研究来证实,相信不久的将来,PPVI将会成为复杂先心病患者矫治术后残余PS与PR的首选常规治疗手段。
