林逸贤:左心耳的解剖结构和影像学特征
2015-05-27 15:21
摘要
左心耳(left atrial appendage,LAA)为延续于左心房的一盲端结构,具有特殊的胚胎起源、解剖结构和生理功能。在心血管疾病中,LAA是血栓形成的主要部位,增大脑卒中风险;而近来研究发现LAA也是不容忽视的房性心律失常的触发点。因此,早期发现LAA结构和功能异常对疾病的治疗和预后具有重要的意义。影像学评估LAA结构功能和血流动力学改变具有明显的优势。 目前,经食管超声心动图(transesophageal echocardiography,TEE)是评估LAA的首选方法,能清晰显示LAA的形态结构和血栓,尤其是三维超声可立体直观地从任意角度和平面观察LAA,较二维超声提供更多的信息。心脏多排螺旋CT(multidetector computed tomography,MDCT)和心脏核磁共振(cardiac magnetic resonance,CMR)亦可无创准确地显示LAA的解剖细节,提供较高分辨率的图像,为临床诊断和治疗提供依据。
关键词 左心耳,超声心动图,心脏多排螺旋CT,心脏核磁共振
左心耳(left atrial appendage,LAA)是沿左心房(left atrium,LA)前侧壁向前下延伸的狭长、弯曲的盲端结构,具有主动舒缩和分泌功能,对缓解LA内压力升高及保证左心室(left ventricle,LV)充盈具有重要意义[1]。在心血管疾病中,LAA特殊的解剖结构和功能特点使其成为血栓形成的主要部位。研究表明,90%以上的非瓣膜性和60%的瓣膜性房颤患者中心房血栓发生于LAA内[2, 3],通过对LAA的研究可以预测疾病的发展及转归。
1 LAA的胚胎起源和解剖结构
LAA是胚胎时期原始LA的残余,大致在胚胎发育8周左右原始LA出现肺静脉开口时形成[4, 5]。胚胎时期的LA主要由原始肺静脉及其分支融合而成。在原始肺静脉插入LA的过程中,LA内膜的血管壁成分逐渐增多,而冠状静脉窦来源的心肌成分逐渐缩小并包绕原始LA。胚胎形成6周后,原始LA壁出现2个肺静脉开口;第8周原始LA扩展把肺静脉根部及其左、右分支并入LA,LA有了4条肺静脉,此部分成为LA的光滑部,而被包绕原始LA房则分割成为LAA。
LAA位于LV上方,肺动脉及升主动脉左侧,左上肺静脉和二尖瓣环之间,多呈狭长、弯曲的管状盲端,形态变异较大,容积为0.77~19.2ml,而长度在16~51mm,开口最小直径为5~27mm,最大直径为10~40mm,70%的LAA主轴明显弯曲或呈螺旋状[6]。与发育成熟的LA不同,LAA内壁附有丰富的梳状肌及肌小梁,97%的梳状肌直径大于1mm;耳缘有锯齿状切迹,呈分叶状,80%具有多个分叶[7]。LAA接受回旋支或右冠状动脉房室结支血液供应,受交感神经和迷走神经纤维支配。
2012年,Di Biase等[8]发表一项研究,通过对932例接受导管消融的房颤患者进行术前CT/MRI检查,将LAA解剖形态分为4种(图1):即“仙人掌”形、“鸡翅”形、“风向袋”形、 “菜花”形;4种类型分别占278例(30%)、451例(48%)、179例(19%)、24例(3%)。在校正了CHADS2评分、性别和房颤类型后发现,“鸡翅”形LAA的患者卒中风险最低,“菜花”形则有最高的卒中发生率。该研究表明LAA解剖形态与房颤卒中的发生有密切关系。
2 LAA的生理功能和电生理特征
LAA的生理功能主要包括:1)压力和容量负荷的调节作用:LAA内存在粗大的梳状肌,其特性与心室肌细胞、骨骼肌细胞相似[4],因此LAA的主动收缩功能和顺应性远强于其余的LA部分;外科术中行血流动力学检查发现,夹闭LAA可导致即刻LA平均压、二尖瓣口和肺静脉口舒张期血流速度上升。因此,在LA压力和容量负荷增加时,LAA对其血流动力学具有重要的调节作用;2)分泌作用:LAA是分泌心房钠尿肽(atrial natriuretic peptide,ANP)的主要部位之一,尤其是LAA内ANP颗粒浓度是其余LA结构的40倍,约占总量的30%[9]。当LA压力负荷增加时,LAA除了扩张以减轻LA压力外,还通过释放ANP产生利尿排钠的作用降低LA压力。迷宫术中行双心耳切除的患者出现ANP分泌减少和水钠潴留[10];此外,LAA在保持心输出量和调节低血容量时的口渴中起有一定的作用[9]。
近年研究发现,LAA不仅是血栓形成的常见部位,也是房性心律失常产生和维持的重要部位[11, 12]。组织胚胎学证实LAA口部没有血管壁成分,其内膜由富含弹性纤维的胶原层和少量散杂的心肌细胞组成,是多条优势传导通路如Bachmann束、Marshall韧带等交汇处,成为潜在的折返性心律失常的关键传导区[5]。
LAA的解剖特点和血流动力学重建是形成血栓的重要原因。窦性心律时,LAA因具有正常收缩能力而减少血栓的形成。病理状态下LA压力增高,LA及LAA均通过增大内径及加强主动收缩来缓解LA压力,保证LV足够的血液充盈。随着LA的增大,LAA入口明显增宽,呈球形或半球形改变,且失去有效的规律收缩,LAA壁的内向运动难以引起足够的LAA排空;加之LAA的盲端结构及其内的肌小梁凹凸不平,易使血流产生漩涡和流速减慢,导致血液淤积,血栓形成[13]。
3 超声心动图在LAA结构和功能评价中的应用
3.1 经食管超声心动图(transesophageal echocardiography,TEE)
作为目前评价LAA的首选检查,二维TEE探头更靠近心脏,频率较高,图像更加清晰,通过主动脉短轴及左室两腔心切面可清晰显示LAA的形态结构,采用完整0°~180°多平面探查可全面评估LAA[14];此外,TTE还可以用来诊断LAA血栓及自发显影(图2)。与术中观察比较,TEE诊断LAA血栓的敏感性和特异性高达100%和99%,阳性预测值为95%[15];然而仍有存在于多叶LAA内的小于2mm的血栓易被漏诊[16],这主要因为LAA复杂的三维结构及对于正常LAA梳状肌与小血栓的鉴别上的困难。
三维TEE的出现克服了二维TEE空间分辨率不足的局限性,可立体直观地从任何角度和平面切割图像,不受自发显影干扰,将血栓从梳状肌中区分开来,提高了判断血栓是否存在的准确性,并可动态观察LAA的舒缩运动及容积变化[17, 18]。此外,三维TEE在需要高质量LAA图像指导LAA封堵装置放置时显示出了很高的适用性。随着LAA封堵术的发展,准确选择封堵装置的型号、指导放置以获得最好的治疗效果和尽量减少副作用变得尤为重要,这对实时准确评估LAA形态结构的要求也越来越高[19, 20]。应用三维TEE对患者进行术前评估和数据测量、术中监测及术后随访都具有重要的指导意义(图3)。
通过TEE脉冲多普勒采集LAA频谱并测量血流速度是评价LAA功能的重要方面。通常高质量的LAA血流频谱包括四个波形:舒张早期排空波(e波)、舒张晚期排空波(a波)、收缩早期充盈波和收缩期震荡波[2]。临床上主要利用a波的测量数据来评价LAA的收缩功能。有研究表明,LAA血流速度小于25cm/s的患者自发显影的发生率明显增高,小于20cm/s者血栓发生率增加,而大于55cm/s可以作为阴性预测值[21]。
TEE组织多普勒成像(tissue Doppler imaging,TDI)以及在此基础上发展起来应变率成像(strain rate imaging,SRI)亦可用来评估LAA功能。有研究证实LAA有血栓或存在高凝状态时组织速度明显降低,且与其血流速度有较好的相关性[22]。Arslan等[23]对LAA侧壁中段心肌研究表明该段心肌的应变及应变率与LAA血流速度、LA应变均有较好的相关性。姜新魁等[24]结合两种技术测量LAA各节段的应变及应变率,结果显示LAA顶部组织速度及应变率均高于其他节段,据此推测LAA顶部的收缩运动在LAA的排空过程中起重要作用。
新近的斑点追踪成像(speckle tracking imaging,STI)因与组织多普勒频移无关,没有角度依赖性,较以往应变率成像在评价LAA功能方面更为准确。有研究表明,房颤时LAA的应变率曲线表现为正负交替的低速波[25]。此外,STI还可通过软件自动追踪LAA内膜,完成最大、最小容积的计算,得出LAA排空分数,且所测得的LAA排空分数与血流速度有较好的相关性[26]。
3.2 经胸超声心动图(transthoracic echocardiography,TTE)
TTE在LAA图像采集中受到诸多因素的限制,很难获得高质量的图像,所以通常只是作为TEE的补充手段来观察LAA。只有经胸声窗足够好的患者,不能耐受TEE患者或低龄患儿,以及某些疾病(如房颤、二尖瓣狭窄等)导致LAA代偿性扩张的情况下,通过TTE胸骨旁短轴及心尖切面可获得相对清晰的LAA图像[16]。尽管有研究表明,联合二维TTE 和三维TTE与单独的TEE比较,在LA和LAA血栓显示方面有相似的精确性[27],但这必须依赖于超声技术的提高和操作者经验的增加。当怀疑LAA有血栓时,可以采用TTE进行初步筛查,但最终确诊还得依赖TEE。
3.3 心内超声心动图(intracardiac echocardiography,ICE)
ICE提供了TEE之外另一种选择,可通过多个切面显示LAA形态和结构,但目前ICE还没有三维成像,诊断LAA血栓的敏感性较TEE低[28]。此外,ICE是有创检查,其临床应用颇为受限,大多在手术中由介入医生完成图像采集,故通常作为TEE的补充手段来评估LAA。
4 其他影像学方法评估LAA
除TEE外,心脏多排螺旋CT(multidetector computed tomography,MDCT)和心脏核磁共振(cardiac magnetic resonance,CMR)因具有较高的图像分辨率,在评估LAA解剖结构和功能方面发挥着越来越重要的作用。
4.1 MDCT
同TEE比较,MDCT不仅可以从不同的平面和角度对心脏进行三维重建,显示LAA的解剖细节,还能更好显示LAA与心内或胸腔其它解剖结构的关系,具有较高的空间分辨率,为临床提供了良好的诊断及治疗依据(图4)。研究显示MDCT诊断LAA血栓的敏感性和特异性分别为96%和92%,阳性预测值和阴性预测值分别为41%和99%;通过延迟显像(注射造影剂后至少30s),MDCT诊断的准确性还可以得到显著提高[29]。然而MDCT亦有自身的局限性,如不能在操作过程中对LAA的结构和血流动力学变化进行实时观察,有电离辐射,且时间分辨率较TEE低[30]。
4.2 CMR
CMR是另外一种无创评估LAA的结构和功能的影像学方法,在LAA封堵术前诊断及术后随访中也发挥重要作用(图5)。CMR进行模型重建评估LAA的容积,可以用来预测房颤患者脑卒中的发生[31];CMR 灌注显像还可以测量LAA的血流速度,且与TEE有较好的相关性[32]。然而与TEE和MDCT相比,CMR在评估LAA血栓和自发显影方面远不理想,这主要和其空间分辨率有限及易对缓慢血流产生伪像有关。目前应用CMR对LAA的研究相对有限,并且在具体问题上还存在不同的结论。有研究显示CMR在诊断LAA血栓的敏感性和特异性为47%~50%,也有研究表明CMR和TEE在诊断LAA血栓方面有高度的一致性[33-35]。与MDCT类似,CMR也不能在操作过程中实时观察LAA。此外,CMR检查时间延长,需要患者屏气配合,对有心脏植入装置的患者亦不适用。
5 结论
LAA是发生栓塞事件、心脏电复律前和二尖瓣狭窄球囊扩张术前需要常规扫查的部位,早期发现LAA结构和功能的异常对于后续的治疗具有非常重要的意义。超声心动图技术的快速发展为LAA的研究提供了多种方法,其中二维TEE无论是在评价结构还是功能方面都是临床上最为常用的方法;三维TEE弥补了二维超声的不足,因其也具有实时性,被越来越广泛的应用。此外,MDCT和MRI因其无创性、可提供较高分辨率的图像在评估LAA方面发挥重要的作用。这些方法有各自的优点,也有其局限性,在未来随着技术的进一步发展及对LAA更深入的研究,通过这些技术可以达到对LAA的早期评估,预测血栓发生可能性,为临床诊治提供更多信息。
参考文献
1. Uretsky S, Shah A, Bangalore S, et al. Assessment of left atrial appendage function with transthoracic tissue Doppler echocardiography. Eur J Echocardiogr 2009, 10: 363-71.
2. Donal E, Yamada H, Leclercq C, Herpin D. The left atrial appendage, a small, blind-ended structure: a review of its echocardiographic evaluation and its clinical role. Chest 2005, 128: 1853-62.
3. Acar J, Cormier B, Grimberg D, et al. Diagnosis of left atrial thrombi in mitral stenosis-usefulness of ultrasound techniques compared with other methods. Eur Heart J 1991, 12 Suppl B: 70-6.
4. Hara H, Virmani R, Holmes DR Jr, et al. Is the left atrial appendage more than a simple appendage? Catheter Cardiovasc Interv 2009, 74: 234-42.
5. Douglas YL, Jonqbloed MR, Gittenberger-de Groot AC, et al. Histology of vascular myocardial wall of left atrial body after pulmonary venous incorporation. Am J Cardiol 2006, 97: 662-70.
6. Ernst G, Stöllberger C, Abzieher F, et al. Morphology of left atrial appendage. Anat Rec 1995, 242: 553-61.
7. Veinot JP, Harrity PJ, Gentile F, et al. Anatomy of the normal left atrial appendage: a quantitative study of age-related changes in 500 autopsy hearts: implications for echocardiographic examination. Circulation 1997, 96: 3112-5.
8. Di Biase L, Santangeli P, Anselmino M, et al. Does the left atrial appendage morphology correlate with the risk of stroke in patients with atrial fibrillation? Results from a multicenter study. J Am Coll Cardiol 2012, 60: 531-8.
9. Qamruddin S, Shinbane J, Shriki J, Naqvi TZ. Left atrial appendage: structure, function, imaging modalities and therapeutic options. Expert Rev Cardiovasc Ther 2010, 8: 65-75.
10. Block PC, Burstein S, Casale PN, et al. Percutaneous left atrial appendage occlusion for patients in atrial fibrillation suboptimal for warfarin therapy: 5-year results of the PLAATO (Percutaneous Left Atrial Appendage Transcatheter Occlusion) Study. JACC Cardiovasc Interv 2009, 2: 594-600.
11. Di Biase L, Burkhardt JD, Mohanty P, et al. Left atrial appendage: an underrecognized trigger site of atrial fibrillation. Circulation 2010, 122: 109-18.
12. Yamada T, Murakami Y, Yoshida Y, et al. Electrophysiologic and electrocardiographic characteristics and radiofrequency catheter ablation of focal atrial tachycardia originating from the left atrial appendage. Heart Rhythm 2007, 4: 1284-91.
13. Camm AJ, Camm CF, Savelieva I. Medical treatment of atrial fibrillation. J Cardiovasc Med (Hagerstown) 2012, 13: 97-107.
14. Roldán FJ, Vargas-Barrón J, Mendoza LL, et al, Anatomic correlation of left atrial appendage by 3-dimensional echocardiography. J Am Soc Echocardiogr 2001, 14: 941-4.
15. Manning WJ, Weintraub RM, Waksmonski CA, et al. Accuracy of transesophageal echocardiography for identifying left atrial thrombi. A prospective, intraoperative study. Ann Intern Med 1995, 123: 817-22.
16. Halperin JL, Gomberg-Maitland M. Obliteration of the left atrial appendage for prevention of thromboembolism. J Am Coll Cardiol 2003, 42: 1259-61.
17. Mizuguchi KA, Burch TM, Bulwer BE, Fox AA, Rizzo RJ, Shernan SK. Thrombus or bilobar left atrial appendage? Diagnosis by real-time three-dimensional transesophageal echocardiography. Anesth Analg 2009, 108: 70-2.
18. Nakajima H, Seo Y, Ishizu T, et al. Analysis of the left atrial appendage by three-dimensional transesophageal echocardiography. Am J Cardiol 2010, 106: 885-92.
19. Swaans MJ, Post MC, Rensing BJ, Boersma LV. Percutaneous left atrial appendage closure for stroke prevention in atrial fibrillation. Neth Heart J 2012, 20: 161-6.
20. Shah SJ, Bardo DM, Sugeng L, et al. Real-time three-dimensional transesophageal echocardiography of left atrial appendage: initial experience in the clinical setting. J Am Soc Echovardiogr 2008, 21: 1362-8.
21. Handke M, Harloff A, Hetzel A, Olschewski M, Bode C, Geibel A. Left atrial appendage flow velocity as a quantitative surrogate parameter for thromboembolic risk: determinants and relationship to spontaneous echocontrast and thrombus formation-a transesophageal echocardiographic study in 500 patients with cerebral ischemia. J Am Soc Echocardiogr 2005, 18: 1366-72.
22. Topsakal R, Eryol NK, Cicek Y, et al. Evaluation of left atrial appendage functions in patients with thrombus and spontaneous echo contrast in left atrial appendage by using color Doppler tissue imaging. Ann Noninvasive Electrocardiol 2004, 9: 345-51.
23. Arslan S, Simsek Z, Gundogdu F, et al. Can left atrial strain and strain rate imaging be used to assess left atrial appendage function? Cardiology 2012, 121: 255-60.
24. 姜新魁, 穆玉明, 韩伟, 等. 组织速度成像结合应变率成像技术对房颤状态下左心耳功能的评价. 中国医学影像技术 2008, 24: 213-6.
25. 穆玉明, 吴治胜, 唐琪, 等. 心房颤动患者左心耳功能的三维超声及斑点追踪成像研究. 中华超声影像学杂志 2011, 20: 558-62.
26. 李艳红, 吴治胜 穆玉明, 等. 斑点追踪成像时间-容积曲线评价左心耳排空功能. 中国医学影像技术 2011, 27: 2049-52.
27. Karakus G, Kodali V, Inamdar V, Nanda NC, Suwanjutah T, Pothineni KR. Comparative assessment of left atrial appendage by transesophageal and combined two- and three-dimensional transthoracic echocardiography. Echocardiography 2008, 25: 918-24.
28. Saksena S, Sra J, Jordaens L, et al. A prospective comparison of cardiac imaging using intracardiac echocardiography with transesophageal echocardiography in patients with atrial fibrillation: the intracardiac echocardiography guided cardioversion helps interventional procedures study. Circ Arrhythm Electrophysiol 2010; 3: 571-7.
29. Romero J, Husain SA, Kelesidis I, Sanz J, Medina HM, Garcia MJ. Detection of left atrial appendage thrombus by cardiac computed tomography in patients with atrial fibrillation: a meta-analysis. Circ Cardiovasc Imaging 2013, 6: 185-94.
30. Pontone G, Andreini D, Bartorelli AL, et al. Diagnostic accuracy of coronary computed tomography angiography: a comparison between prospective and retrospective electrocardiogram triggering. J Am Coll Cardiol 2009, 54: 346-55.
31. Burrell LD, Horne BD, Anderson JL, Muhlestein JB, Whisenant BK. Usefulness of left atrial appendage volume as a predictor of embolic stroke in patients with atrial fibrillation. Am J Cardiol 2013, 112: 1148-52.
32. Muellerleile K, Sultan A, Groth M, et al. Velocity encoded cardiovascular magnetic resonance to assess left atrial appendage emptying. J Cardiovasc Magn Reson 2012, 14: 39.
33. Zahuranec DB, Mueller GC, Bach DS, et al. Pilot study of cardiac magnetic resonance imaging for detection of embolic source after ischemic stroke. J Stroke Cerebrovasc Dis 2012, 21: 794-800.
34. Mohrs OK, Nowak B, Petersen SE, et al. Thrombus detection in the left atrial appendage using contrast-enhanced MRI: a pilot study. AJR Am J Roentqenol 2006, 186: 198-205.
35. Ohyama H, Hosomi N, Takahashi T, et al. Comparison of magnetic resonance imaging and transesophageal echocardiography in detection of thrombus in the left atrial appendage. Stroke 2003, 34: 2436-9.
图1 心脏CT(左侧)/CMR(右侧)显示LAA的解剖形态
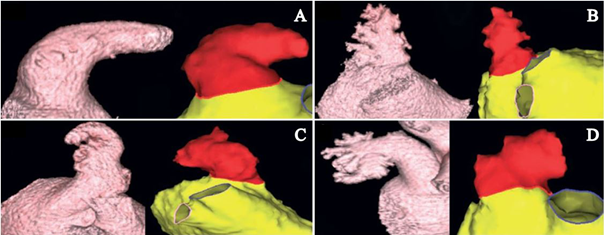
A: “鸡翅”形LAA;B:“仙人掌”形LAA;C:“风向袋”形LAA;D:“菜花”形LAA
LAA:左心耳
图2 二维TEE评估LAA
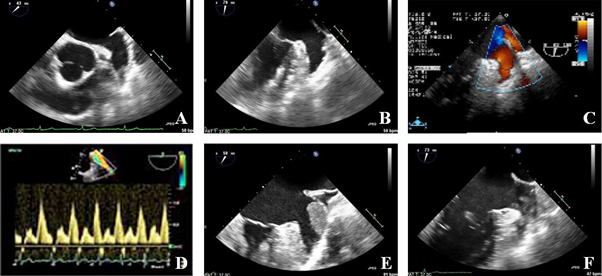
A:主动脉短轴切面显示LAA;B:左室两腔心切面显示LAA;C:LAA血流;D:LAA血流频谱;E:LAA血栓;F:LAA自发显影
LAA:左心耳
图3 三维TEE在LAA封堵术中的应用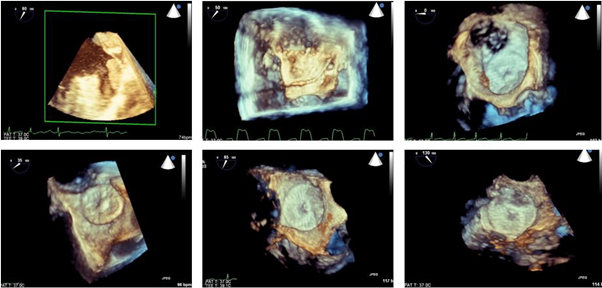
A:评估LAA结构和血栓;B:指导房间隔穿刺;C:评估LAA封堵器位置(0º);D:评估LAA封堵器位置(35º);E:评估LAA封堵器位置(65º);F:评估LAA封堵器位置(130º)
LAA:左心耳
图4 MDCT显示LAA结构
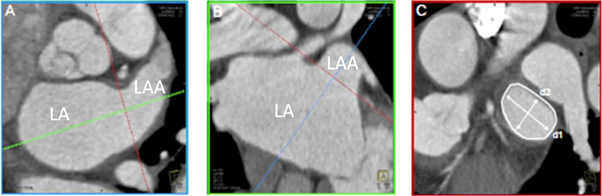
A: LAA长轴;B:LAA短轴;C: 评估LAA大小
LA:左心房;LAA:左心耳
图5 CMR显示LAA结构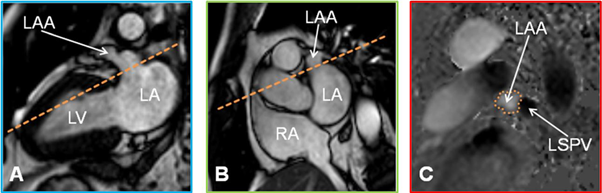
A: LAA长轴;B:LAA短轴;C:评估LAA大小
LA:左心房;LAA:左心耳;LV:左心室;LSPV:左上肺静脉;RA:右心房
阅读数: 9754
左心耳(left atrial appendage,LAA)为延续于左心房的一盲端结构,具有特殊的胚胎起源、解剖结构和生理功能。在心血管疾病中,LAA是血栓形成的主要部位,增大脑卒中风险;而近来研究发现LAA也是不容忽视的房性心律失常的触发点。因此,早期发现LAA结构和功能异常对疾病的治疗和预后具有重要的意义。影像学评估LAA结构功能和血流动力学改变具有明显的优势。 目前,经食管超声心动图(transesophageal echocardiography,TEE)是评估LAA的首选方法,能清晰显示LAA的形态结构和血栓,尤其是三维超声可立体直观地从任意角度和平面观察LAA,较二维超声提供更多的信息。心脏多排螺旋CT(multidetector computed tomography,MDCT)和心脏核磁共振(cardiac magnetic resonance,CMR)亦可无创准确地显示LAA的解剖细节,提供较高分辨率的图像,为临床诊断和治疗提供依据。
关键词 左心耳,超声心动图,心脏多排螺旋CT,心脏核磁共振
左心耳(left atrial appendage,LAA)是沿左心房(left atrium,LA)前侧壁向前下延伸的狭长、弯曲的盲端结构,具有主动舒缩和分泌功能,对缓解LA内压力升高及保证左心室(left ventricle,LV)充盈具有重要意义[1]。在心血管疾病中,LAA特殊的解剖结构和功能特点使其成为血栓形成的主要部位。研究表明,90%以上的非瓣膜性和60%的瓣膜性房颤患者中心房血栓发生于LAA内[2, 3],通过对LAA的研究可以预测疾病的发展及转归。
1 LAA的胚胎起源和解剖结构
LAA是胚胎时期原始LA的残余,大致在胚胎发育8周左右原始LA出现肺静脉开口时形成[4, 5]。胚胎时期的LA主要由原始肺静脉及其分支融合而成。在原始肺静脉插入LA的过程中,LA内膜的血管壁成分逐渐增多,而冠状静脉窦来源的心肌成分逐渐缩小并包绕原始LA。胚胎形成6周后,原始LA壁出现2个肺静脉开口;第8周原始LA扩展把肺静脉根部及其左、右分支并入LA,LA有了4条肺静脉,此部分成为LA的光滑部,而被包绕原始LA房则分割成为LAA。
LAA位于LV上方,肺动脉及升主动脉左侧,左上肺静脉和二尖瓣环之间,多呈狭长、弯曲的管状盲端,形态变异较大,容积为0.77~19.2ml,而长度在16~51mm,开口最小直径为5~27mm,最大直径为10~40mm,70%的LAA主轴明显弯曲或呈螺旋状[6]。与发育成熟的LA不同,LAA内壁附有丰富的梳状肌及肌小梁,97%的梳状肌直径大于1mm;耳缘有锯齿状切迹,呈分叶状,80%具有多个分叶[7]。LAA接受回旋支或右冠状动脉房室结支血液供应,受交感神经和迷走神经纤维支配。
2012年,Di Biase等[8]发表一项研究,通过对932例接受导管消融的房颤患者进行术前CT/MRI检查,将LAA解剖形态分为4种(图1):即“仙人掌”形、“鸡翅”形、“风向袋”形、 “菜花”形;4种类型分别占278例(30%)、451例(48%)、179例(19%)、24例(3%)。在校正了CHADS2评分、性别和房颤类型后发现,“鸡翅”形LAA的患者卒中风险最低,“菜花”形则有最高的卒中发生率。该研究表明LAA解剖形态与房颤卒中的发生有密切关系。
2 LAA的生理功能和电生理特征
LAA的生理功能主要包括:1)压力和容量负荷的调节作用:LAA内存在粗大的梳状肌,其特性与心室肌细胞、骨骼肌细胞相似[4],因此LAA的主动收缩功能和顺应性远强于其余的LA部分;外科术中行血流动力学检查发现,夹闭LAA可导致即刻LA平均压、二尖瓣口和肺静脉口舒张期血流速度上升。因此,在LA压力和容量负荷增加时,LAA对其血流动力学具有重要的调节作用;2)分泌作用:LAA是分泌心房钠尿肽(atrial natriuretic peptide,ANP)的主要部位之一,尤其是LAA内ANP颗粒浓度是其余LA结构的40倍,约占总量的30%[9]。当LA压力负荷增加时,LAA除了扩张以减轻LA压力外,还通过释放ANP产生利尿排钠的作用降低LA压力。迷宫术中行双心耳切除的患者出现ANP分泌减少和水钠潴留[10];此外,LAA在保持心输出量和调节低血容量时的口渴中起有一定的作用[9]。
近年研究发现,LAA不仅是血栓形成的常见部位,也是房性心律失常产生和维持的重要部位[11, 12]。组织胚胎学证实LAA口部没有血管壁成分,其内膜由富含弹性纤维的胶原层和少量散杂的心肌细胞组成,是多条优势传导通路如Bachmann束、Marshall韧带等交汇处,成为潜在的折返性心律失常的关键传导区[5]。
LAA的解剖特点和血流动力学重建是形成血栓的重要原因。窦性心律时,LAA因具有正常收缩能力而减少血栓的形成。病理状态下LA压力增高,LA及LAA均通过增大内径及加强主动收缩来缓解LA压力,保证LV足够的血液充盈。随着LA的增大,LAA入口明显增宽,呈球形或半球形改变,且失去有效的规律收缩,LAA壁的内向运动难以引起足够的LAA排空;加之LAA的盲端结构及其内的肌小梁凹凸不平,易使血流产生漩涡和流速减慢,导致血液淤积,血栓形成[13]。
3 超声心动图在LAA结构和功能评价中的应用
3.1 经食管超声心动图(transesophageal echocardiography,TEE)
作为目前评价LAA的首选检查,二维TEE探头更靠近心脏,频率较高,图像更加清晰,通过主动脉短轴及左室两腔心切面可清晰显示LAA的形态结构,采用完整0°~180°多平面探查可全面评估LAA[14];此外,TTE还可以用来诊断LAA血栓及自发显影(图2)。与术中观察比较,TEE诊断LAA血栓的敏感性和特异性高达100%和99%,阳性预测值为95%[15];然而仍有存在于多叶LAA内的小于2mm的血栓易被漏诊[16],这主要因为LAA复杂的三维结构及对于正常LAA梳状肌与小血栓的鉴别上的困难。
三维TEE的出现克服了二维TEE空间分辨率不足的局限性,可立体直观地从任何角度和平面切割图像,不受自发显影干扰,将血栓从梳状肌中区分开来,提高了判断血栓是否存在的准确性,并可动态观察LAA的舒缩运动及容积变化[17, 18]。此外,三维TEE在需要高质量LAA图像指导LAA封堵装置放置时显示出了很高的适用性。随着LAA封堵术的发展,准确选择封堵装置的型号、指导放置以获得最好的治疗效果和尽量减少副作用变得尤为重要,这对实时准确评估LAA形态结构的要求也越来越高[19, 20]。应用三维TEE对患者进行术前评估和数据测量、术中监测及术后随访都具有重要的指导意义(图3)。
通过TEE脉冲多普勒采集LAA频谱并测量血流速度是评价LAA功能的重要方面。通常高质量的LAA血流频谱包括四个波形:舒张早期排空波(e波)、舒张晚期排空波(a波)、收缩早期充盈波和收缩期震荡波[2]。临床上主要利用a波的测量数据来评价LAA的收缩功能。有研究表明,LAA血流速度小于25cm/s的患者自发显影的发生率明显增高,小于20cm/s者血栓发生率增加,而大于55cm/s可以作为阴性预测值[21]。
TEE组织多普勒成像(tissue Doppler imaging,TDI)以及在此基础上发展起来应变率成像(strain rate imaging,SRI)亦可用来评估LAA功能。有研究证实LAA有血栓或存在高凝状态时组织速度明显降低,且与其血流速度有较好的相关性[22]。Arslan等[23]对LAA侧壁中段心肌研究表明该段心肌的应变及应变率与LAA血流速度、LA应变均有较好的相关性。姜新魁等[24]结合两种技术测量LAA各节段的应变及应变率,结果显示LAA顶部组织速度及应变率均高于其他节段,据此推测LAA顶部的收缩运动在LAA的排空过程中起重要作用。
新近的斑点追踪成像(speckle tracking imaging,STI)因与组织多普勒频移无关,没有角度依赖性,较以往应变率成像在评价LAA功能方面更为准确。有研究表明,房颤时LAA的应变率曲线表现为正负交替的低速波[25]。此外,STI还可通过软件自动追踪LAA内膜,完成最大、最小容积的计算,得出LAA排空分数,且所测得的LAA排空分数与血流速度有较好的相关性[26]。
3.2 经胸超声心动图(transthoracic echocardiography,TTE)
TTE在LAA图像采集中受到诸多因素的限制,很难获得高质量的图像,所以通常只是作为TEE的补充手段来观察LAA。只有经胸声窗足够好的患者,不能耐受TEE患者或低龄患儿,以及某些疾病(如房颤、二尖瓣狭窄等)导致LAA代偿性扩张的情况下,通过TTE胸骨旁短轴及心尖切面可获得相对清晰的LAA图像[16]。尽管有研究表明,联合二维TTE 和三维TTE与单独的TEE比较,在LA和LAA血栓显示方面有相似的精确性[27],但这必须依赖于超声技术的提高和操作者经验的增加。当怀疑LAA有血栓时,可以采用TTE进行初步筛查,但最终确诊还得依赖TEE。
3.3 心内超声心动图(intracardiac echocardiography,ICE)
ICE提供了TEE之外另一种选择,可通过多个切面显示LAA形态和结构,但目前ICE还没有三维成像,诊断LAA血栓的敏感性较TEE低[28]。此外,ICE是有创检查,其临床应用颇为受限,大多在手术中由介入医生完成图像采集,故通常作为TEE的补充手段来评估LAA。
4 其他影像学方法评估LAA
除TEE外,心脏多排螺旋CT(multidetector computed tomography,MDCT)和心脏核磁共振(cardiac magnetic resonance,CMR)因具有较高的图像分辨率,在评估LAA解剖结构和功能方面发挥着越来越重要的作用。
4.1 MDCT
同TEE比较,MDCT不仅可以从不同的平面和角度对心脏进行三维重建,显示LAA的解剖细节,还能更好显示LAA与心内或胸腔其它解剖结构的关系,具有较高的空间分辨率,为临床提供了良好的诊断及治疗依据(图4)。研究显示MDCT诊断LAA血栓的敏感性和特异性分别为96%和92%,阳性预测值和阴性预测值分别为41%和99%;通过延迟显像(注射造影剂后至少30s),MDCT诊断的准确性还可以得到显著提高[29]。然而MDCT亦有自身的局限性,如不能在操作过程中对LAA的结构和血流动力学变化进行实时观察,有电离辐射,且时间分辨率较TEE低[30]。
4.2 CMR
CMR是另外一种无创评估LAA的结构和功能的影像学方法,在LAA封堵术前诊断及术后随访中也发挥重要作用(图5)。CMR进行模型重建评估LAA的容积,可以用来预测房颤患者脑卒中的发生[31];CMR 灌注显像还可以测量LAA的血流速度,且与TEE有较好的相关性[32]。然而与TEE和MDCT相比,CMR在评估LAA血栓和自发显影方面远不理想,这主要和其空间分辨率有限及易对缓慢血流产生伪像有关。目前应用CMR对LAA的研究相对有限,并且在具体问题上还存在不同的结论。有研究显示CMR在诊断LAA血栓的敏感性和特异性为47%~50%,也有研究表明CMR和TEE在诊断LAA血栓方面有高度的一致性[33-35]。与MDCT类似,CMR也不能在操作过程中实时观察LAA。此外,CMR检查时间延长,需要患者屏气配合,对有心脏植入装置的患者亦不适用。
5 结论
LAA是发生栓塞事件、心脏电复律前和二尖瓣狭窄球囊扩张术前需要常规扫查的部位,早期发现LAA结构和功能的异常对于后续的治疗具有非常重要的意义。超声心动图技术的快速发展为LAA的研究提供了多种方法,其中二维TEE无论是在评价结构还是功能方面都是临床上最为常用的方法;三维TEE弥补了二维超声的不足,因其也具有实时性,被越来越广泛的应用。此外,MDCT和MRI因其无创性、可提供较高分辨率的图像在评估LAA方面发挥重要的作用。这些方法有各自的优点,也有其局限性,在未来随着技术的进一步发展及对LAA更深入的研究,通过这些技术可以达到对LAA的早期评估,预测血栓发生可能性,为临床诊治提供更多信息。
参考文献
1. Uretsky S, Shah A, Bangalore S, et al. Assessment of left atrial appendage function with transthoracic tissue Doppler echocardiography. Eur J Echocardiogr 2009, 10: 363-71.
2. Donal E, Yamada H, Leclercq C, Herpin D. The left atrial appendage, a small, blind-ended structure: a review of its echocardiographic evaluation and its clinical role. Chest 2005, 128: 1853-62.
3. Acar J, Cormier B, Grimberg D, et al. Diagnosis of left atrial thrombi in mitral stenosis-usefulness of ultrasound techniques compared with other methods. Eur Heart J 1991, 12 Suppl B: 70-6.
4. Hara H, Virmani R, Holmes DR Jr, et al. Is the left atrial appendage more than a simple appendage? Catheter Cardiovasc Interv 2009, 74: 234-42.
5. Douglas YL, Jonqbloed MR, Gittenberger-de Groot AC, et al. Histology of vascular myocardial wall of left atrial body after pulmonary venous incorporation. Am J Cardiol 2006, 97: 662-70.
6. Ernst G, Stöllberger C, Abzieher F, et al. Morphology of left atrial appendage. Anat Rec 1995, 242: 553-61.
7. Veinot JP, Harrity PJ, Gentile F, et al. Anatomy of the normal left atrial appendage: a quantitative study of age-related changes in 500 autopsy hearts: implications for echocardiographic examination. Circulation 1997, 96: 3112-5.
8. Di Biase L, Santangeli P, Anselmino M, et al. Does the left atrial appendage morphology correlate with the risk of stroke in patients with atrial fibrillation? Results from a multicenter study. J Am Coll Cardiol 2012, 60: 531-8.
9. Qamruddin S, Shinbane J, Shriki J, Naqvi TZ. Left atrial appendage: structure, function, imaging modalities and therapeutic options. Expert Rev Cardiovasc Ther 2010, 8: 65-75.
10. Block PC, Burstein S, Casale PN, et al. Percutaneous left atrial appendage occlusion for patients in atrial fibrillation suboptimal for warfarin therapy: 5-year results of the PLAATO (Percutaneous Left Atrial Appendage Transcatheter Occlusion) Study. JACC Cardiovasc Interv 2009, 2: 594-600.
11. Di Biase L, Burkhardt JD, Mohanty P, et al. Left atrial appendage: an underrecognized trigger site of atrial fibrillation. Circulation 2010, 122: 109-18.
12. Yamada T, Murakami Y, Yoshida Y, et al. Electrophysiologic and electrocardiographic characteristics and radiofrequency catheter ablation of focal atrial tachycardia originating from the left atrial appendage. Heart Rhythm 2007, 4: 1284-91.
13. Camm AJ, Camm CF, Savelieva I. Medical treatment of atrial fibrillation. J Cardiovasc Med (Hagerstown) 2012, 13: 97-107.
14. Roldán FJ, Vargas-Barrón J, Mendoza LL, et al, Anatomic correlation of left atrial appendage by 3-dimensional echocardiography. J Am Soc Echocardiogr 2001, 14: 941-4.
15. Manning WJ, Weintraub RM, Waksmonski CA, et al. Accuracy of transesophageal echocardiography for identifying left atrial thrombi. A prospective, intraoperative study. Ann Intern Med 1995, 123: 817-22.
16. Halperin JL, Gomberg-Maitland M. Obliteration of the left atrial appendage for prevention of thromboembolism. J Am Coll Cardiol 2003, 42: 1259-61.
17. Mizuguchi KA, Burch TM, Bulwer BE, Fox AA, Rizzo RJ, Shernan SK. Thrombus or bilobar left atrial appendage? Diagnosis by real-time three-dimensional transesophageal echocardiography. Anesth Analg 2009, 108: 70-2.
18. Nakajima H, Seo Y, Ishizu T, et al. Analysis of the left atrial appendage by three-dimensional transesophageal echocardiography. Am J Cardiol 2010, 106: 885-92.
19. Swaans MJ, Post MC, Rensing BJ, Boersma LV. Percutaneous left atrial appendage closure for stroke prevention in atrial fibrillation. Neth Heart J 2012, 20: 161-6.
20. Shah SJ, Bardo DM, Sugeng L, et al. Real-time three-dimensional transesophageal echocardiography of left atrial appendage: initial experience in the clinical setting. J Am Soc Echovardiogr 2008, 21: 1362-8.
21. Handke M, Harloff A, Hetzel A, Olschewski M, Bode C, Geibel A. Left atrial appendage flow velocity as a quantitative surrogate parameter for thromboembolic risk: determinants and relationship to spontaneous echocontrast and thrombus formation-a transesophageal echocardiographic study in 500 patients with cerebral ischemia. J Am Soc Echocardiogr 2005, 18: 1366-72.
22. Topsakal R, Eryol NK, Cicek Y, et al. Evaluation of left atrial appendage functions in patients with thrombus and spontaneous echo contrast in left atrial appendage by using color Doppler tissue imaging. Ann Noninvasive Electrocardiol 2004, 9: 345-51.
23. Arslan S, Simsek Z, Gundogdu F, et al. Can left atrial strain and strain rate imaging be used to assess left atrial appendage function? Cardiology 2012, 121: 255-60.
24. 姜新魁, 穆玉明, 韩伟, 等. 组织速度成像结合应变率成像技术对房颤状态下左心耳功能的评价. 中国医学影像技术 2008, 24: 213-6.
25. 穆玉明, 吴治胜, 唐琪, 等. 心房颤动患者左心耳功能的三维超声及斑点追踪成像研究. 中华超声影像学杂志 2011, 20: 558-62.
26. 李艳红, 吴治胜 穆玉明, 等. 斑点追踪成像时间-容积曲线评价左心耳排空功能. 中国医学影像技术 2011, 27: 2049-52.
27. Karakus G, Kodali V, Inamdar V, Nanda NC, Suwanjutah T, Pothineni KR. Comparative assessment of left atrial appendage by transesophageal and combined two- and three-dimensional transthoracic echocardiography. Echocardiography 2008, 25: 918-24.
28. Saksena S, Sra J, Jordaens L, et al. A prospective comparison of cardiac imaging using intracardiac echocardiography with transesophageal echocardiography in patients with atrial fibrillation: the intracardiac echocardiography guided cardioversion helps interventional procedures study. Circ Arrhythm Electrophysiol 2010; 3: 571-7.
29. Romero J, Husain SA, Kelesidis I, Sanz J, Medina HM, Garcia MJ. Detection of left atrial appendage thrombus by cardiac computed tomography in patients with atrial fibrillation: a meta-analysis. Circ Cardiovasc Imaging 2013, 6: 185-94.
30. Pontone G, Andreini D, Bartorelli AL, et al. Diagnostic accuracy of coronary computed tomography angiography: a comparison between prospective and retrospective electrocardiogram triggering. J Am Coll Cardiol 2009, 54: 346-55.
31. Burrell LD, Horne BD, Anderson JL, Muhlestein JB, Whisenant BK. Usefulness of left atrial appendage volume as a predictor of embolic stroke in patients with atrial fibrillation. Am J Cardiol 2013, 112: 1148-52.
32. Muellerleile K, Sultan A, Groth M, et al. Velocity encoded cardiovascular magnetic resonance to assess left atrial appendage emptying. J Cardiovasc Magn Reson 2012, 14: 39.
33. Zahuranec DB, Mueller GC, Bach DS, et al. Pilot study of cardiac magnetic resonance imaging for detection of embolic source after ischemic stroke. J Stroke Cerebrovasc Dis 2012, 21: 794-800.
34. Mohrs OK, Nowak B, Petersen SE, et al. Thrombus detection in the left atrial appendage using contrast-enhanced MRI: a pilot study. AJR Am J Roentqenol 2006, 186: 198-205.
35. Ohyama H, Hosomi N, Takahashi T, et al. Comparison of magnetic resonance imaging and transesophageal echocardiography in detection of thrombus in the left atrial appendage. Stroke 2003, 34: 2436-9.
图1 心脏CT(左侧)/CMR(右侧)显示LAA的解剖形态

A: “鸡翅”形LAA;B:“仙人掌”形LAA;C:“风向袋”形LAA;D:“菜花”形LAA
LAA:左心耳
图2 二维TEE评估LAA

A:主动脉短轴切面显示LAA;B:左室两腔心切面显示LAA;C:LAA血流;D:LAA血流频谱;E:LAA血栓;F:LAA自发显影
LAA:左心耳
图3 三维TEE在LAA封堵术中的应用

A:评估LAA结构和血栓;B:指导房间隔穿刺;C:评估LAA封堵器位置(0º);D:评估LAA封堵器位置(35º);E:评估LAA封堵器位置(65º);F:评估LAA封堵器位置(130º)
LAA:左心耳
图4 MDCT显示LAA结构

A: LAA长轴;B:LAA短轴;C: 评估LAA大小
LA:左心房;LAA:左心耳
图5 CMR显示LAA结构

A: LAA长轴;B:LAA短轴;C:评估LAA大小
LA:左心房;LAA:左心耳;LV:左心室;LSPV:左上肺静脉;RA:右心房
