健心知著
2023.05.31
第273期

SGLT2抑制剂对多支非阻塞性冠状动脉狭窄合并诱发性心肌缺血的糖尿病患者冠状动脉纤维帽厚度和心血管事件的影响

刘健、马铭潞、孙浩宁
北京大学人民医院
健心荐语
钠-葡萄糖转运蛋白2抑制剂(SGLT2-I)可以通过下调炎症反应来延缓动脉粥样硬化斑块的进展,且能减少2型糖尿病(T2DM)合并缺血性心脏病(IHD)患者的主要不良心血管事件(MACEs)。T2DM合并多支非阻塞性冠状动脉狭窄(Mv-NOCS)患者的斑块内可存在过度炎症反应和脂质堆积,导致纤维帽厚度(FCT) 较薄,易发生斑块破裂和MACEs。然而,关于SGLT2-I对T2DM合并Mv-NOCS患者的动脉粥样硬化斑块表型及MACEs发生率的影响,尚缺乏相关数据。
文章介绍
本研究旨在评估SGLT2-I对T2DM合并Mv-NOCS患者纤维帽厚度、全身和冠状动脉斑块炎症、MACEs的影响。本文于2023年4月发表于Cardiovascular Diabetology杂志。
研究方法
本研究是一项前瞻性、多中心的对照试验,纳入369例合并有Mv-NOCS的T2DM患者,其中258例(69.9%)未接受SGLT2-I治疗(非SGLT2-I治疗组),111例(30.1%)在经皮冠状动脉介入治疗(PCI)和光学相干断层扫描(OCT)评估后接受SGLT2-I治疗(SGLT2-I治疗组)。研究者在1年时随访评估SGLT2-I对FCT变化的影响并作为主要终点;在基线水平和随访12个月时评估炎症反应、斑块负荷、MACEs发生率,并通过多变量分析评估MACEs的预测因素并作为次要终点。研究流程图如下:
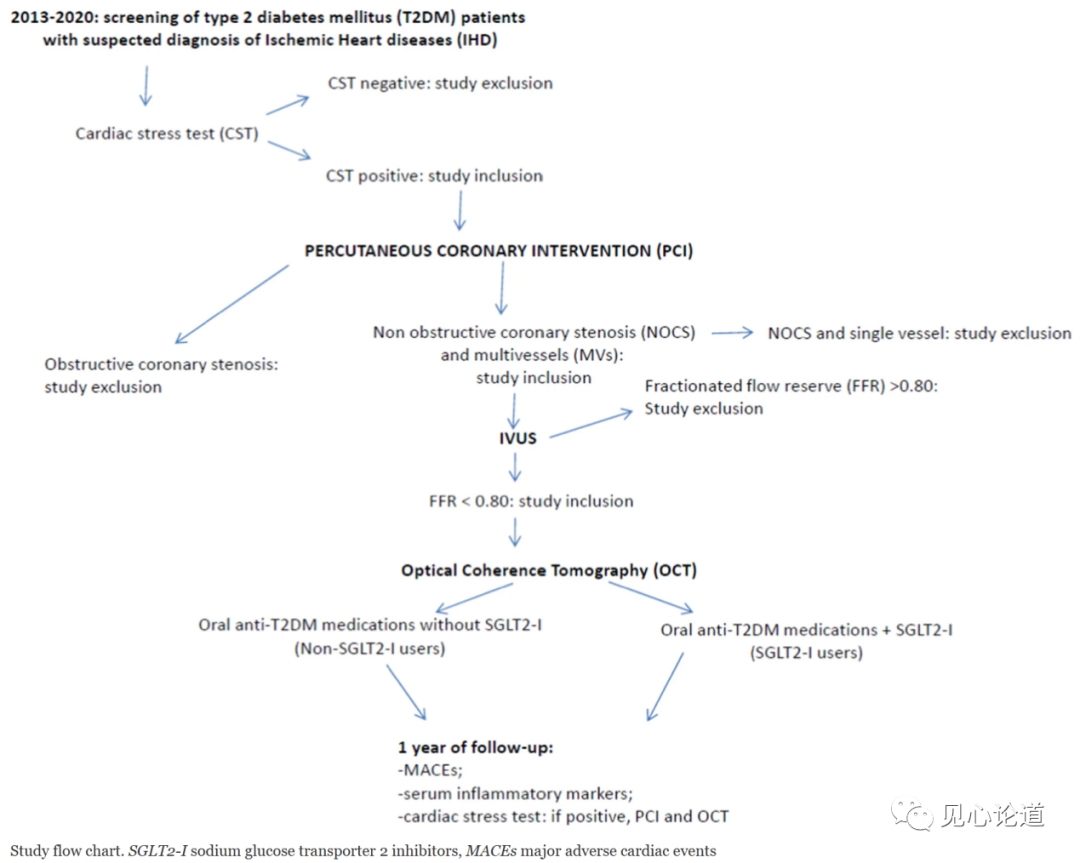
研究结果
研究者利用OCT高精度地测量冠脉斑块纤维帽厚度和脂质弧度(图2)。图中上半部分为SGLT2-I治疗组(A,左半部分)与非SGLT2-I治疗组(B,右半部分)患者纤维帽厚度(FCT)和脂质弓在基线水平的代表性图像。图的下半部分为SGLT2-I治疗组(E,左上部分)与非SGLT2-I治疗组(F,右上部分)的纤维帽厚度(FCT)和脂质弓在随访结束时的代表性图像。
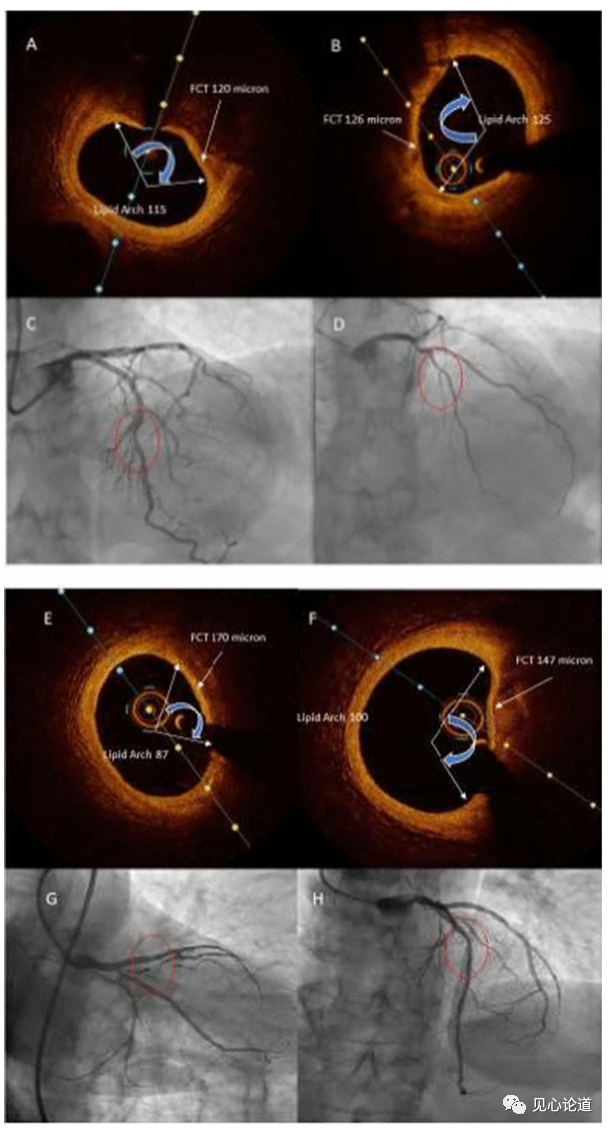
图2:OCT测量冠脉斑块纤维帽厚度和脂质弧度
基线时,SLGT2-I治疗组(111例)与非SLGT2-I治疗组(258例)在临床特征、炎症标志物、药物治疗和OCT数据方面没有显著差异(表1)。基线时,没有证据表明以冠状动脉造影评估的参数在两组间有显著差异,例如靶病灶[LAD: 42(37.8%) vs 95 (36.8%); LCX: 19 (17.1%) vs. 52 (20.2%); RCA: 50 (45%) vs 111 (43%); P=0.733],管腔面积(11.96±2.80 vs 11.58±2.58 mm2) ; P=0.123),平均参考直径(2.65±0.55 vs 2.59±0.48 mm; P=0.325),狭窄直径百分比(45.12±11.25 vs 43.56±10.94%; P=0.215), FFR(0.82±0.65 vs 0.83±0.58%; p 0.364)。
在随访6个月时,SGLT2-I治疗组与非SGLT2-I治疗组相比,体重指数(BMI)、血糖、Hb1Ac、BNP、炎症细胞(白细胞、粒细胞、单核细胞)和炎性分子[C反应蛋白(CRP)、IL-6、肿瘤坏死因子α (TNFα)、硝基酪氨酸]的值均较低(p < 0.05; 表1)。
在随访12个月时,SGLT2-I治疗组与非SGLT2-I治疗组相比,BMI、血糖、Hb1Ac、BNP值、炎症细胞(白细胞、粒细胞、单核细胞)和炎性分子(CRP、IL-6、TNFα、硝基酪氨酸)更低且差异更显著(p < 0.05;表1);最小FCT值更高,脂质弧度和巨噬细胞分级值更低(p < 0.05; 表1);且在随访结束时,SGLT2-I治疗组的MACEs发生率较低[n=12(10.8%) vs n=57 (22.1%); p < 0.05]。
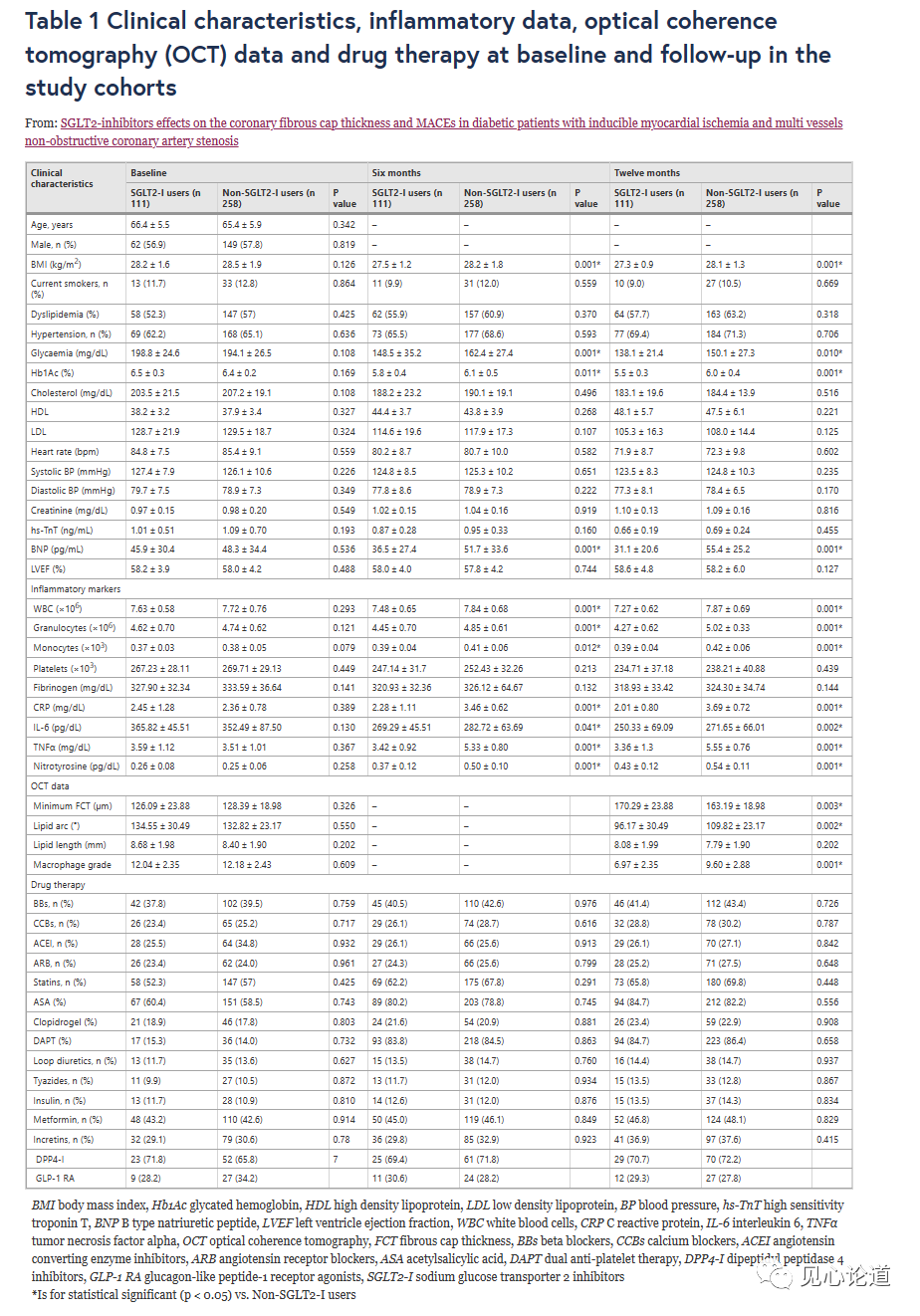
表1:队列的临床特征、炎症指标、光学相干断层扫描(OCT)数据以及基线和随访时的药物治疗
Cox回归分析显示,Hb1Ac(1.930,[CI 95%: 1.149-2.176])、巨噬细胞分级(1.188,[CI 95%: 1.073-1.315])和SGLT2-I治疗(0.342,[CI 95%: 0.180-0.651])是1年随访时MACEs的独立预测因子(表2)。
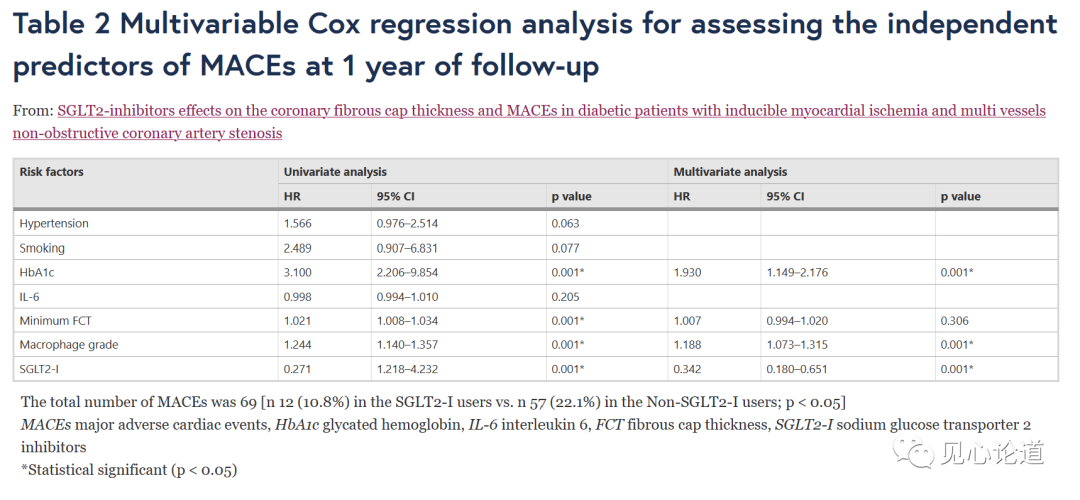
表2:多因素Cox回归分析评估随访1年时MACEs的独立预测因素Kaplan曲线显示了SGLT2-I治疗组与非SGLT2-I治疗组在1年随访时发生MACEs的累积风险(图3)
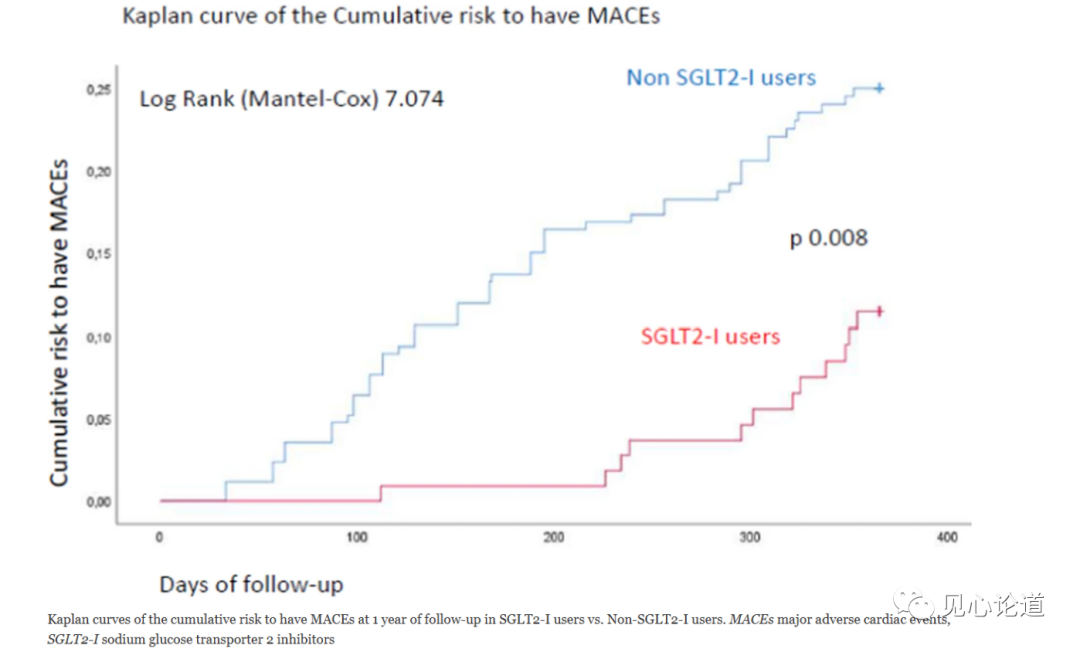
图图3:SGLT2-I治疗组与非SGLT2-I治疗组在随访1年时发生MACEs累积风险的Kaplan曲线
在T0(基线)时,SGLT2-I治疗组与非SGLT2-I治疗组的血清NLRP3炎性小体(31±6 vs. 34±8 pg/mL, p > 0.05),caspase-1(4±1 vs. 4±2 ng/mL, p > 0.05)和IL-1β(44±10 vs. 42±10 pg/mL, p > 0.05)水平无显著差异(图4)。在T1时,与同一时间点的SGLT2治疗组相比,SGLT2非治疗组的以上三种与炎症反应相关的血清标志物(NLRP3炎性小体、caspase-1、IL-1β)均显著增加(p < 0.05;图4)。同样的现象在T2和T3时间点(随访6个月和12个月)也存在(p < 0.05;图4)。
关于M1/M2巨噬细胞极化(炎症细胞表达)的血清标志物,在T0时,SGLT2-I治疗组与非SGLT2-I治疗组相比,M1巨噬细胞标志物CD86(415±68比412±72 U/mL, p > 0.05)和M2巨噬细胞标志物CD206(835±97比785±100 ng/mL, p > 0.05)在血清中无显著差异(图4)。从T1开始,非SGLT2-I治疗组的血清CD86水平高于SGLT2治疗组(p < 0.05;图4)。在随后的所有时间点,非SGLT2-I治疗组的CD206水平也较低(p < 0.05;图4)。
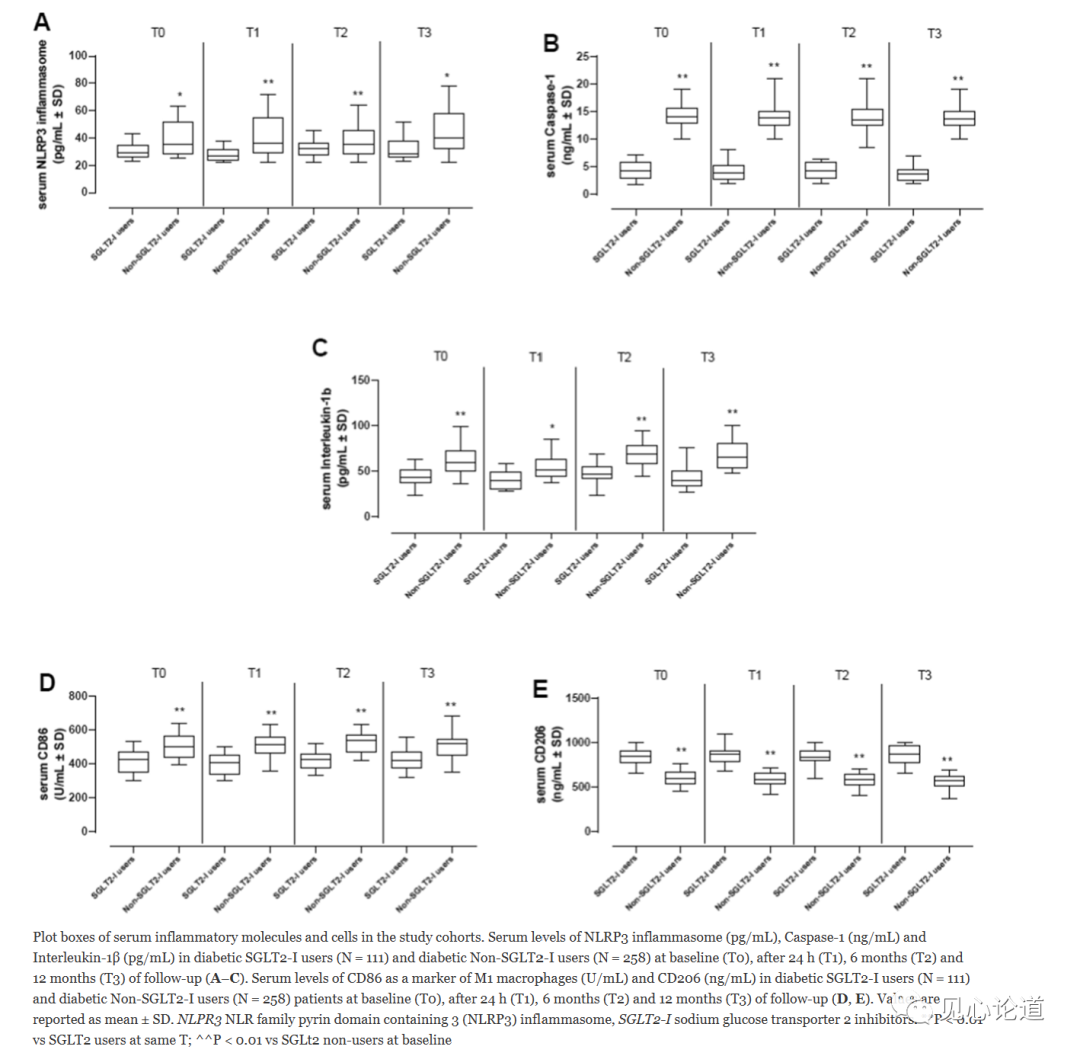
图4:炎症分子和免疫细胞的血清学检测
结 论
SGLT2-I在合并多支冠脉病变的糖尿病患者中具有逆转斑块(抗炎、减少脂质负荷、增加纤维帽厚度)、降低MACEs发生风险的效果。
点评
在本项前瞻性队列研究中,研究者利用OCT高精度地测量冠脉斑块纤维帽厚度和脂质弧度,初步证明了SGLT2-I在合并多支冠脉病变的糖尿病患者中具有逆转斑块效果。然而,目前的研究也存在一些局限性。首先,患者没有随机接受SGLT2-I治疗,这可能导致研究偏倚。其次,1年的研究随访时间限制了研究结果的可推广性。第三,入组患者的数量可能会降低当前研究的有效性,降低研究主要终点和次要终点的统计学显著性。第四,在目前的研究中,无法确定一个明确的临界值来划分稳定与不稳定的冠状动脉粥样硬化斑块表型和/或预测其破裂和随之而来的不良临床事件。
