爱德华公司SAPIEN 3经导管主动脉瓣膜系统产品获得CFDA批准
2020-06-09 16:46
2020年6月8日,国家药品监督管理局经审查,批准了Edwards Lifesciences LLC生产的创新产品SAPIEN3“经导管主动脉瓣膜系统”注册。
该产品包括经导管主动脉瓣膜,经导管主动脉瓣膜输送系统,导管鞘套件,经股动脉球囊导管,瓣膜预置装置。瓣膜由牛心包瓣叶,钴铬合金瓣架,PET内外裙缘组成。用于治疗由心脏团队(包括心血管外科医师)决定的外科手术高危或禁忌的(例如:根据美国胸外科医师学会(STS)评分系统评估外科手术风险≥8%或手术30天死亡率≥15%)症状性的重度钙化性自体主动脉瓣狭窄的患者。
该产品采用了球囊扩张式技术,瓣架可提供高径向支撑力,低瓣架高度以适应于周围解剖结构,并尽可能降低起搏器植入风险;通过外层裙缘设计尽可能减少瓣周返流。预期临床应用瓣周漏发生率较低。
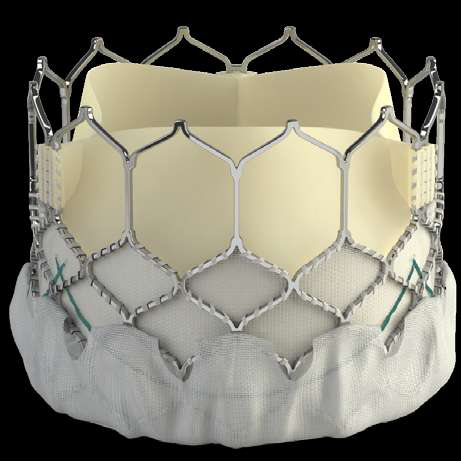
SAPIEN 3瓣膜
以SAPIEN3瓣膜为代表的球扩式TAVR技术在全球市场上占据着重要的主流地位,拥有坚实的以PARTNER系列试验为代表的循证医学证据和全球最广泛的应用,迄今为止全球植入逾45万例病人。最新公布的SAPIEN XT和SAPIEN 3瓣膜系列中国临床试验同样证实了它对于中国病人的优异疗效,SAPIEN3瓣膜将与国产的自膨式TAVR瓣膜一起,为中国心脏介入医生提供更全面更完善的TAVR治疗解决方案。
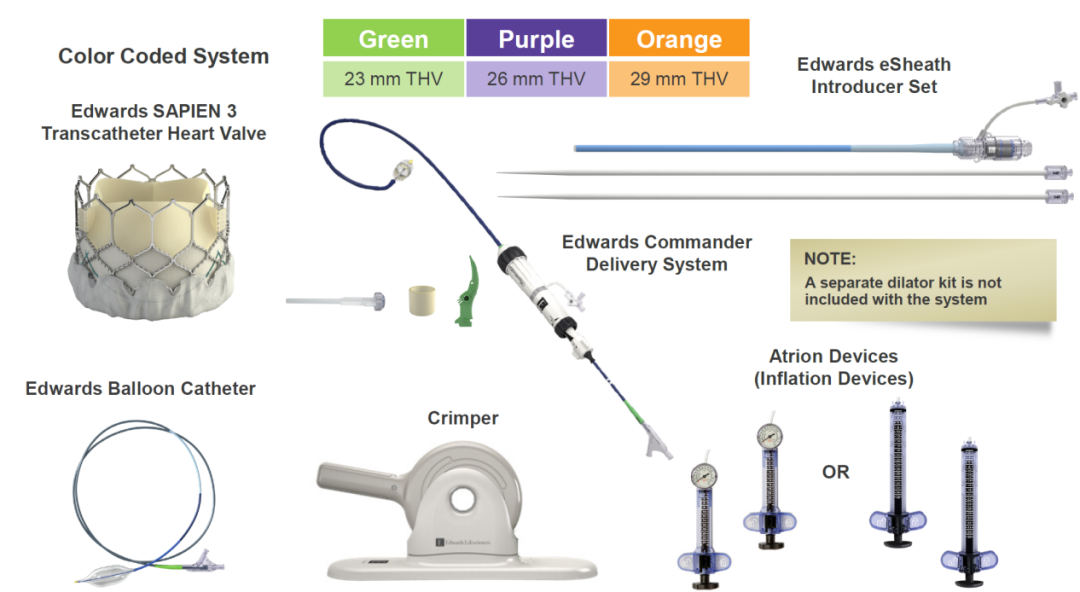
SAPIEN 3瓣膜系统